Modelul atomic Bohr
From Wikipedia, the free encyclopedia
Remove ads
Modelul atomic Bohr este primul model de natură cuantică al atomului și a fost introdus în anul 1913 de către fizicianul danez Niels Bohr. Acest model preia modelul planetar al lui Ernest Rutherford și îi aplică teoria cuantelor. Deși ipotezele introduse de către Bohr sunt de natură cuantică, calculele efective ale mărimilor specifice atomului sunt pur clasice, modelul fiind, de fapt, semi-cuantic. Modelul lui Bohr este aplicabil ionilor hidrogenoizi (He+, Li+2, Be+3, etc, adică ionii care au un singur electron în câmpul de sarcină efectivă a nucleului).
| Acest articol sau această secțiune are bibliografia incompletă sau inexistentă. Puteți contribui prin adăugarea de referințe în vederea susținerii bibliografice a afirmațiilor pe care le conține. |

Îmbunătățirea modelului Rutherford este în mare parte o interpretare fizică cuantică a acestuia. Succesul cheie al modelului constă în explicarea formulei Rydberg pentru liniile de emisie spectrală ale hidrogenului atomic. În timp ce formula Rydberg fusese cunoscută experimental, nu a avut o bază teoretică până la introducerea modelului Bohr. Modelul Bohr nu explică doar motivul pentru structura formulei Rydberg, ci și justificarea rezultatelor sale empirice în termeni de constante fizice fundamentale.[1]
Modelul Bohr este un model relativ primitiv al atomului de hidrogen, în comparație cu atomul învelișurilor de valență. Ca teorie, el poate fi derivat ca o aproximare de ordinul întâi a atomului de hidrogen utilizând mecanica cuantică mai largă și mai exactă și astfel poate fi considerat o teorie științifică depășită. Cu toate acestea, din cauza simplității sale și a rezultatelor sale corecte pentru sistemele selectate, modelul Bohr este încă învățat în mod obișnuit ca introducere în mecanica cuantică sau diagramele de nivel energetic înainte, de a trece la unul mai precis, atomul învelișurilor de valență. Un model asemănător a fost propus inițial de Arthur Erich Haas în 1910, dar a fost respins. Teoria cuantică a perioadei dintre descoperirea de către Planck a cuantei (1900) și apariția unei mecanici cuantice mature (1925) este adesea menționată ca vechea teorie cuantică.
Remove ads
Origine

La începutul secolului XX, experimentele lui Ernest Rutherford au stabilit că atomii constau dintr-un nor difuz de electroni încărcați negativ care înconjoară un nucleu mic, dens, încărcat pozitiv.[2] Având în vedere aceste date experimentale, Rutherford a considerat în mod firesc un atom ca model planetar, modelul Rutherford din 1911 - electroni care orbitează un nucleu solar - cu toate acestea, atomul ca model planetar a avut o dificultate tehnică. Legile mecanicii clasice (adică formula Larmor) prezic că electronul va elibera radiațiile electromagnetice în timp orbitează nucleul. Deoarece electronul ar pierde energie, ar fi atras în spirală rapid spre interior, prăbușindu-se în nucleu într-un interval de timp de 16 picosecunde.[3] Acest model de atom este dezastruos, deoarece prezice că toți atomii sunt instabili.[4]
De asemenea, pe măsură ce electronii cad în spirală în interior, emisia ar crește rapid în frecvență, pe măsură ce orbita ar deveni mai mică și mai rapidă. Aceasta ar produce o difuzie continuă, în frecvență, a radiației electromagnetice. Cu toate acestea, experimentele din secolul al XIX-lea cu descărcări electrice au arătat că atomii vor emite lumină (adică radiații electromagnetice) numai la anumite frecvențe discrete.
Pentru a depăși această dificultate, Niels Bohr a propus, în 1913, ceea ce se numește acum modelul lui Bohr al atomului. El a sugerat că electronii puteau avea doar anumite mișcări clasice:
- Electronii din atomi orbitează nucleul.
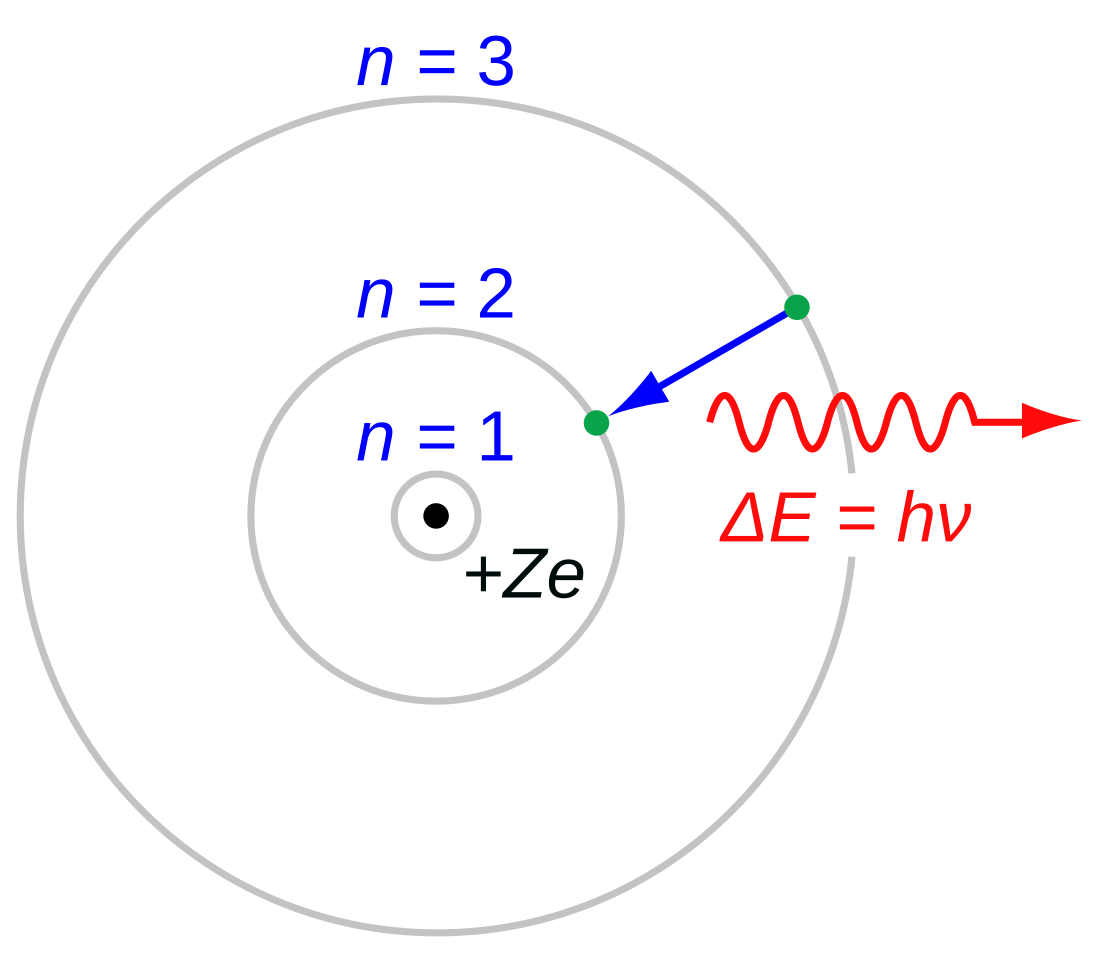
- Electronii pot orbita numai în mod stabil, fără a radia, pe anumite orbite (numite de Bohr "orbite staționare" [5]) la un anumit set discret de distanțe față de nucleu. Aceste orbite sunt asociate cu energii definite și sunt denumite, de asemenea, învelișuri de energie sau niveluri de energie. În aceste orbite, accelerația electronului nu are ca rezultat radiații și pierderi de energie, așa cum este cerut de electromagneții clasici. Modelul lui Bohr al unui atom se bazează pe teoria cuantică a radiației Planck.
- Electronii pot câștiga și pierde energie doar sărind de la o orbită permisă la alta, absorbind sau emițând radiații electromagnetice cu o frecvență ν determinată de diferența energetică a nivelelor în relația Planck:
- unde h este constanta lui Planck. Frecvența radiației emise pe orbita perioadei T este la fel ca în mecanica clasică; este reciproca perioadei clasice a orbitei:
- 4. Momentul unghiular, L, a electronului care orbitează, este cuantificat astfel încât
- unde n = 1, 2, 3, ... se numește numărul cuantic principal si ħ = h/2π. Valoarea cea mai mică a lui n este 1; aceasta oferă cea mai mică rază orbitală posibilă, de 0,0529 nm, cunoscută sub numele de raza Bohr. Odată ce un electron se află în cea mai mică orbită, nu se poate apropia de proton. Pornind de la regula cuantică a momentului unghiular, Bohr[2] a reușit să calculeze energiile orbitelor permise ale atomului de hidrogen și ale altor atomi și ioni asemănători hidrogenului.
Alte puncte sunt:
- Ca și în teoria lui Einstein a efectului fotoelectric, formula lui Bohr presupune că în timpul unui salt cuantic se emite o cantitate discretă de energie. Cu toate acestea, spre deosebire de Einstein, Bohr a rămas la teoria clasică Maxwell a câmpului electromagnetic. Cuantificarea câmpului electromagnetic a fost explicată prin discrepanța nivelurilor energiei atomice; Bohr nu a crezut în existența fotonilor.
- Conform teoriei lui Maxwell, frecvența ν a radiației clasice este egală cu frecvența de rotație νrot a electronului în orbita sa, cu armonici la multiplii întregi ai acestei frecvențe. Acest rezultat este obținut din modelul Bohr pentru salturi între nivelele energetice En și En-k atunci când k este mult mai mic decât n. Aceste salturi reproduc frecvența armonicei k a orbitei n. Pentru valori suficient de mari ale lui n (așa-numitele stări Rydberg), cele două orbite implicate în procesul de emisie au aproape aceeași frecvență de rotație, astfel încât frecvența orbitală clasică nu este ambiguă. Dar pentru n (sau k mare) mic, frecvența radiațiilor nu are o interpretare clasică clară. Aceasta marchează nașterea principiului corespondenței, cerând ca teoria cuantică să fie de acord cu teoria clasică numai în limita numerelor cuantice mari.
- Teoria Bohr-Kramers-Slater (teoria BKS) este o încercare eșuată de a extinde modelul Bohr, care încalcă conservarea energiei și a impulsului în salturi cuantice, legile de conservare păstrându-se doar în medie.
Condiția lui Bohr, conform căreia momentul unghiular este un multiplu întreg al lui ħ, a fost reinterpretat în 1924 de către de Broglie ca o condiție de undă staționară: electronul este descris de o undă și un număr întreg de lungimi de undă trebuie să se potrivească de-a lungul circumferinței orbitei electronului:
Bohr a descris un moment unghiular al orbitei de electroni ca 1/2h în timp ce lungimea de undă a lui de Broglie λ = h/p descria h împărțită la impulsul electronului. În 1913, totuși, Bohr și-a justificat regula apelând la principiul corespondenței, fără a oferi niciun fel de interpretare a undelor. În 1913, comportamentul ondulatoriu al particulelor de materie, cum ar fi electronul (adică undele de materie), nu a fost bănuit.
În 1925, a fost propus un nou tip de mecanică, mecanica cuantică, în care modelul de electroni al lui Bohr care se deplasa pe orbite cuantificate a fost extins la un model mai precis al mișcării electronilor. Noua teorie a fost propusă de Werner Heisenberg. O altă formă a aceleiași teorii, mecanica ondulatorie, a fost descoperită independent de fizicianul austriac Erwin Schrödinger prin raționamente diferite. Schrödinger a folosit undele de materie de Broglie, dar a căutat soluții de undă cu o ecuație tridimensională a undelor care descrie electronii care erau constrânși să se deplaseze în jurul nucleului unui atom de tip hidrogen, fiind reținuți de potențialul încărcăturii nucleare pozitive.
Remove ads
Postulatele lui Bohr
Modelul atomic al lui Bohr se bazează pe două postulate:
Primul postulat al lui Bohr
Este legat de orbitele atomice și presupune că electronul se rotește în jurul nucleului numai pe anumite orbite circulare permise, fără a emite sau a absorbi energie radiantă. Aceste stări se numesc staționare și au un timp de viață infinit și energie constantă, electronul trecând pe alte nivele energetice doar dacă este perturbat din exterior. Electronul se menține pe o orbită staționară datorită compensării forței centrifuge cu forța de atracție coulombiană.
Primul postulat a fost introdus pentru explicarea stabilității atomului. El este în contradicție cu fizica clasică. Conform teoriilor acesteia, o sarcină electrică în mișcare accelerată emite radiație electromagnetică. Aceasta ar duce la scăderea energiei sistemului, iar traiectoria circulară a electronului ar avea raza din ce în ce mai mică, până când acesta ar "cădea" pe nucleu. Experimental se constată, însă, că atomul este stabil și are anumite stări în care energia sa se menține constantă.
Al doilea postulat al lui Bohr
Afirmă faptul că un atom emite sau absoarbe radiație electromagnetică doar la trecerea dintr-o stare staționară în alta. Energia pe care o primește sau o cedează este egală cu diferența dintre energiile celor două nivele între care are loc tranziția. Radiația emisă sau absorbită are frecvența dată de relația obținută în cadrul teoriei lui Max Planck:
unde:
- reprezintă constanta lui Planck;
- frecvența radiației emise/absorbite;
- energiile stărilor staționare între care are loc tranziția.
Atomul trece dintr-o stare staționară în alta cu energie superioară doar dacă i se transmite o cuantă de energie corespunzătoare diferenței dintre cele două nivele. La revenirea pe nivelul inferior se emite o radiație de aceeași frecvență ca și la absorbție. Acest fapt exprimă natura discontinuă a materiei și energiei la nivel microscopic. De asemenea, frecvențele radiațiilor atomice depind de natura și structura atomului și au valori discrete, spectrele lor fiind spectre de linii.
Remove ads
Condiția de cuantificare
Cuantificarea momentului cinetic
Condiția de cuantificare se exprimă, de obicei, în legătură cu momentul cinetic al electronului aflat în mișcare circulară pe o orbită în interiorul atomului.
unde
- este un număr întreg, numit număr cuantic principal;
- reprezintă constanta redusă a lui Planck.
Condiția rezultă din primul postulat al lui Bohr, considerând ipoteza lui de Broglie referitoare la dualismul undă-particulă. Pentru un atom aflat într-o stare staționară, electronul trebuie să se deplaseze pe o orbită stabilă, adică unda sa asociată sa fie staționară. Acest lucru este posibil dacă lungimea traiectoriei electronului este un multiplu al lungimii de undă a undei asociate. Dacă este raza traiectoriei, condiția se poate scrie:
Aplicând ipoteza lui de Broglie se obține:
- unde simbolizează impulsul electronului.
De aici, .
Cuantificarea razelor orbitelor electronilor
Pornind de la aceasta și considerând egalitatea forțelor de atracție electrostatică cu cele centrifuge, se poate deduce condiția pentru cuantificarea razelor orbitelor electronilor. Pentru atomul de hidrogen (Z=1) se obține:
unde mărimile reprezintă:
- , permitivitatea electrică a vidului;
- , constanta lui Planck;
- , masa electronului;
- , sarcina electronului;
- , raza corespunzătoare numărului cuantic , numită și prima rază Bohr.
Relația exprimă faptul că un electron se poate deplasa doar pe anumite orbite în cadrul atomului, raza acestora crescând cu pătratul numărului cuantic principal .
Cuantificarea energiei totale
În modelul planetar, nucleul este considerat fix, iar energia totală a atomului este dată de suma energiilor cinetice și potențiale ale electronului aflat în mișcare circulară. Introducând cuantificarea razei calculată de Bohr în expresia energiei, se obține pentru atomul de hidrogen:
unde cu se notează energia atomului de hidrogen în stare fundamentală . Se observă că energia este minimă pentru , adică starea fundamentală este o stare de echilibru și are un timp de viață infinit. În acest caz, energia de legatură a electronului este maximă, fiind egală cu valoarea absolută a energiei unei stări legate. Celelalte stări se numesc stări excitate. Atomul are o infinitate de nivele de energie situate la intervale din ce în ce mai apropiate. La limită, pentru , energia tinde la valoarea zero. Valorile pozitive ale energiei sunt continue, iar electronul se deplasează liber pe o traiectorie deschisă, în afara nucleului.
Remove ads
Deficiențe ale modelului
Acest model nu poate explica spectrele de emisie și energia de ionizare decât pentru atomul de hidrogen și ionii hidrogenoizi. Nu a putut fundamenta științific spectrele unor atomi grei. Nu a putut explica formarea legăturilor duble. Nu a putut fundamenta scindarea liniilor spectrale într-un câmp perturbator.
Aceste deficiente au fost rezolvate prin apariția modelului atomic Bohr-Sommerfeld - modelul precuantic.
Remove ads
Note
Legături externe
Vezi și
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads