A ariranha (nome científico: Pteronura brasiliensis), também conhecida popularmente como onça-d'água,[2] lontra-gigante e lobo-do-rio, é um mamífero mustelídeo, característico do Pantanal e da bacia do Rio Amazonas, na América do Sul.[3] É o membro de maior comprimento dentre os mustelídeos, um grupo de predadores de sucesso global, alcançando até 1,7 metro (5,6 pés). Atípica dos mustelídeos, uma ariranha é uma espécie social, com grupos familiares sustentando de três a oito membros. Os grupos estão centrados em um par reprodutor dominante e são extremamente coesos e cooperativos. Embora geralmente pacífica, a espécie é territorialista, e a agressão foi observada entre os grupos. É diurna, sendo ativa exclusivamente durante o dia. É a espécie de lontra mais barulhenta e foram documentadas vocalizações distintas que indicam alarme, agressão e segurança.
| Ariranha | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Estado de conservação | |||||||||||||||||
 Em perigo (IUCN 3.1) [1] | |||||||||||||||||
| Classificação científica | |||||||||||||||||
| |||||||||||||||||
| Nome binomial | |||||||||||||||||
| Pteronura brasiliensis (Gmelin, 1788) | |||||||||||||||||
| Distribuição geográfica | |||||||||||||||||
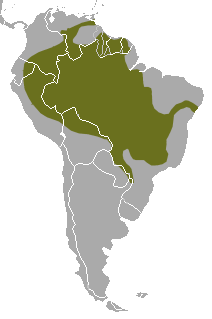 Distribuição da ariranha na América do Sul | |||||||||||||||||
Sua distribuição foi bastante reduzida e agora é descontínua. Décadas de caça furtiva para obter sua pele aveludada, com pico nas décadas de 1950 e 1960, diminuíram consideravelmente o número da população. Foi listada como ameaçada de extinção em 1999 e as estimativas da população selvagem são normalmente abaixo de 5 000. As Guianas são um dos últimos verdadeiros redutos da espécie, que também goza de números modestos - e proteção significativa - na bacia amazônica peruana. É uma das espécies de mamíferos mais ameaçadas da região neotropical. A degradação e perda de habitat é a maior ameaça atual. Também é rara em cativeiro; em 2003, apenas 60 animais estavam detidos.[4]
A ariranha mostra uma variedade de adaptações adequadas a um estilo de vida anfíbio, incluindo pelo excepcionalmente denso, cauda em forma de asa e pés palmados. Prefere rios e riachos de água doce, que geralmente são inundados sazonalmente, e também podem levar a lagos e nascentes de água doce. Constrói extensos acampamentos próximos às áreas de alimentação, eliminando grande quantidade de vegetação. Sobrevive quase exclusivamente com uma dieta de peixes, principalmente caraciformes e bagres, mas também pode comer caranguejos, tartarugas, cobras e pequenos jacarés.[1] Não tem predadores naturais sérios além do homem, embora precise competir com outros predadores, como a lontra-neotropical, a onça-pintada e várias espécies de crocodilo, por recursos alimentares.
Etimologia
"Ariranha" provém do termo tupi-guarani ari'raña que significa "onça d'água".[2] No espanhol "lobo do rio" (lobo de río) e cachorro d'água (perro de agua) são usados ocasionalmente (embora este último também se refira a vários animais diferentes), e podem ter sido mais comuns nos relatos de exploradores espanhóis do século XIX e início do XX.[5] Todos os três nomes são usados na América do Sul com uma série de variações regionais, como lontra-gigante (português) e nutria-gigante (espanhol). Entre os achuares, são conhecidas como wankanim,[6] entre os ianomâmis como hadami[7][8] e entre os macuxis como turara.[9] O nome do gênero Pteronura deriva do grego antigo pteron/πτερον (pena ou asa) e ura/ουρά (cauda),[10] em referência a sua distinta cauda parecida com uma asa.[11]
Taxonomia
As lontras formam a subfamília dos lutríneos (Lutrinae) dentro da família dos mustelídeos e a ariranha é a única espécie do gênero Pteronura. Duas subespécies são reconhecidas pelo canônico Mammal Species of the World, P. b. brasiliensis e P. b. paraguensis. A descrição incorreta da espécie levou a vários sinônimos (a última subespécie é frequentemente chamada P. b. paranensis na literatura).[12] P. b. brasiliensis ocorre na porção norte da distribuição da ariranha, incluindo o rio Amazonas e os sistemas fluviais das Guianas. Ao sul, P. b. paraguensis teve ocorrência sugerida no Paraguai, Uruguai, sul do Brasil e norte da Argentina,[13] embora possa estar extinta nos últimos três locais. A UICN considera a presença na Argentina e Uruguai incerta.[1] Na Argentina, uma investigação mostrou remanescentes populacionais escassamente distribuídos.[14] P. b. paraguensis é supostamente menor e mais sociável, com dentição e morfologia craniana diferentes. Carter e Rosas, entretanto, rejeitaram a divisão subespecífica em 1997, observando que a classificação só foi validada uma vez, em 1968, e o espécime-tipo de P. b. paraguensis era muito similar a P. b. brasiliensis[15] A bióloga Nicole Duplaix chama a divisão de "valor duvidoso".[16]

Crê-se que um gênero extinto, o Satherium, era o ancestral da espécie, tendo migrado do Novo Mundo durante o Plioceno ou início do Pleistoceno.[11] A ariranha divide o continente sul-americano com três dos quatro membros do gênero Lontra: a lontra-neotropical, a Lontra provocax e a Lontra felina.[17] Parece ter evoluído de forma independente de Lontra na América do Sul, apesar da sobreposição. A Lutrogale perspicillata da Ásia pode ser seu parente mais próximo: comportamento, vocalizações e morfologia craniana similares foram observadas.[11] Ambas espécies também apresentam forte laço entre casais e empenho em criar os filhotes.[18] Restos fósseis de ariranha foram recuperados de uma caverna no Mato Grosso brasileiro.[19]
A análise filogenética de Koepfli e Wayne em 1998 descobriu que a ariranha tem as sequências de divergência mais altas dentro da subfamília da lontra, formando um clado distinto que se separou de 10 a 14 milhões de anos atrás. Observaram que as espécies podem ser a divergência basal entre as lontras ou sair fora delas, tendo se dividido antes mesmo de outros mustelídeos, como o arminho, a doninha e o vison.[11] Pesquisas posteriores de sequenciamento de DNA nos mustelídeos, em 2004, colocam a divergência da ariranha um pouco mais tarde, entre cinco e 11 milhões de anos atrás; a árvore filogenética correspondente localiza a divergência do gênero Lontra em primeiro lugar entre os gêneros dessa família, e Pteronura em segundo, embora as faixas de divergência se sobreponham.[20]
Características


A ariranha se distingue claramente das outras lontras por suas características morfológicas e comportamentais. Tem o maior comprimento corporal de todas as espécies da família dos mustelídeos, embora a lontra-marinha possa ser mais pesada. Os machos têm entre 1,5 e 1,7 metro (4,9 e 5,6 pés) de comprimento da cabeça à cauda e as fêmeas entre 1 e 1,5 metro (3,3 e 4,9 pés). A cauda bem musculosa do animal pode adicionar mais 70 centímetros (28 polegadas) ao comprimento total do corpo.[21][22] Os primeiros relatórios de peles e animais vivos sugeriram machos excepcionalmente grandes de até 2,4 metros (7,9 pés); a caça intensiva provavelmente reduziu a ocorrência de tais espécimes grandes. Os pesos são entre 26 e 32 quilos (57 e 71 libras) para machos e 22 e 26 quilos (49 e 57 libras) para fêmeas.[23] A ariranha tem o pelo mais curto de todas as espécies de lontra; normalmente é castanho chocolate, mas pode ser avermelhado ou fulvo e parece quase preto quando molhado.[24] O pelo é extremamente denso, tanto que a água não consegue penetrar na pele.[25] Proteger os pelos retêm água e manter a pele interna seca; os pelos externos têm aproximadamente 8 milímetros (um terço de polegada) de comprimento, cerca de duas vezes mais longos que o pelo da pelagem interna.[26] Seu toque aveludado torna o animal muito procurado pelos comerciantes de peles e tem contribuído para seu declínio.[27] Marcas exclusivas de pelo branco ou creme colorem a garganta e sob o queixo, permitindo que os indivíduos sejam identificados desde o nascimento.[24]
O focinho da ariranha é curto e inclinado e dá à cabeça uma aparência de bola.[16] As orelhas são pequenas e arredondadas.[25] O nariz (ou rinário) é completamente coberto por pelos, com apenas as duas narinas em fenda visíveis. Os bigodes altamente sensíveis da ariranha (vibrissas) permitem que rastreie as mudanças na pressão e nas correntes da água, o que auxilia na detecção de presas.[28] As pernas são curtas e atarracadas e terminam em grandes pés palmados com garras afiadas nas pontas. Bem adequado para uma vida aquática, pode fechar as orelhas e o nariz enquanto está debaixo d'água.[29]
Na época em que Carter e Rosas escreveram, a visão não tinha sido estudada diretamente, mas as observações de campo mostram que o animal caça principalmente pela visão; acima da água, é capaz de reconhecer observadores a grandes distâncias. O fato de ser exclusivamente ativo durante o dia sugere ainda que sua visão deve ser forte, para ajudar na caça e evitar predadores. Em outras espécies de lontras, a visão é geralmente normal ou ligeiramente míope, tanto na terra quanto na água. A audição da ariranha é aguda e seu olfato é excelente.[24][30] A espécie possui 2n = 38 cromossomos.[31]
Biologia e comportamento
A ariranha é grande, gregária e diurna. Os primeiros relatórios de viajantes descrevem grupos barulhentos em torno de barcos de exploradores, mas pouca informação científica estava disponível sobre a espécie até o trabalho pioneiro de Duplaix no final dos anos 1970.[32]
Vocalizações
A ariranha é um animal especialmente barulhento, com um complexo repertório de vocalizações. Todas as lontras produzem vocalizações, mas considerando frequência e volume, a ariranha pode ser a mais vocal.[33] Duplaix identificou nove sons distintos, com subdivisões adicionais possíveis, dependendo do contexto. Latidos rápidos ou roncos explosivos sugerem interesse imediato e possível perigo. Um grito vacilante pode ser usado em acusações de blefe contra intrusos, enquanto um rosnado baixo é usado para advertência agressiva. Murmúrios e arrulhos são mais reconfortantes dentro do grupo. Os apitos podem ser usados como um aviso prévio de intenção não hostil entre os grupos, embora as evidências sejam limitadas. Filhotes recém-nascidos guincham para chamar a atenção, enquanto jovens mais velhos gemem e choram quando começam a participar de atividades em grupo.[34] Uma análise publicada em 2014 catalogou 22 tipos distintos de vocalização em adultos e 11 em neonatos.[35] Cada família de lontras mostrou ter sua própria assinatura de áudio única.[36]
Estrutura social


A ariranha é um animal altamente social e vive em grupos familiares extensos. O tamanho dos grupos varia de dois a 20 membros, mas provavelmente em média entre quatro e oito.[13] (Grupos maiores podem refletir dois ou três grupos familiares alimentando-se temporariamente juntos.)[37] Os membros do grupo compartilham papéis, estruturados em torno do par reprodutor dominante. A espécie é territorialista, com grupos marcando suas fronteiras com latrinas, secreções glandulares e vocalizações.[38] Foi relatado pelo menos um caso de mudança no relacionamento alfa, com um novo homem assumindo o papel; a mecânica da transição não foi determinada.[39] Duplaix sugere uma divisão entre "residentes", que se estabelecem dentro de grupos e territórios, e "transitórios" nômades e solitários; as categorias não parecem rígidas e ambas podem ser uma parte normal do ciclo de vida da ariranha.[40] Uma teoria provisória para o desenvolvimento da sociabilidade em mustelídeos é que presas localmente abundantes, mas imprevisivelmente dispersas, causam a formação de grupos.[41]
A agressão dentro da espécie (conflito "intraespecífico") foi documentada. A defesa contra animais intrusos parece ser cooperativa: embora os machos adultos geralmente lidem com encontros agressivos, foram relatados casos de fêmeas alfa protegendo grupos.[39] Uma luta foi observada diretamente no Pantanal brasileiro, na qual três animais atacaram violentamente um único indivíduo próximo a um limite de área.[38] Em outra instância no Brasil, uma carcaça foi encontrada com claras indicações de agressão violenta por outras lontras, incluindo mordidas no focinho e genitais, um padrão de ataque semelhante ao exibido por animais em cativeiro.[42] Embora não seja raro entre grandes predadores em geral, a agressão intraespecífica é incomum entre as espécies de lontras; Ribas e Mourão sugerem uma correlação com a sociabilidade do animal, que também é rara entre outras lontras.[38] A capacidade de comportamento agressivo não deve ser exagerada com a ariranha. Os pesquisadores enfatizam que, mesmo entre grupos, a prevenção de conflitos é geralmente adotada.[43][44] Dentro dos grupos, os animais são extremamente pacíficos e cooperativos. Hierarquias de grupo não são rígidas e os animais facilmente compartilham papéis.[45]
Reprodução e ciclo de vida
As ariranhas constroem tocas, que são buracos cavados nas margens dos rios, geralmente com várias entradas e várias câmaras dentro. Dão à luz dentro dessas tocas durante a estação seca. No Parque Estadual do Cantão, cavam suas tocas reprodutivas nas margens de braços mortos a partir de julho, quando as águas já estão bastante baixas. Dão à luz entre agosto e setembro, e os filhotes emergem pela primeira vez em outubro e novembro, que são os meses de menor nível de água, quando as concentrações de peixes nos lagos e canais cada vez mais escassos estão no auge. Isso torna mais fácil para os adultos pegarem peixes suficientes para os filhotes em crescimento e para os filhotes aprenderem a pescar. Todo o grupo, incluindo adultos não reprodutivos, que geralmente são irmãos mais velhos dos filhotes daquele ano, colaboram para pegar peixes suficientes para os filhotes.[46]
Detalhes sobre a reprodução e o ciclo de vida da ariranha são escassos, e animais em cativeiro forneceram muitas informações. As fêmeas parecem dar à luz durante todo o ano, embora na natureza, os nascimentos possam atingir o pico durante a estação seca. O ciclo estral é de 21 dias, com as fêmeas receptivas a avanços sexuais entre três e dez dias.[47] O estudo de espécimes em cativeiro revelou que apenas os machos iniciam a cópula. No Tierpark Hagenbeck, na Alemanha, foram observadas relações de longo prazo entre pares e seleção individualizada de parceiros, com a cópula ocorrendo com mais frequência na água. As fêmeas têm um período de gestação de 65 a 70 dias, dando à luz de um a cinco filhotes, com uma média de dois.[47][48] Pesquisa de cinco anos em um casal reprodutor no Zoológico de Cali, na Colômbia, descobriu que o intervalo médio entre as ninhadas era de seis a sete meses, mas tão curto quanto 77 dias quando a ninhada anterior não sobreviveu.[4] Outras fontes encontraram intervalos maiores, com até 21 a 33 meses sugeridos para lontras na natureza.[47]


As mães dão à luz filhotes peludos e cegos em uma toca subterrânea perto da margem do rio e de locais de pesca.[49] Os machos participam ativamente da criação dos filhotes e a coesão familiar é forte;[50] irmãos mais velhos e jovens também participam da criação, embora nas semanas imediatamente após o nascimento, podem deixar temporariamente o grupo.[47] Os filhotes abrem os olhos na quarta semana, começam a andar na quinta e são capazes de nadar com segurança entre 12 e 14 semanas de idade.[4] São desmamados aos nove meses e começam a caçar com sucesso logo depois. O animal atinge a maturidade sexual por volta dos dois anos de idade (análises histológicas dos testículos indicam que, nessa faixa etária, os machos já apresentam espermatozoides no interior dos túbulos seminíferos e epidídimo.[51]) e os filhotes machos e fêmeas deixam o grupo permanentemente após dois a três anos;[47][48] Então procuram um novo território para começar uma família própria.[52]
A ariranha é muito sensível à atividade humana ao criar seus filhotes. Nenhuma instituição, por exemplo, cria filhotes de ariranha com sucesso, a menos que os pais tenham medidas de privacidade suficientes; o estresse causado pela interferência visual e acústica humana pode levar ao abandono, ao abuso e ao infanticídio, bem como à diminuição da lactação. Na natureza, foi sugerido, embora não sistematicamente confirmado, que os turistas causam estresses semelhantes: interrupção da lactação e fuga para tocas, caça reduzida e abandono do habitat são todos riscos.[52] Essa sensibilidade é acompanhada por uma forte proteção para com os jovens. Todos os membros do grupo podem atacar agressivamente os intrusos, incluindo barcos com humanos.[53]
A maior longevidade documentada de ariranha na natureza é de oito anos. Em cativeiro, esse número pode aumentar para 17, com um registro não confirmado de 19.[52] Um estudo realizado pelo Instituto Nacional de Pesquisas da Amazônia (INPA) com animais que viveram em cativeiro demonstrou, por meio das contagens de Grupos de Camadas de Crescimento (GLGs) presentes no cemento dos dentes caninos, que as ariranhas podem atingir 20 anos de idade.[54] O animal é suscetível a uma variedade de doenças, incluindo parvovírus canino. Parasitas, como larvas de moscas e uma variedade de vermes intestinais, também afligem a ariranha.[52] Outras causas de morte incluem acidentes, gastroenterite, infanticídio e convulsões epilépticas.[47]
Caça e dieta


A ariranha é um superpredador, e seu estatuto populacional reflete a saúde geral dos ecossistemas ribeirinhos.[55] Alimenta-se principalmente de peixes, incluindo ciclídeos, caraciformes (como a piranha) e bagres. Um estudo de um ano de fezes na Amazônia brasileira encontrou peixes presentes em todas as amostras fecais. Peixes da ordem Perciformes, principalmente ciclídeos, foram vistos em 97% das fezes, e Caraciformes, como os caracídeos, em 86%. Os restos de peixes eram de espécies de tamanho médio que parecem preferir águas relativamente rasas, para a vantagem da ariranha que provavelmente se orienta visualmente. As espécies de presas encontradas também eram sedentárias, geralmente nadando apenas a distâncias curtas, o que pode ajudar a ariranha na predação. A caça em águas rasas também foi considerada mais recompensadora, com a profundidade da água inferior a 0,6 metros (2,0 pés) tendo a maior taxa de sucesso.[56] A ariranha parece ser oportunista, pegando todas as espécies que são mais abundantes localmente.[57] Se não houver peixes disponíveis, também captura caranguejos, cobras e até pequenos jacarés e sucuris.[58]
A espécie pode caçar sozinhas, em pares e em grupos, contando com a visão aguçada para localizar a presa.[59] Em alguns casos, a suposta caça cooperativa pode ser acidental, resultado de membros do grupo pescando individualmente nas proximidades; a caça verdadeiramente coordenada só pode ocorrer onde a presa não pode ser capturada por uma única ariranha, como sucuris e jacarés-açus juvenis.[44] A ariranha parece preferir peixes forrageiros que geralmente são imóveis no fundo dos rios em águas claras. A perseguição de presas é rápida e tumultuada, com investidas e reviravoltas na parte rasa e poucos alvos perdidos. A ariranha pode atacar por cima e por baixo, girando no último instante para prender a presa em suas mandíbulas. As ariranhas pegam seu próprio alimento e o consomem imediatamente; agarram o peixe firmemente entre as patas dianteiras e começam a comer ruidosamente na cabeça.[59] Carter e Rosas descobriram que animais adultos em cativeiro consomem cerca de 10% de seu peso corporal diariamente - cerca de 3 quilos (7 libras), de acordo com as descobertas na natureza.[60]
Ecologia
Habitat

A espécie é anfíbia, embora principalmente terrestre.[61] Ocorre em rios e córregos de água doce, que geralmente inundam sazonalmente. Outros habitats aquáticos incluem nascentes de água doce e lagos de água doce permanentes.[1] Quatro tipos específicos de vegetação ocorrem em um riacho importante no Suriname: floresta alta às margens do rio, pântano misto inundável e floresta de pântano alto, floresta de pântano baixo inundável e ilhas de grama e prados flutuantes em áreas abertas do próprio riacho.[61] Duplaix identificou dois fatores críticos na seleção de habitat: abundância de alimentos, que parece se correlacionar positivamente com águas rasas, e margens baixas com boa cobertura e fácil acesso aos tipos de água preferidos. A ariranha parece escolher águas límpidas e negras com fundos rochosos ou arenosos ao invés de siltosas, salinas e brancas.[62]
Ariranhas usam áreas ao lado de rios para construir tocas, acampamentos e latrinas.[63] Limpam uma quantidade significativa de vegetação durante a construção de seus acampamentos. Um relatório sugere áreas máximas de 28 metros (92 pés) de comprimento e 15 metros (49 pés) de largura, bem marcadas por glândulas odoríferas, urina e fezes para sinalizar o território.[17] Carter e Rosas encontraram áreas médias com um terço desse tamanho. As ariranhas adotam latrinas comunitárias ao lado dos acampamentos e cavam tocas com um punhado de entradas, geralmente sob o sistema de raízes ou árvores caídas. Um relatório encontrou entre três e oito locais de acampamento, agrupados em torno de áreas de alimentação. Em áreas inundadas sazonalmente, pode abandonar os acampamentos durante a estação chuvosa, dispersando-se em florestas inundadas em busca de presas.[64] Podem adotar locais preferidos perenemente, geralmente em terrenos elevados. Podem se tornar bastante extensos, incluindo saídas "pelos fundos" em florestas e pântanos, longe da água.[61] Não visitam ou marcam todos os locais diariamente, mas geralmente patrulham todos, pela manhã.[65]
A pesquisa geralmente ocorre na estação seca e uma compreensão do uso geral do habitat da espécie permanece parcial. Uma análise do tamanho do intervalo da estação seca para três grupos de lontras no Equador encontrou áreas entre 0,45 e 2,79 quilômetros quadrados (0,17 e 1,08 milhas quadradas). Utreras[63] presumiu que os requisitos e disponibilidade de habitat difeririam dramaticamente na estação chuvosa: estimando tamanhos de alcance de 1,98 a 19,55 quilômetros quadrados (0,76 a 7,55 milhas quadradas) para os grupos. Outros pesquisadores sugerem aproximadamente 7 quilômetros quadrados (2,7 mi quadrados) e observam uma forte correlação inversa entre a sociabilidade e o tamanho da área de vida; a altamente social ariranha tem tamanhos menores de área de vida do que seria esperado para uma espécie de sua massa.[41] As densidades populacionais variaram com um máximo de 1,2 por quilômetro quadrado (3,1 por metro quadrado) relatado no Suriname e com um mínimo de 0,154 por quilômetro quadrado (0,40 por metro quadrado) encontrado na Guiana.[13] Em 2021, conservacionistas da Fundação Rewilding avistaram uma ariranha selvagem nadando no rio Bermejo no Parque Nacional Impenetrável, localizado na província de Chaco, no nordeste da Argentina.[66]
Predação e competição
Ariranhas adultas que vivem em grupos familiares não têm predadores naturais sérios conhecidos, no entanto, existem alguns relatos de jacarés-açus no Peru e jacarés-do-pantanal no Pantanal atacando ariranhas.[60] Além disso, animais solitários e filhotes podem ser vulneráveis a ataques de onça-pintada, onça-parda e sucuri, mas isso é baseado em relatos históricos, não em observação direta.[67] Os filhotes são mais vulneráveis e podem ser capturados por jacarés e outros grandes predadores,[52] embora os adultos estejam constantemente atentos aos filhotes perdidos e assediem e lutem contra possíveis predadores. Quando na água, a ariranha enfrenta o perigo de animais que não a atacam estritamente: a enguia elétrica e a arraia são potencialmente mortais se forem encontradas, e a piranha pode ser capaz de pelo menos dar mordidas em uma ariranha, como evidenciado por cicatrizes em indivíduos.[68]
Mesmo sem predação direta, ainda precisa competir com outros predadores por recursos alimentares. Duplaix documentou a interação com a lontra-neotropical.[69] Embora as duas espécies sejam simpátricas (com intervalos sobrepostos) durante certas estações, não parecia haver conflito sério. A lontra neotropical menor é muito mais tímida, menos barulhenta e menos social; com cerca de um terço do peso da ariranha, é mais vulnerável à predação, portanto, a falta de visibilidade é uma vantagem. A lontra neotropical está ativa durante o crepúsculo e a escuridão, reduzindo a probabilidade de conflito com a ariranha gigante diurna.[70] Suas presas menores, diferentes hábitos de definhamento e diferentes tipos de água preferidos também reduzem a interação.[60]
Outras espécies que se alimentam de recursos alimentares semelhantes incluem os jacarés e peixes grandes que são piscívoros. Os gimnotídeos gimnotídeos, como a enguia-elétrica, e o grande bagre silurídeo, estão entre os competidores aquáticos. Dois golfinhos de rio, o tucuxi e o boto, podem potencialmente competir com a ariranha, mas diferentes usos espaciais e preferências dietéticas sugerem uma sobreposição mínima. Além disso, Defler observou associações entre ariranhas e botos-cor-de-rosa, e sugeriu que os golfinhos podem se beneficiar com a fuga de peixes das lontras.[60]
Estado de conservação
A União Internacional para a Conservação da Natureza (UICN) listou a ariranha como "ameaçada de extinção" em 1999; havia sido considerada "vulnerável" em todas as listagens anteriores de 1982, quando dados suficientes se tornaram disponíveis. É regulamentado internacionalmente pelo Apêndice I da Convenção sobre o Comércio Internacional das Espécies da Fauna e da Flora Silvestres Ameaçadas de Extinção (CITES): todo o comércio de espécimes e partes destes é ilegal.[71] Em 1975, o Brasil aderiu a uma convenção internacional que proibia o comércio de espécies ameaçadas, incluindo a ariranha. Desde então, por todo o mundo, a demanda por peles de animais diminuiu, permitindo que as ariranhas começassem a se recuperar. Os mais recentes indícios da recuperação da espécie foram divulgados em 2018.[72] No Brasil, em especial, a espécie figura em várias listas de conservação: em 2007, foi classificado como vulnerável na Lista de espécies de flora e fauna ameaçadas de extinção do Estado do Pará;[73] em 2010, como regionalmente extinto na Lista de Espécies Ameaçadas de Extinção da Fauna do Estado de Minas Gerais[74] e como criticamente em perigo no Livro Vermelho da Fauna Ameaçada no Estado do Paraná[75] em 2014, como regionalmente extinto na Lista das Espécies da Fauna Ameaçadas de Extinção no Rio Grande do Sul[76][77] e em perigo no Livro Vermelho da Fauna Ameaçada de Extinção no Estado de São Paulo;[78] em 2018, como vulnerável no Livro Vermelho da Fauna Brasileira Ameaçada de Extinção do Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio);[79] e como vulnerável no anexo dois (mamíferos) na Lista Oficial da Fauna Brasileira Ameaçada de Extinção da Portaria MMA N.º 148, de 7 de junho de 2022.[80][81]
Ameaças
O animal enfrenta uma variedade de ameaças críticas. A caça furtiva sempre foi um problema. As estatísticas mostram que, entre 1959 e 1969, a Amazônia brasileira sozinha contabilizou de 1 000 a 3 000 peles anualmente. A espécie foi completamente dizimada, o número caiu para apenas 12 em 1971. A implementação da CITES em 1973 finalmente trouxe reduções significativas na caça,[13] embora a demanda não tenha desaparecido completamente: na década de 1980, os preços das peles chegavam a $250 dólares no mercado europeu. A ameaça foi exacerbada pela relativa intrepidez e tendência das lontras para se aproximarem de seres humanos. São extremamente fáceis de caçar, sendo ativas durante o dia e altamente inquisitivas.[82] A maturidade sexual relativamente tardia e a vida social complexa do animal tornam a caça especialmente desastrosa.[13][83][84]
Mais recentemente, a destruição e degradação do habitat se tornaram os principais perigos, e uma redução adicional de 50% é esperada no número de ariranhas dentro de 20 anos após 2004 (cerca de três gerações).[1] Normalmente, os madeireiros vão primeiro para a floresta tropical, limpando a vegetação ao longo das margens dos rios. Os agricultores seguem, criando solo empobrecido e habitats destruídos. À medida que a atividade humana se expande, as áreas de vida das ariranhas tornam-se cada vez mais isoladas. Os subadultos que saem em busca de um novo território descobrem que é impossível formar grupos familiares.[85] Ameaças específicas da indústria humana incluem a exploração insustentável de mogno em partes da área da ariranha,[82] e as concentrações de mercúrio em sua dieta de peixes, um subproduto da mineração de ouro.[86][87]
Outras ameaças à ariranha incluem conflito com pescadores, que muitas vezes consideram a espécie um incômodo. O ecoturismo também apresenta desafios: ao mesmo tempo que aumenta o dinheiro e a conscientização dos animais, por sua natureza também aumenta o efeito humano sobre as espécies, tanto por meio do desenvolvimento associado quanto de distúrbios diretos no campo. Uma série de restrições ao uso da terra e à intrusão humana são necessárias para manter as populações selvagens de maneira adequada. Schenck et al., que realizaram um extenso trabalho de campo no Peru na década de 1990, sugerem zonas específicas "proibidas" onde a espécie é observada com mais frequência, compensadas por torres de observação e plataformas para permitir a visualização. Limites no número de turistas em qualquer momento, proibições de pesca e uma distância mínima de segurança de 50 metros (164 pés) são propostas para oferecer proteção adicional.[88]
Distribuição e população


A ariranha perdeu até 80% de sua distribuição na América do Sul.[82] Embora ainda presentes em vários países do centro-norte, as populações estão sob considerável estresse. A UICN lista Bolívia, Brasil, Colômbia, Equador, Guiana Francesa, Guiana, Paraguai, Peru, Suriname e Venezuela como países de abrangência atual.[1] Dadas as extinções locais, a distribuição da espécie tornou-se descontínua.[13] Os números totais da população são difíceis de estimar. Um estudo da UICN em 2006 sugeriu que ainda existem de 1 000 a 5 000 ariranhas.[1] A população da Bolívia já foi generalizada, mas o país se tornou um "ponto negro" nos mapas de distribuição após a caça ilegal entre as décadas de 1940 e 1970; uma população relativamente saudável, mas ainda pequena, de 350 foi estimada no país em 2002.[37] A espécie provavelmente foi extirpada do sul do Brasil, mas no oeste do país, a redução da pressão de caça no Pantanal levou a uma recolonização muito bem-sucedida; uma estimativa sugere 1 000 ou mais animais na região.[82][89]
Em 2006, a maioria desta espécie vivia na Amazônia brasileira e suas áreas limítrofes.[1] Uma população significativa vive nas áreas úmidas do rio Araguaia central e, em particular, no Parque Estadual do Cantão, que, com suas 843 lagoas marginais e extensas florestas alagadas e brejos, é uma das melhores manchas de habitat para esta espécie no Brasil.[46] Uma pesquisa de 2018 liderada pela bióloga Natália Pimenta analisou sinais da presença de ariranhas na bacia do rio Içana, no noroeste do Amazonas, onde o animal era considerado extinto. O estudo teve início depois que indígenas baníuas alertaram sobre o retorno seu retorno seu território, dentro da Terra Indígena do Alto Rio Negro.[84] A ariranha não era vista na região desde os anos 1940. Ultimamente, porém, outras pesquisas já haviam indicado uma tendência de recuperação da espécie em várias partes da Amazônia, como a bacia do Solimões e a região da Usina Hidrelétrica de Balbina.[72][90]
O Suriname ainda tem uma cobertura florestal significativa e um extenso sistema de áreas protegidas, muitas das quais protegem a ariranha.[91] Duplaix voltou ao país em 2000 e encontrou a ariranha ainda presente no riacho Caburi, uma "joia" da biodiversidade, embora o aumento da presença humana e do uso da terra sugiram que, mais cedo ou mais tarde, a espécie pode não ser capaz de encontrar um habitat adequado para acampamentos.[92] Em um relatório para o World Wildlife Fund em 2002, Duplaix foi enfático sobre a importância do Suriname e das outras Guianas:[61]
| “ | As três Guianas continuam sendo o último reduto de ariranhas na América do Sul, com habitat intocado de ariranhas em alguns rios e boa densidade geral de ariranhas - ainda, mas por quanto tempo? A sobrevivência das populações de ariranhas nas Guianas é fundamental para a sobrevivência dessa espécie ameaçada de extinção na América do Sul. | ” |
Outros países assumiram a liderança na designação de áreas protegidas na América do Sul. Em 2004, o Peru criou uma das maiores áreas de conservação do mundo, o Parque Nacional do Alto Purús, com área semelhante à da Bélgica. O parque abriga muitas plantas e animais ameaçados de extinção, incluindo a ariranha, e detém o recorde mundial de diversidade de mamíferos.[93][94] A Bolívia designou áreas úmidas maiores que o tamanho da Suíça como áreas protegidas de água doce em 2001 e estas também são o lar da ariranha.[95]
Interação com humanos
Em toda sua extensão, interage com grupos indígenas, que costumam praticar a caça e a pesca tradicionais. Um estudo de cinco comunidades indígenas na Colômbia sugere que as atitudes nativas em relação ao animal são uma ameaça: são frequentemente vistas como um incômodo que interfere na pesca e às vezes são mortas. Mesmo quando informados da importância da espécie para os ecossistemas e do perigo de extinção, os entrevistados mostraram pouco interesse em continuar a conviver com a espécie. As crianças em idade escolar, no entanto, tiveram uma impressão mais positiva do animal.[96]
No Suriname, não é uma presa tradicional para caçadores humanos, o que oferece alguma proteção.[92] (Um pesquisador sugeriu que a ariranha é caçada apenas em desespero devido ao seu sabor horrível.)[85] O animal às vezes se afoga em redes colocadas em rios e ataques de facão por pescadores foram notados, de acordo com Duplaix, mas "a tolerância é o regra" no Suriname.[68] Uma diferença de comportamento foi observada no país em 2002: as ariranhas, normalmente curiosas, mostraram "comportamento de evitação ativa com pânico visível" quando os barcos apareceram. A extração de madeira, a caça e a apreensão de filhotes podem ter levado os grupos a serem muito mais cautelosos com a atividade humana.[61] A população local às vezes leva os filhotes para o comércio de animais de estimação exóticos ou como animais de estimação para si mesmos, mas o animal cresce rapidamente e se torna incontrolável.[85] Duplaix conta a história de um índio aruaque que tirou dois filhotes de seus pais. Apesar de revelar o carinho que sentia pelos animais, a apreensão foi um golpe profundo para o casal reprodutor, que passou a perder seu território para os competidores.[68]
A espécie também apareceu no folclore da região. Desempenha um papel importante na mitologia dos achuares, onde é vista como uma forma de tsunki, ou espíritos da água: são uma espécie de "povo da água" que se alimenta de peixes. Aparecem numa lenda de envenenamento de peixes onde ajudam um homem que desperdiçou sua energia sexual, criando as sucuris do mundo a partir de seus órgãos genitais angustiados e dilatados.[6] Os bororós têm uma lenda sobre a origem do tabagismo: quem usava indevidamente a folha ao engoli-la era punido com a transformação em ariranha; os bororós também associam a ariranha com peixes e com fogo.[97] Conta a lenda ticuna que a ariranha trocou de lugar com a onça: a história diz que a onça vivia na água e a ariranha vinha à terra apenas para comer.[98] Os quíchuas da Amazônia Peruana acreditavam em um mundo de água onde Iacuruna reinava como mãe da água e era encarregado de cuidar de peixes e animais. Ariranhas serviam como canoas para ela.[99] Uma história de criação dos maxacalis sugere que a prática da pesca com ariranhas pode ter prevalecido no passado.[100]
Referências
- Groenendijk, J.; Duplaix, N.; Marmontel, M.; Van Damme, P.; Schenck, C. (2015). «Giant Otter - Pteronura brasiliensis». Lista Vermelha da IUCN. União Internacional para Conservação da Natureza (UICN). p. e.T18711A21938411. doi:10.2305/IUCN.UK.2015-2.RLTS.T18711A21938411.en. Consultado em 15 de abril de 2023
- Ferreira, Aurélio Buarque de Holanda (1986). Novo Dicionário da Língua Portuguesa 2.ª ed. Rio de Janeiro: Nova Fronteira. p. 163
- «Ariranha - Fauna - G1». Sítio de notícias G1. 23/12/2014 (atual. em 13/01/2015). Grupo Globo. Consultado em 15 de abril de 2023. Cópia arquivada em 9 de junho de 2021
- Londono, G. Corredor; Munoz, N. Tigreros (2006). «Reproduction, behaviour and biology of the Giant river otter (Pteronura brasiliensis) at Cali Zoo». International Zoo Yearbook. 40: 360–371. doi:10.1111/j.1748-1090.2006.00360.x. Consultado em 15 de abril de 2023
- Duplaix 1980, p. 547.
- Descola, Philippe (1994). In the Society of Nature: A Native Ecology in Amazonia. Cambrígia: Imprensa da Universidade de Cambrígia. pp. 280–282. ISBN 0-521-41103-3. Consultado em 15 de abril de 2023
- Ramos, Alcida Rita (1995). Sanumá Memories: Yanomami Ethnography in Times of Crisis. Madison, Visconsim: Imprensa da Universidade de Visconsim. p. 219. ISBN 0-299-14654-5. Consultado em 15 de abril de 2023
- «sem título». Sociedad de Ciencias Naturales La Salle (Fundación La Salle de Ciencias Naturales). Antrapológica. 55–58: 107. 1981–1982
- «River Otter - Giant Otter». Iwokrama International Centre for Rain Forest Conservation and Development. 1999. Consultado em 15 de abril de 2023. Cópia arquivada em 6 de abril de 2023
- Liddell, Henry George e Robert Scott (1980). A Greek-English Lexicon (Abridged Edition). Reino Unido: Imprensa da Universidade de Oxônia. ISBN 0-19-910207-4
- Koepfli, K.-P; Wayne, R.K. (Dezembro de 1998). «Phylogenetic relationships of otters (Carnivora: Mustelidae) based on mitochondrial cytochrome b sequences». Journal of Zoology. 246 (4): 401–416. doi:10.1111/j.1469-7998.1998.tb00172.x. Consultado em 15 de abril de 2023
- Wozencraft, W.C. (2005). «Pteronura brasiliensis». In: Wilson, D. E.; Reeder, D. M. (eds.). Mammal Species of the World 3 ed. Baltimore, Marilândia: Imprensa da Universidade Johns Hopkins. p. 605. ISBN 978-0-8018-8221-0. OCLC 62265494. Consultado em 15 de abril de 2023
- «Pteronura brasiliensis (giant otter)». Carnivores. Food and agricultural organization of the United Nations. Consultado em 15 de abril de 2023. Arquivado do original em 27 de novembro de 2007
- Chehebar, C. (Fevereiro de 1991). «Searching for the Giant Otter in Northeastern Argentina». IUCN Otter Specialist Group. 6 (1): 17–18. Consultado em 15 de abril de 2023. Cópia arquivada em 9 de abril de 2023
- Carter & Rosas 1997, p. 4.
- Duplaix 1980, p. 511.
- Foster-Turley, Pat; Macdonald, Sheila; Mason, Chris (eds.) (1990). «Otters: An Action Plan for their Conservation» (PDF). União Internacional para a Conservação da Natureza. IUCN/SSC Otter Specialist Group: Sections 2 and 12. Consultado em 15 de abril de 2023. Cópia arquivada (PDF) em 30 de abril de 2019
- Duplaix 1980, p. 614.
- Cartelle, Cástor; Hirooka, Suzana (setembro de 2005). «Primeiro Registro Pleistocênico de Pteronura brasiliensis (Gmelin, 1788) (Carnivora, Mustelidae)». Research Gate. Arquivos do Museu Nacional, Rio de Janeiro Publishing. Consultado em 15 de abril de 2023
- Marmi, Josep; Lopez-Giraldez, Juan F.; Domingo-Roura, Xavier (novembro de 2004). «Phylogeny, evolutionary history and taxonomy of the Mustelidae based on sequences of the cytochrome b gene and a complex repetitive flanking region». Zoologica Scripta. 33 (6): 481–499. doi:10.1111/j.0300-3256.2004.00165.x. Consultado em 15 de abril de 2023
- «Giant Otter (Pteronura brasiliensis)». The Nature Conservancy. Consultado em 15 de abril de 2023. Arquivado do original em 25 de maio de 2009
- Boitani, Luigi (1984). Simon & Schuster's Guide to Mammals. Nova Iorque: Simon & Schuster/Touchstone Books. ISBN 978-0-671-42805-1. Consultado em 15 de abril de 2023
- Carter & Rosas 1997, p. 2.
- «Giant Otter». Meet Our Animals. Zoológico da Filadélfia. Consultado em 15 de abril de 2023. Arquivado do original em 11 de abril de 2013
- «Otters: Physical characteristics». Anheuser-Busch Adventure Parks. Consultado em 15 de abril de 2023. Arquivado do original em 2 de novembro de 2007
- «Giant Otter Facts». Meet Our Animals. Earth's Endangered Creatures. Consultado em 15 de abril de 2023. Cópia arquivada em 8 de abril de 2023
- «Giant Otter». World Wildlife Fund. Consultado em 15 de abril de 2023. Arquivado do original em 24 de outubro de 2007
- «Giant Otter, the "Water Dog"». Iwokrama International Centre for Rainforest Conservation and Development. Consultado em 15 de abril de 2023. Cópia arquivada em 17 de outubro de 2007
- Duplaix 1980, p. 533.
- Franco-de-Sá, J. F. O.; Rosas, F. C. W.; Feldberg, E. (2007). «Cytogenetic study of the giant otter Pteronura brasiliensis Zimmermann 1780 (Carnivora, Mustelidae, Lutrinae)». Genetics and Molecular Biology. 30 (4): 1093–1096. doi:10.1590/S1415-47572007000600011. Consultado em 15 de abril de 2023
- Duplaix 1980, p. 497.
- «Otters: A SeaWorld Education Department Publication» (PDF). Seaworld. 2005. Consultado em 15 de abril de 2023. Cópia arquivada (PDF) em 15 de julho de 2008
- Duplaix 1980, pp. 552–561.
- Mumm, C. A. S.; Knörnschild, M. (12 de novembro de 2014). «The Vocal Repertoire of Adult and Neonate Giant Otters (Pteronura brasiliensis)». PLOS ONE. 9 (11): e112562. Bibcode:2014PLoSO...9k2562M. PMC 4229255
 . PMID 25391142. doi:10.1371/journal.pone.0112562. Consultado em 15 de abril de 2023
. PMID 25391142. doi:10.1371/journal.pone.0112562. Consultado em 15 de abril de 2023 - Mumm, C. A.; Knörnschild, M. (2017). «Territorial choruses of giant otter groups (Pteronura brasiliensis) encode information on group identity». PLOS ONE. 12 (10): e0185733. Bibcode:2017PLoSO..1285733M. PMC 5638252
 . PMID 29023545. doi:10.1371/journal.pone.0185733. Consultado em 15 de abril de 2023
. PMID 29023545. doi:10.1371/journal.pone.0185733. Consultado em 15 de abril de 2023 - van Damme, Paul; Wallace, Rob (outubro de 2002). «Distribution and Population Status of the Giant Otter Pteronura brasiliensis in Bolivia». IUCN Otter Specialist Group. 19 (2): 87–96. Consultado em 15 de abril de 2023. Cópia arquivada em 9 de abril de 2023
- Ribas, Carolina; Mourão, Guilherme (janeiro de 2005). «Intraspecific Agonism between Giant Otter Groups». IUCN Otter Specialist Group Bulletin. 21 (2): 89–93. Consultado em 15 de abril de 2023. Cópia arquivada em 8 de abril de 2023
- Evangelista, Emanuela (julho de 2004). «Change Of Partners In A Giant Otter Alpha Couple». IUCN Otter Specialist Group Bulletin. 21 (1): 47–51. Consultado em 15 de abril de 2023. Cópia arquivada em 8 de abril de 2023
- Duplaix 1980, pp. 571–2.
- Johnson, Dominic D.P.; MacDonald, David W.; Dickman, Amy J. (2000). «An analysis and review of the sociobiology of the Mustelidae» (PDF). Mammal Review. 30 (3&4): 171–196. doi:10.1046/j.1365-2907.2000.00066.x. Consultado em 15 de abril de 2023. Cópia arquivada (PDF) em 19 de setembro de 2006 Ver figura três para tamanho estimado da área de vida.
- Rosas, F. C. W.; De Mattos, G. E. (outubro de 2003). «Natural Deaths Of Giant Otters (Pteronura Brasiliensis) In Balbina Hydroelectric Lake, Amazonas, Brazil». IUCN Otter Specialist Group Bulletin. 20 (2): 62–64. Consultado em 15 de abril de 2023. Cópia arquivada em 8 de abril de 2023
- Duplaix 1980, p. 563.
- Carter & Rosas 1997, p. 15.
- Schenck, C.; Staib, E. (abril de 1992). «Giant Otters In Peru». IUCN Otter Specialist Group. 7: 24–26. Consultado em 15 de abril de 2023. Cópia arquivada em 8 de abril de 2023
- «Giant Otters in Cantão». Instituto Araguaia. Consultado em 15 de abril de 2023. Cópia arquivada em 26 de junho de 2017
- Carter & Rosas 1997, p. 18.
- Hagenbeck, Carl; Wunnemann, Claus (1992). «Breeding the giant otter (Pteronura brasiliensis) at Carl Hagenbecks Tierpark». International Zoo Yearbook. 32: 240–245. doi:10.1111/j.1748-1090.1991.tb02392.x. Consultado em 15 de abril de 2023. Cópia arquivada em 9 de maio de 2020
- Duplaix 1980, p. 567.
- Duplaix 1980, p. 576.
- de Oliveira, Gabriel; Rosas, Fernando; Barcellos, José; Lazzarini, Stella (2011). «Gross anatomy and histology of giant otter (Pteronura brasiliensis) and neotropical otter (Lontra longicaudis) testes». Animal Biology. 61 (2): 175–183. ISSN 1570-7555. doi:10.1163/157075511X566506. Consultado em 15 de abril de 2023. Cópia arquivada em 14 de março de 2023
- Sykes-Gatz, Sheila (2005). International Giant Otter Studbook Husbandry and Management Information and Guidelines 2.ª ed. Alemanha: Zoologischer Garten Dortmund. p. 13. Consultado em 15 de abril de 2023
- Duplaix 1980, pp. 564–5, 570.
- Oliveira, G. C.; Barcellos, J. F. M.; Rosas, F. C. W. (2007). «Age estimation in giant otters ( Pteronura brasiliensis ) (Carnivora: Mustelidae) using growth layer groups in canine teeth». Latin American Journal of Aquatic Mammals (em inglês). 6 (2): 155–160. ISSN 2236-1057. doi:10.5597/lajam00120. Consultado em 15 de abril de 2023. Cópia arquivada em 1 de dezembro de 2021
- Barnett, Adrian; Shapley, Rebecca; Lehman, Shawn (outubro de 2000). «Records of the Giant Otter, Pteronura brasiliensis, from Guyana». IUCN Otter Specialist Group. 17 (2): 65–74. Consultado em 15 de abril de 2023
- Carter & Rosas 1997, p. 16.
- Fernando, Rosas; Zuanon, Jansen (setembro de 1999). «Feeding Ecology of the Giant Otter, Pteronura brasiliensis». Biotropica. 31 (3): 502–506. doi:10.1111/j.1744-7429.1999.tb00393.x. Consultado em 15 de abril de 2023
- «Giant Otter (Pteronura brasiliensis)». International Otter Survival Fund. Consultado em 15 de abril de 2023. Cópia arquivada em 11 de outubro de 2007
- Duplaix 1980, pp. 544–6.
- Carter & Rosas 1997, p. 17.
- Duplaix, Nicole (2002). Guianas Rapid River Bio-assessments and Giant Otter Conservation Project (PDF) (Relatório). World Wildlife Fund. Consultado em 15 de abril de 2023. Cópia arquivada (PDF) em 6 de abril de 2023
- Duplaix 1980, pp. 514–5.
- Utreras, V.; Suárez, E.; Zapata-Ríos, G. (julho–dezembro de 2005). «Dry and Rainy Season Estimations of Giant Otter, Pteronura brasiliensis, Home-Range in the Yasuní National Park, Ecuador» (PDF). The Latin American Journal of Aquatic Mammals. 4 (2): 191–194. doi:10.5597/lajam00085. Consultado em 15 de abril de 2023. Cópia arquivada (PDF) em 6 de abril de 2023
- Carter & Rosas 1997, p. 13.
- Duplaix 1980, p. 69.
- Noor, Dharna. «Giant River Otter Believed to Be Extinct Has Been Spotted in Argentina». Gizmodo. Consultado em 15 de abril de 2023. Cópia arquivada em 8 de abril de 2023
- Duplaix 1980, pp. 523, 529.
- Duplaix 1980, pp. 529–530.
- Lontra longicaudis. In Duplaix 1980 foi listada como a ariranha sob o binômio mais antigo Lutra enudris.
- Duplaix 1980, pp. 527–9.
- «Appendices I, II and III». Convention on International Trade in Endangered Species of Wild Fauna and Flora. Consultado em 15 de abril de 2023. Cópia arquivada em 29 de dezembro de 2007
- Fillet, João (agosto de 2018). «Após serem quase extintas, ariranhas retornam a rios na Amazônia». BBC News Brasil. Consultado em 15 de abril de 2023. Cópia arquivada em 21 de fevereiro de 2023
- Extinção Zero. Está é a nossa meta (PDF). Belém: Conservação Internacional - Brasil; Museu Paraense Emílio Goeldi; Secretaria do Estado de Meio Ambiente, Governo do Estado do Pará. 2007. Consultado em 2 de maio de 2022. Cópia arquivada (PDF) em 2 de maio de 2022
- «Lista de Espécies Ameaçadas de Extinção da Fauna do Estado de Minas Gerais» (PDF). Conselho Estadual de Política Ambiental - COPAM. 30 de abril de 2010. Consultado em 2 de abril de 2022. Cópia arquivada (PDF) em 21 de janeiro de 2022
- Livro Vermelho da Fauna Ameaçada. Curitiba: Governo do Estado do Paraná, Secretaria do Meio Ambiente e Recursos Hídricos do Paraná. 2010. Consultado em 2 de abril de 2022
- de Marques, Ana Alice Biedzicki; Fontana, Carla Suertegaray; Vélez, Eduardo; Bencke, Glayson Ariel; Schneider, Maurício; Reis, Roberto Esser dos (2002). Lista de Espécies da Fauna Ameaçadas de Extinção no Rio Grande do Sul - Decreto Nº 41.672, de 11 de junho de 2002 (PDF). Porto Alegre: Museu de Ciências e Tecnologia da Pontifícia Universidade Católica do Rio Grande do Sul; PANGEA - Associação Ambientalista Internacional; Fundação Zoo-Botânica do Rio Grande do Sul; Secretaria Estadual do Meio Ambiente (SEMA); Governo do Rio Grande do Sul. Consultado em 2 de abril de 2022. Cópia arquivada (PDF) em 31 de janeiro de 2022
- «Decreto N.º 51.797, de 8 de setembro de 2014» (PDF). Porto Alegre: Estado do Rio Grande do Sul Assembleia Legislativa Gabinete de Consultoria Legislativa. 2014. Consultado em 2 de maio de 2022. Cópia arquivada (PDF) em 16 de março de 2022
- Bressan, Paulo Magalhães; Kierulff, Maria Cecília Martins; Sugleda, Angélica Midori (2009). Fauna Ameaçada de Extinção no Estado de São Paulo - Vertebrados (PDF). São Paulo: Governo do Estado de São Paulo, Secretaria de Infraestrutura e Meio Ambiente do Estado de São Paulo (SIMA - SP), Fundação Parque Zoológico de São Paulo. Consultado em 2 de maio de 2022. Cópia arquivada (PDF) em 25 de janeiro de 2022
- «Livro Vermelho da Fauna Brasileira Ameaçada de Extinção» (PDF). Brasília: Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio), Ministério do Meio Ambiente. 2018. Consultado em 3 de maio de 2022. Cópia arquivada (PDF) em 3 de maio de 2018
- «Portaria MMA N.º 148, de 7 de junho de 2022» (PDF). Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio), Ministério do Meio Ambiente (MMA). Consultado em 14 de abril de 2023. Cópia arquivada (PDF) em 1 de março de 2023
- «Pteronura brasiliensis (Gmelin, 1788)». Sistema de Informação sobre a Biodiversidade Brasileira (SiBBr). Consultado em 15 de abril de 2023. Cópia arquivada em 15 de abril de 2023
- Ridgley, Heidi (inverno de 2007). «The Wolf of the River» (PDF). Defenders Magazine. Defenders of Wildlife. Consultado em 15 de abril de 2023. Cópia arquivada (PDF) em 10 de janeiro de 2022
- Zielinski, S. (1 de maio de 2018). «How a social lifestyle helped drive a river otter species to near extinction». Science News. Consultado em 15 de abril de 2023. Cópia arquivada em 8 de abril de 2023
- Slotow, R.; Pimenta, N. C.; Antunes, A. P.; Barnett, A. A.; Macedo, V. W.; Shepard, G. H. (30 de março de 2018). «Differential resilience of Amazonian otters along the Rio Negro in the aftermath of the 20th century international fur trade». PLOS ONE. 13 (3): e0193984. Bibcode:2018PLoSO..1393984P. PMC 5877832
 . PMID 29601590. doi:10.1371/journal.pone.0193984. Consultado em 15 de abril de 2023
. PMID 29601590. doi:10.1371/journal.pone.0193984. Consultado em 15 de abril de 2023 - Wright, Lesley. «Threats to the Giant Otter». Otterjoy.com. Consultado em 15 de abril de 2023. Cópia arquivada em 6 de abril de 2023
- Fonseca, Fabrizio R.D.; Malm, Olaf; Waldemarin, Helen F. (2005). «Mercury levels in tissues of Giant otters (Pteronura brasiliensis) from the Rio Negro, Pantanal, Brazil» (PDF). Environmental Research. 98 (3): 368–371. Bibcode:2005ER.....98..368D. PMID 15910792. doi:10.1016/j.envres.2004.11.008. Consultado em 15 de abril de 2023. Cópia arquivada (PDF) em 6 de abril de 2023
- Gutleb, A. C.; Schenck, C.; Staib, E. (dezembro de 1997). «Giant otter (Pteronura brasiliensis) at risk? Total mercury and methylmercury levels in fish and otter scats, Peru». Ambio. 26 (8): 511–514. Consultado em 15 de abril de 2023. Cópia arquivada em 27 de novembro de 2007
- Schenck, Christof; Jessica, Groenendijk (abril de 1999). «Giant Otter Project In Peru: Field Trip And Activity Report, 1998». IUCN Otter Specialist Group. 16 (1): 33–43. Consultado em 15 de abril de 2023. Cópia arquivada em 9 de abril de 2023
- Carter & Rosas 1997, p. 8.
- «A caça predatória na Amazônia e a recuperação das ariranhas do rio Negro». Museu Paraense Emílio Goeldi. Maio de 2018. Consultado em 15 de abril de 2023. Cópia arquivada em 21 de setembro de 2021
- «Natural Heritage in Suriname». Suriname Natcom. UNESCO. Consultado em 15 de abril de 2023. Arquivado do original em 7 de março de 2007
- Duplaix, Nicole; Lingaard, Marchal; Sakimin, Claudine (2001). «A Survey of Kaburi Creek, West Suriname, and its Conservation Implications» (PDF). The Oceanic Society. Consultado em 15 de abril de 2023. Cópia arquivada (PDF) em 6 de abril de 2023
- «Perú creará inmensa reserva amazónica» (em espanhol). BBC Mundo. 1 de abril de 2005. Consultado em 15 de abril de 2023. Cópia arquivada em 8 de abril de 2023
- «The Alto Purús Conservation Project». Round River Conservation Studies. Consultado em 15 de abril de 2023. Arquivado do original em 10 de janeiro de 2008
- «WWF welcomes Latin America's largest freshwater protected area» (Nota de imprensa). The Ramsar Convention on Wetlands. 18 de setembro de 2001. Consultado em 15 de abril de 2023. Arquivado do original em 22 de fevereiro de 2008
- Velasco, Diana Marcela (2005). Investigación en Guainia: Estudio preliminar sobre el estado de conservación de la nutria gigante (Pteronura brasiliensis) en la zona de influencia de Inírida (Bajo río Inírida) Guainía, Colombia (PDF). Bogotá: Giant Otter Conservation. Consultado em 15 de abril de 2023. Cópia arquivada (PDF) em 6 de abril de 2023
- Lévi-Strauss, Claude (1983). The Raw and the Cooked. Traduzido por Weightman, John; Weightman, Doreen. Chicago: Imprensa da Universidade de Chicago. pp. 104–108. ISBN 978-0-226-47487-8. Consultado em 15 de abril de 2023
- Landolt, Gredna (2005). El ojo que cuenta: Mitos y costumbres de la Amazonía indígena ilustrados. Copenhague: International Work Group for Indigenous Affairs. p. 81. ISBN 978-9972-2640-0-9. Consultado em 15 de abril de 2023
- Ching, César (outubro de 2006). «PER-I38: El mundo del agua temido y poco conocido». BioDiversity Reporting Award. Semanario Kanatari, Iquitos, Iquitos (em espanhol). Consultado em 15 de abril de 2023. Cópia arquivada em 10 de fevereiro de 2012
- Warren, Jonathan W. (26 de setembro de 2001). Racial Revolutions: Antiracism and Indian Resurgence in Brazil. Durham, Carolina do Norte: Imprensa da Universidade Duke. pp. 1–4. ISBN 978-0-8223-2741-7. Consultado em 15 de abril de 2023
Bibliografia
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.


