A glicoproteína do envelope GP120 é uma glicoproteína exposta na superfície do envelope do HIV. Foi descoberta pelos Professores Tun-Hou Lee e Myron "Max" Essex da Harvard School of Public Health em 1988. O 120 em seu nome vem de seu peso molecular de 120 kDa. O Gp120 é essencial para a entrada de vírus nas células, pois desempenha um papel vital no apego a receptores de superfície celular específicos. Estes receptores são DC-SIGN, Heparan Sulfate Proteoglycan e uma interação específica com o receptor CD4, particularmente nas células T. A ligação ao CD4 induz o início de uma cascata de mudanças conformacionais em gp120 e gp41 que levam à fusão da membrana viral com a membrana da célula hospedeira. A ligação ao CD4 é principalmente eletrostática, embora haja interações van der Waals e ligações de hidrogênio.
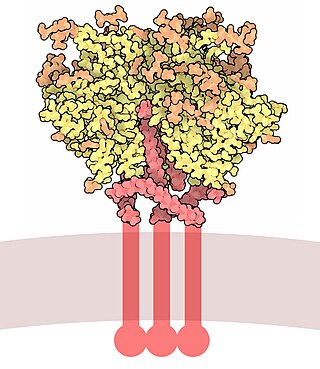
O Gp120 é codificado pelo gene HIV, que tem cerca de 2,5 kb de comprimento e códigos para cerca de 850 aminoácidos. O produto primário do env é a proteína gp160, que é clivada para gp120 (~480 aminoácidos) e gp41 (~345 aminoácidos) no retículo endoplasmático pela protease celular furina. A estrutura cristalina do núcleo do gp120 mostra uma organização com um domínio externo, um domínio interno com respeito a sua terminologia e uma folha de ponte. Gp120 é ancorado à membrana viral, ou envelope, através de ligações não covalentes com a glicoproteína transmembrana, gp41. Três gp120s e gp41s se combinam em um trimer de heterodímeros para formar o espigão do envelope, o que medeia a fixação e a entrada na célula hospedeira.
Variabilidade
Uma vez que o gp120 desempenha um papel vital na capacidade do HIV-1 de entrar nas células CD4+, sua evolução é de particular interesse. Muitos anticorpos neutralizantes se ligam a locais localizados em regiões variáveis do gp120, de modo que as mutações nessas regiões serão fortemente selecionadas.[1] A diversidade de env demonstrou aumentar em 1-2% ao ano no grupo M do HIV-1 e as unidades variáveis são notáveis para mudanças rápidas no comprimento da sequência de aminoácidos. O aumentos na variabilidade da gp120 resultam em níveis significativamente elevados de replicação viral, indicando um aumento na aptidão viral em indivíduos infectados por diversas variantes do HIV-1.[2] Outros estudos mostraram que a variabilidade em potenciais locais de glicosilação ligados ao N (PNGS) também resulta em aumento da aptidão viral. Os PNGS permitem a ligação de carboidratos de cadeia longa às regiões de alta variabilidade do gp120, de modo que os autores supõem que o número de PNGS em env pode afetar a aptidão do vírus ao fornecer mais ou menos sensibilidade aos anticorpos neutralizantes. A presença de grandes cadeias de carboidratos que se estendem a partir do gp120 pode obscurecer possíveis locais de ligação de anticorpos.[3]
Os limites do potencial para adicionar e eliminar PNGS são ingenuamente explorados pelo crescimento das populações virais após cada nova infecção.[4] Enquanto o hospedeiro transmissor desenvolveu uma resposta de anticorpos neutralizantes ao gp120, ao hospedeiro recém-infectado falta o reconhecimento imunológico do vírus. Os dados da seqüência mostram que as variantes virais iniciais em um hospedeiro imunologicamente ingênuo têm poucos locais de glicosilação e loops variáveis expostos mais curtos. Isto pode facilitar a capacidade viral de ligar os receptores das células hospedeiras.[5] medida que o sistema imunológico do hospedeiro desenvolve anticorpos contra o gp120, as pressões imunes parecem selecionar para aumentar a glicosilação, particularmente nos loops variáveis expostos do gp120.[6] Consequentemente, inserções em env, que conferem mais PNGS ao gp120 podem ser mais toleradas pelo vírus, uma vez que uma maior densidade de glicanos promove a capacidade viral de escapar dos anticorpos e, portanto, promove uma maior aptidão viral.[7] Ao considerar quanta densidade de PNGS poderia teoricamente mudar, pode haver um limite superior para o número de PNGS devido a sua inibição de dobrar o gp120, mas se o número de PNGS diminui substancialmente, então o vírus é detectado com muita facilidade pela neutralização de anticorpos.[8] Portanto, é provável que se estabeleça um equilíbrio de seleção estabilizador entre densidades baixas e altas de glicanos. Um número menor de latas de glicanos volumosas melhora a eficiência da replicação viral e um número maior nos loops expostos ajuda a evasão imunológica do hospedeiro através do disfarce.
Alvo da vacina
Como a ligação do receptor CD4 é o passo mais óbvio na infecção pelo HIV, o gp120 foi um dos primeiros alvos da pesquisa vacina contra o HIV. Os esforços para desenvolver vacinas contra o HIV visando o gp120, entretanto, foram prejudicados pelas propriedades químicas e estruturais do gp120, que dificultam a ligação dos anticorpos a ele. O gp120 também pode ser facilmente expelido da superfície do vírus e capturado por células T devido a sua ligação solta com o gp41. Uma região conservada na glicoproteína gp120 que está envolvida na fixação metastável do gp120 ao CD4 foi identificada e o alvo da região invariante foi alcançado com um anticorpo amplamente neutralizante, IgG1-b12.[9] [10]
A pesquisa NIH publicada na Science relata o isolamento de 3 anticorpos que neutralizam 90% das cepas HIV-1 na região CD4bs do gp120, oferecendo potencialmente uma estratégia terapêutica e vacinal. [http://www.sciencemag.org/cgi/content/abstract/science.1187659 A maioria dos anticorpos que ligam a região CDbs do gp120 não neutraliza o HIV,[11] e raros que fazem como IgG1-b12 têm propriedades incomuns como assimetria do Fab arms[12] ou em seu posicionamento.[13] A menos que uma vacina à base de gp120 possa ser projetada para produzir anticorpos com propriedades antivirais fortemente neutralizantes, existe a preocupação de que a infecção revolucionária levando à produção humoral de altos níveis de anticorpos não neutralizantes visando o site de ligação CD4 do gp120 esteja associada a uma progressão mais rápida da doença para a AIDS.[14]
Competição
A proteína gp120 é necessária durante a ligação inicial do HIV a sua célula alvo. Consequentemente, qualquer coisa que se ligue ao gp120 ou a seus alvos pode bloquear fisicamente o gp120 de ligar-se a uma célula. Apenas um desses agentes, Maraviroc, que liga o co-receptor. CCR5 está atualmente licenciado e em uso clínico. Nenhum agente visando o primeiro parceiro principal de interação celular do gp120, CD4, está atualmente licenciado, uma vez que a interferência com tal molécula central do sistema imunológico pode causar efeitos colaterais tóxicos, como o anticorpo monoclonal anti-CD4 OKT4. A mira do próprio gp120 se mostrou extremamente difícil devido a seu alto grau de variabilidade e blindagem. Fostemsavir]. (BMS-663068) é um pró-fármaco de fosfato de metila do pequeno inibidor de moléculas BMS-626529, que impede a entrada viral ligando-se ao envelope viral gp120 e interferindo na fixação do vírus ao receptor CD4 hospedeiro.[15]
Demência por HIV
A proteína viral do HIV gp120 induz a apoptose das células neuronais pela inibição dos níveis de furina e ativador do plasminogênio tecidual, enzimas responsáveis pela conversão do pBDNF em mBDNF.[16] gp120 induz proteínas mitocondriais de morte como caspases que podem influenciar a upregulation do receptor de morte Fas levando à apoptose de células neuronais,[17] gp120 induz estresse oxidativo nas células neuronais,[18] e também é conhecido por ativar STAT1 e induzir a secreção interleucinas IL-6 e IL-8 em células neuronais.[19]
Ver também
- HIV envelope gene
- HIV entrada na célula
- GP41
- CD4
- CCR5
- Inibidor de entrada
- Estrutura e genoma do HIV
Referências
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.
