Loading AI tools
O cancro (português europeu) ou câncer (português brasileiro) do pâncreas surge quando as células do pâncreas, um órgão glandular atrás do estômago, se começam a multiplicar de forma descontrolada e formam um tumor. Estas células cancerígenas têm a capacidade de invadir outras partes do corpo.[10] Existem diversos tipos de cancro do pâncreas. O mais comum, adenocarcinoma pancreático, corresponde a aproximadamente 85% dos casos e em muitas situações o termo "cancro do pâncreas" é usado para designar apenas este tipo. Estes adenocarcinomas começam-se a formar na parte do pâncreas que produz as enzimas digestivas. A partir destas células podem também surgir vários outros tipos de cancro, que no conjunto representam a maioria dos não-adenocarcinomas. Um a dois em cada 100 casos de cancro do pâncreas são tumores neuroendócrinos que se formam a partir das células do pâncreas produtoras de hormonas. Este tipo é geralmente menos agressivo que o adenocarcinoma pancreático.[2]
| Cancro do pâncreas | |
|---|---|
| TAC com coloração artificial e elevado nível de contraste. A cruz delimita um adenocarcinoma macrocístico na cabeça do pâncreas. | |
| Especialidade | Oncologia |
| Sintomas | Pele de tom amarelo, dor abdominal ou dor nas costas, perda de peso inexplicável, fezes claras, urina escura, perda de apetite[1] |
| Início habitual | Após os 40 anos[2] |
| Fatores de risco | Fumar, obesidade, diabetes, algumas doenças genéticas raras[2] |
| Método de diagnóstico | Imagiologia médica, análises ao sangue, biópsia[3][4] |
| Prevenção | Não fumar, manter peso saudável, diminuir o consumo de carne vermelha[5] |
| Tratamento | Cirurgia, radioterapia, quimioterapia, cuidados paliativos[1] |
| Prognóstico | Sobrevivência a 5 anos: 5%[6][7] |
| Frequência | 393 800 (2015)[8] |
| Mortes | 411 600 (2015)[9] |
| Classificação e recursos externos | |
| CID-10 | C25 |
| CID-9 | 157 |
| CID-11 | 542147910 |
| OMIM | 260350 |
| DiseasesDB | 9510 |
| MedlinePlus | 000236 |
| eMedicine | med/1712 |
| MeSH | D010190 |
Entre os sintomas mais comuns de cancro pancreático estão a coloração amarelada da pele, dores abdominais e nas costas, perda de peso inexplicável, fezes de coloração clara, urina escura e perda de apetite. Geralmente os sintomas não se manifestam durante as primeiras fases da doença e os sintomas que são suficientemente específicos para suspeitar de cancro pancreático só se manifestam quando a doença já se encontra num estádio avançado.[2] Em muitos casos, no momento do diagnóstico o cancro já se disseminou para outras partes do corpo.[11][6]
O cancro do pâncreas raramente ocorre antes dos 40 anos de idade e mais de metade dos casos de adenocarcinoma pancreático ocorrem em pessoas com mais de 70.[2] Entre os fatores de risco para a doença estão o tabagismo, obesidade, diabetes e determinadas condições genéticas raras.[2] Mais de um quarto dos casos estão relacionados com o fumo do tabaco[3] e 5–10% estão associados a genes hereditários.[2] O cancro pancreático é geralmente diagnosticado com recurso a um conjunto de técnicas de imagiologia médica, como ecografia ou tomografia computadorizada, análises ao sangue e biópsia de amostras de tecido.[3][4] A doença divide-se em estádios, desde o estádio I até ao estádio IV.[11] Não há evidências de que o rastreio generalizado da população seja eficaz no diagnóstico precoce.[12]
O risco de desenvolver cancro do pâncreas é menor entre não fumadores e pessoas que mantêm um peso saudável e limitam o consumo de carne vermelha ou processada.[5] A probabilidade de um fumador desenvolver a doença diminui após deixar de fumar, regressando aos valores da generalidade da população no prazo de 20 anos.[6] O cancro do pâncreas pode ser tratado com cirurgia, radioterapia, quimioterapia, cuidados paliativos ou pela conjugação de vários destes métodos. As opções de tratamento dependem em parte do estádio do cancro. A cirurgia é o único tratamento que cura a doença, embora também possa ser realizada com o objetivo de melhorar a qualidade de vida da pessoa quando não exista possibilidade de cura.[1] Por vezes é necessária medicação e medidas para gestão da dor.[11] Os cuidados paliativos são recomendados até para pessoas cujo tratamento se destine à cura.[13][14]
Em 2012, os cancros pancreáticos de todos os tipos foram a sétima causa mais comum de morte por cancro, correspondendo a 330 000 mortes à escala global.[6] A prevalência da doença é maior em países desenvolvidos, os quais foram a origem de 70% dos novos casos em 2012.[6] O adenocarcinoma pancreático apresenta geralmente um prognóstico muito reservado: após o diagnóstico, apenas 25% das pessoas sobrevive mais de um ano e apenas 5% sobrevive por mais de cinco anos.[6][7] Nos casos em que o cancro é diagnosticado durante a fase inicial, a taxa de sobrevivência após cinco anos aumenta para aproximadamente 20%.[15] Os cancros neuroendócrinos apresentam um diagnóstico mais positivo; após cinco anos, a taxa de sobrevivência é de 65%, embora dependa consideravelmente do tipo de tumor.[6]

Os diversos tipos de cancro do pâncreas podem ser divididos em dois grupos genéricos. A grande maioria dos casos (99%) ocorre na parte do pâncreas que produz enzimas digestivas, denominada de componente exócrino. Embora existam vários subtipos de cancros pancreáticos exócrinos, o diagnóstico e tratamento é em grande parte idêntico. A pequena minoria de cancros que surge no tecido produtor de hormonas (endócrino) apresenta características clínicas diferentes. Ambos os grupos ocorrem principalmente (mas não de forma exclusiva) em pessoas com mais de 40 anos e são ligeiramente mais comuns em homens. No entanto, alguns subtipos mais raros ocorrem principalmente em mulheres ou crianças.[16][17]
Cancros exócrinos
O grupo exócrino é dominado pelo adenocarcinoma pancreático, também denominado "invasivo" ou "ductal", que é de longe o tipo mais comum e corresponde a cerca de 85% de todos os cancros pancreáticos.[2] Por outro lado, o tecido a partir do qual se forma, o epitélio ductal pancreático, representa apenas 10% do volume de células do pâncreas.[18] Este cancro tem origem nos ductos que transportam determinadas hormonas e enzimas para fora do pâncreas. Cerca de 60–70% dos adenocarcinomas ocorrem na cabeça do pâncreas (ver diagrama à direita).[2]
O segundo tipo mais comum, o carcinoma de células acinares, tem origem nos aglomerados de células que produzem estas enzimas e corresponde a 5% de todos os cancros pancreáticos exócrinos. Os carcinomas de células acinares podem causar sobreprodução de determinadas moléculas, neste caso de enzimas digestivas, que podem provocar sintomas como irritações cutâneas ou dores nas articulações. Os cistoadenocarcinomas correspondem a 1% dos cancros pancreáticos e apresentam melhor prognóstico do que os restantes tipos exócrinos.[19]
Os pancreatoblastomas são uma forma rara de cancro pancreático, que ocorre maioritariamente na infância e que apresenta um prognóstico relativamente positivo. Entre outros cancros exócrinos raros estão os carcinomas adenoescamosos, os carcinomas de células em anel de sinete, os carcinomas hepatoides, carcinomas coloides, carcinomas indiferenciados e os carcinomas indiferenciados com células gigantes do tipo osteoclasto. O tumor sólido pseudopapilar é uma neoplasia rara de baixo grau que afeta principalmente mulheres jovens e tem geralmente um prognóstico bastante positivo.[2][20] As neoplasias císticas mucinosas do pâncreas são um grupo alargado de tumores do pâncreas com diferente potencial de malignidade. Têm vindo a ser detectados com maior frequência devido à utilização mais frequente e à melhoria da definição da imagem da tomografia computorizada. Ainda se discute a melhor forma de tratamento, dado que a maior parte é benigna.[21]
Cancros neuroendócrinos
A pequena minoria de tumores que se forma nas restantes áreas do pâncreas são sobretudo tumores neuroendócrinos do pâncreas (PanNET).[22] Os tumores neuroendócrinos (NET) são um grupo diversificado de tumores benignos ou malignos que se forma nas células neuroendócrinas, as quais são responsáveis pela integração do sistema nervoso e endócrino. Os NET podem formar-se na maior parte dos órgãos, incluindo o pâncreas, embora todos os tipos malignos sejam considerados raros. Os PanNET são agrupados em de tipo "funcional" e "não funcional", dependendo do grau de produção de hormonas. Os de tipo funcional segregam para a corrente sanguínea hormonas como a insulina, gastrina e glicagina, muitas vezes em grande quantidade, dando origem a sintomas graves como pouco açúcar no sangue, embora também favoreçam a deteção precoce da doença. Os PanNET mais comuns são os insulinomas e os gastrinomas, assim denominados de acordo com as hormonas que segregam. Os de tipo não funcional não segregam hormonas em quantidade suficiente para provocar sintomas clínicos visíveis. Por esta razão, muitas vezes os PanNET de tipo não funcional só são diagnosticados depois do cancro se ter disseminado para outras partes do corpo.[23]
Tal como com outros tumores neuroendócrinos, a história da terminologia e classificação dos PanNET é complexa.[22] Os PanNET são por vezes denominados "tumores de células dos ilhéus",[24] embora hoje se saiba que não têm origem nas células dos Ilhéus de Langerhans, como anteriormente se pensava.[23]

Uma vez que o cancro do pâncreas geralmente não produz sintomas durante as fases iniciais, na maioria dos casos a doença só é diagnosticada quando já se disseminou para além do próprio pâncreas.[4] Isto é uma das principais razões que explica a baixa taxa de sobrevivência da doença. No entanto, excluem-se deste cenário os PanNET, uma vez que a sobre-produção de várias hormonas ativas pode dar origem a sintomas, os quais dependem do tipo de hormonas.[25]
Tendo em conta que a doença raramente é diagnosticada antes dos 40 anos de idade, os sintomas mais comuns de adenocarcinoma pancreático pré-diagnóstico incluem:
- Dor na parte superior ou posterior do abdómen, que muitas vezes se prolonga à volta do estômago e até às costas. É por vezes descrita clinicamente como "dor em cinturão".[26] A localização da dor pode indicar a parte do pâncreas onde se situa o tumor. Esta dor pode agravar-se durante a noite e aumentar ao longo do tempo, tornando-se mais dolorosa e persistente. Pode ser ligeiramente aliviada quando a pessoa se dobra para a frente.[19]
- Icterícia, uma coloração amarelada da parte branca dos olhos ou da pele, com ou sem dor, e possivelmente em conjunto com urina mais escura do que o normal. Isto deve-se ao facto dos cancros na cabeça do pâncreas obstruírem o ducto colédoco na parte em que atravessa o pâncreas.[27]
- Perda inexplicável de peso, quer devido a perda de apetite, má digestão ou caquexia.[11]
- O tumor pode comprimir os órgãos vizinhos, interferir com o processo digestivo e dificultar o esvaziamento do estômago, o que pode provocar náuseas e a sensação de enfartamento. A gordura não digerida provoca fezes gordurosas e fétidas, difíceis de escoar da sanita.[11] A obstipação é comum.[28]
- Pelo menos 50% das pessoas com adenocarcinoma pancreático têm diabetes no momento do diagnóstico.[2] Embora a diabetes seja um fator de risco conhecido para o cancro do pâncreas, o próprio cancro pode provocar a diabetes, pelo que o aparecimento recente da doença pode ser considerado um dos primeiros sinais da doença.[29] As pessoas com mais de 50 anos que desenvolvem diabetes apresentam um risco oito vezes superior de desenvolver adenocarcinoma pancreático no prazo de três anos, após os quais o risco diminui.[11]
Outras manifestações
- A síndrome de Trousseau, na qual se formam coágulos sanguíneos de forma espontânea nos vasos capilares portais ou nas veias superficiais de qualquer parte do corpo, pode estar associada ao cancro do pâncreas e é observada em cerca de 10% dos casos.[3]
- Em cerca de 10-20% dos casos tem sido indicada perturbação depressiva em associação com o cancro do pâncreas, o que pode constituir um obstáculo ao tratamento correto. Por vezes, a depressão aparece antes do diagnóstico de cancro, o que sugere que pode ser provocada pela própria biologia da doença.[3]
Entre outras manifestações comuns da doença estão a fraqueza e facilidade em se cansar; boca seca, problemas de sono; e uma massa abdominal palpável.[28]
Sintomas das metástases

A disseminação do cancro do pâncreas para outros órgãos (metástase) pode também causar sintomas. Geralmente, o adenocarcinoma pancreático começa por se propagar para os gânglios linfáticos nas proximidades, e posteriormente para o fígado, cavidade peritoneal, intestino grosso ou pulmões.[3] É pouco comum que se espalhe para os ossos ou cérebro.[30]
Os cancros no pâncreas também podem ser cancros secundários que se disseminaram a partir de outras partes do corpo. No entanto, esta situação é pouco comum e observa-se apenas em 2% dos casos de cancro no pâncreas. O cancro dos rins é, de longe, o cancro mais comum que se propaga para o pâncreas, seguido pelo cancro do cólon, melanoma e cancro da mama.[31]
Os fatores de risco para o adenocarcinoma pancreático incluem:[2][11][6][32]
- Idade, género e raça. O risco de desenvolver cancro do pâncreas aumenta com a idade. A maior parte dos casos ocorre após os 65 anos,[6] enquanto que os casos em idades inferiores a 40 anos são pouco comuns. A doença é ligeiramente mais comum em homens do que em mulheres e, nos Estados Unidos, é 1,5 vezes mais comum entre a população afro-americana, embora a incidência em África seja baixa.[6]
- O tabagismo é o fator de risco mais facilmente evitável. O risco é duas vezes superior entre fumadores de longa data, risco esse que aumenta de acordo com o número de cigarros fumados por dia e os anos de tabagismo. O risco diminui ligeiramente após suspensão dos hábitos tabágicos, embora só após cerca de 20 anos é que o risco se equipara àquele de não fumadores.[33]
- Obesidade; um índice de massa corporal superior a 35 aumenta o risco relativo em cerca de metade.[11]
- Antecedentes familiares; 5–10% dos casos de cancro do pâncreas têm um componente hereditário e antecedentes familiares de cancro pancreático.[2] O risco aumenta de forma significativa se mais do que um familiar em primeiro grau teve a doença, e de forma moderada caso a tenham desenvolvido antes dos 50 anos de idade.[4] A maior parte dos genes envolvidos nesta doença ainda não foi identificada.[2][34] A pancreatite hereditária predispõe a um risco bastante agravado (30-40%) de até aos 70 anos de idade se poder vir a desenvolver cancro do pâncreas.[3] É possível que a este grupo possa ser oferecido rastreio precoce de cancro do pâncreas no âmbito de investigação clínica.[35] Algumas pessoas podem optar por remover cirurgicamente o pâncreas de modo a evitar o aparecimento de cancro no futuro.[3]
- A diabetes é um fator de risco para cancro do pâncreas e o seu aparecimento pode ser um sinal precoce da doença. As pessoas diagnosticadas com diabetes do tipo 2 há mais de dez anos têm um risco acrescido em 50% em comparação com os não diabéticos.[3]
- A pancreatite crónica aparenta triplicar o risco e, tal como no caso da diabetes, o aparecimento de pancreatite pode ser sintoma de tumor.[3] O risco de cancro do pâncreas em indivíduos com historia familiar de pancreatite é particularmente elevado.[3][34]
- Para muitos dos alimentos, não há indícios claros de que aumentem o risco de cancro do pâncreas.[2] No entanto, há evidências de que possa haver um risco ligeiramente superior derivado do consumo de carne vermelha, carne processada e carne cozinhada a temperatura muito alta (p.e. frita ou grelhada).[36][37]
- O cancro pancreático tem também sido associado às seguintes síndromes hereditárias raras: síndrome de Peutz–Jeghers devido a mutações no gene supressor de tumor STK11 (bastante raro, embora um fator de risco significativo); síndrome do nevo displásico devido a mutações no gene supressor de tumor CDKN2A; ataxia telangiectasia autossómica recessiva e mutações autossómicas dominantes hereditárias nos genes BRCA2 e PALB2; cancro colorretal hereditário sem polipose; e polipose adenomatosa familiar. Os PanPET têm sido associados com neoplasia endócrina múltipla do tipo 1 e com a síndrome de Von Hippel-Lindau.[2][3][4]
Bebidas alcoólicas
O consumo de álcool em excesso é uma das principais causas de pancreatite crónica, a qual predispõe a pessoa para o cancro pancreático. No entanto, apesar de uma quantidade considerável de investigação, não se conseguiu estabelecer de forma inequívoca que o de consumo de álcool seja um fator de risco direto para o cancro pancreático. De forma geral, a associação é consistentemente fraca e a maioria dos estudos não encontrou qualquer associação, embora o tabagismo seja uma forte variável de confundimento. A evidência é mais fortes nos casos de consumo pesado, de pelo menos seis bebidas por dia.[3][38]

Os sintomas de adenocarcinoma pancreático geralmente não se manifestam durante as fases iniciais da doença e, individualmente, não são exclusivos da doença (inespecíficos).[11][3][27] Os sintomas no momento do diagnóstico variam de acordo com a localização do cancro no pâncreas, órgão que os anatomistas dividem em cabeça, pescoço, corpo e cauda. Cerca de 60–70% dos cancros pancreáticos localizam-se na cabeça do pâncreas.[2] O sintoma mais comum, qualquer que seja a localização, é a perda inexplicável de peso, que pode ser considerável. Os tumores na cabeça da glândula também provocam icterícia, dores abdominais, perda de apetite, urina escura e fezes de cor clara. Os tumores do corpo e da cauda do pâncreas geralmente também provocam dor. Uma parte significativa das pessoas diagnosticadas (entre 35 e 47%) também apresenta náuseas, vómitos e sensação de fraqueza.[27]
No momento de diagnóstico, por vezes as pessoas têm história recente de diabetes do tipo 2 de difícil controlo, história recente e inexplicável de inflamação dos vasos capilares provocada por coágulos sanguíneos (sinal de Trousseau) ou crise de pancreatite prévia.[27] O médico poderá suspeitar de cancro do pâncreas quando o aparecimento de diabetes num indivíduo com mais de 50 anos é acompanhado por sintomas característicos, como perda inexplicável de peso, dor abdominal ou das costas persistente (em cinturão), indigestão, vómitos ou fezes gordurosas.[11] Também a icterícia, quando acompanhada por inflamação indolor da vesícula biliar (sinal de Courvoisier), pode levantar suspeitas e ajudar a diferenciar o cancro pancreático de pedras na vesícula.[39]
As técnicas de imagiologia médica, como a tomografia computadorizada ou ecoendoscopia, são usadas para confirmar o diagnóstico e ajudar a decidir se o tumor pode ou não ser removido com cirurgia.[11] É também possível recorrer a imagem por ressonância magnética ou tomografia por emissão de positrões,[2] e nalguns casos a colangiopancreatografia por ressonância magnética.[27] A ecografia abdominal é menos sensível e pode não detetar pequenos tumores, embora possa identificar cancros que se tenham propagado para o fígado e a acumulação de fluido na cavidade peritoneal (ascite).[11] Pode ser usado numa avaliação rápida, não invasiva e barata antes de outras técnicas.[40] Nos casos em que não há certeza sobre o diagnóstico, pode ser realizada uma biópsia através de punção aspirativa por agulha fina, geralmente orientada por ecoendoscopia. No entanto, geralmente não é necessário um diagnóstico histológico para decidir a remoção do tumor através de cirurgia.[11]
Os testes de função hepática podem mostrar uma combinação de resultados indicativos de uma obstrução do ducto biliar (quantidade acima do normal de bilirrubina, gamaglutamiltranspeptidase e fosfatase alcalina). O antígeno de carcinoma 19-9 (CA 19-9) é um marcador tumoral que geralmente se encontra elevado em casos de cancro do pâncreas. No entanto, este indicador tem pouca sensibilidade, uma vez que 5% das pessoas não têm o antígeno de Lewis (a) e não produzem o CA 19-9, pelo que é usado principalmente para acompanhar casos já diagnosticados e não para o diagnóstico em si.[2][11]
Quando observada ao microscópio, a forma mais comum de cancro do pâncreas (adenocarcinoma) é geralmente caracterizada por estruturas glandulares pouco ou moderadamente diferenciadas. Normalmente, verifica-se desmoplasia considerável ou formação de um estroma ou tecido estrutural constituído por uma gama diversa de tipos celulares (incluindo miofibroblastos, macrófagos, linfócitos e mastócitos) e material depositado (colagénio do tipo I e ácido hialurónico. Isto proporciona um microambiente no tumor com pouca quantidade de vasos sanguíneos (hipovascular) e de oxigénio (hipóxia tumoral).[2] Pensa-se que este ambiente seja o que impeça muitos dos fármacos de quimioterapia de atingir o tumor, o que é um dos fatores que tornam o tratamento deste cancro particularmente difícil.[2][3]
Cancros exócrinos
A determinação do estágio do cancro do pâncreas é geralmente realizada após uma TC.[27] O sistema mais amplamente utilizado de classificação de cancro do pâncreas é o da autoria do American Joint Committee on Cancer (AJCC) em co-autoria com a União Internacional Contra o Cancro (UICC). O sistema AJCC-UICC determina quatro estádios principais, desde o inicial até doença avançada, com base na classificação TNM — tamanho do tumor, grau de propagação para os nódulos (ou gânglios) linfáticos e metástases à distância.[41]
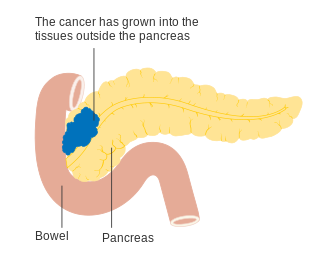
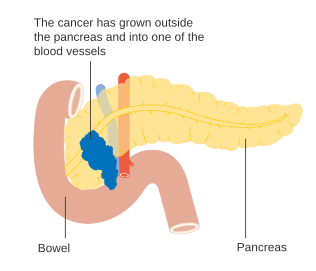
Para auxiliar a decisão sobre a melhor forma de tratamento, os tumores também são divididos em três categorias genéricas com base na possibilidade aparente da remoção cirúrgica. Desta forma, os tumores podem ser considerados "ressecáveis", "marginalmente ressecáveis" ou "irressecáveis".[42] Quando a doença se encontra nos estádios iniciais (estádios AJCC-UICC I e II), sem se ter propagado para vasos sanguíneos de grande dimensão ou para órgãos à distancia, como o fígado ou os pulmões, geralmente é possível realizar a ressecção do tumor, desde que o paciente esteja disposto e apto a submeter-se a esta operação complexa.[11] O sistema AJCC-UICC permite distinguir entre tumores de estádio III que sejam "marginalmente ressecáveis" (em que a cirurgia é tecnicamente viável porque as artérias celíaca e mesentérica superior ainda se encontram livres) e tumores que sejam "irressecáveis" (devido a doença localmente mais avançada). Nos parâmetros da classificação TNM, estes dois grupos correspondem a T3 e T4, respetivamente.[3]
- Estágios do cancro do pâncreas (classificação TNM)
- Estágio T1
- Estágio T2
- Estágio T3
- Estágio T4
- Estágio N1: Cancro pancreático nos gânglios linfáticos próximos
- Estágio M1: Cancro pancreático metastatizado
Os adenocarcinomas localmente avançados propagam-se para órgãos adjacentes, os quais podem ser qualquer um dos seguintes (por ordem aproximada de frequência): duodeno, estômago, cólon transverso, baço, glândula suprarrenal ou rim. Em muitos casos também se propagam para vasos sanguíneos ou linfáticos importantes que passem na proximidade do pâncreas, tornando a cirurgia bastante mais complexa. Os locais mais comuns de metástase (doença em estádio IV) são o fígado, a cavidade peritoneal, e pulmões, as quais se verificam em mais de metade dos casos avançados.[43]
PanNET
A classificação da OMS de 2010 de tumores do sistema digestivo divide todos os tumores neuroendócrinos em três categorias, com base no grau de diferenciação celular, desde "NET G1" até ao pouco diferenciado "NET G3".[17] A associação norte-americana National Comprehensive Cancer Network recomenda o uso do mesmo sistema AJCC-UICC usado para os adenocarcinomas,[44] embora com este sistema os prognósticos de cada estádio sejam diferentes dos cancros exócrinos.[45] A Sociedade Europeia de Tumores Neuroendócrinos tem vindo a propor um sistema TNM diferente para os tumores endócrinos.[17]

Cancros exócrinos

Pensa-se que estes cancros tenham origem em diversos tipos de lesões pré-cancerígenas do pâncreas. No entanto, estas lesões nem sempre evoluem para cancro e nem sempre há necessidade de tratamento.[3] Para além dos cistoadenomas serosos do pâncreas (SCN), que são quase sempre benignos, existem três tipos de lesões pré-cancerígenas:
- A primeira é a neoplasia intraepitelial pancreática. Trata-se de anomalias microscópicas no pâncreas, que são frequentemente encontradas em autópsias de pessoas sem cancro diagnosticado. Estas lesões podem evoluir de baixo grau para alto grau e posteriormente para um tumor. Em mais de 90% dos casos, em qualquer dos graus, observa-se uma deficiência no gene KRAS, enquanto nos graus 2 e 3 se verifica frequentemente lesões em mais três genes: CDKN2A (p16), p53 e SMAD4.[2]
- A segunda são as neoplasias mucinosas papilares intraductais, que são lesões macroscópicas que ocorrem em cerca de 2% de todos os adultos (10% por volta dos 70 anos de idade) e que apresentam um risco de 25% de se desenvolverem em cancros invasivos. Também apresentam frequentemente mutações no gene KRAS (40-65% dos casos) e nos genes GNAS e RNF43, o que afeta a via de sinalização Wnt.[2] Mesmo quando estas lesões são extraídas por via cirúrgica, continua a existir um risco consideravelmente acrescido de se vir a desenvolver cancro pancreático.[3]
- O terceiro tipo são as neoplasias mucinosas císticas (MCN), que ocorrem principalmente em mulheres e podem permanecer benignas ou evoluir para cancros.[46] No caso de aumentarem de tamanho, causarem sintomas ou apresentarem características suspeitas, são geralmente removidas cirurgicamente.[3]
Os eventos genéticos observados em adenocarcinomas ductais estão hoje bem caracterizados, tendo sido realizada sequenciação do exoma para os tipos mais comuns de tumores. Verificou-se que, na maioria dos adenocarcinomas, há quatro genes que sofrem mutações: KRAS (em 95% dos casos), CDKN2A (também em 95%), TP53 (75%) e SMAD4 (55%). Este último está especialmente associado a um prognóstico reservado.[3] Em cerca de 10-15% dos adenocarcinomas ocorrem mutações ou eliminações SWI/SNF.[2]
PanNET
Os genes que geralmente se encontram modificados nos PanNET são diferentes dos do adenocarcinoma pancreático.[47] Por exemplo, normalmente não se verifica mutação do KRAS. Em vez disso, as mutações genéticas hereditárias do gene MEN1 dão origem à síndrome MEN1, no qual ocorrem tumores primários em duas ou mais glândulas endócrinas. Entre 40 a 70% das pessoas que nascem com mutação no gene MEN1 irão a determinado ponto desenvolver um PanNET.[48] Outros genes que se encontram frequentemente mutados são o DAXX, mTOR e ATRX.[23]
Para além de não fumar, recomenda-se a manutenção de um peso saudável e o aumento do consumo de fruta, verduras e cereais integrais. Geralmente, também se recomenda a diminuição do consumo de carne vermelha e carne processada, embora não haja evidências consistentes de que isto possa prevenir especificamente o cancro do pâncreas.[49] Um estudo de revisão de 2014 concluiu que não há evidência de que o consumo de citrinos e curcumina diminuam o risco de cancro pancreático, enquanto que cereais integrais, ácido fólico, selénio e peixe não frito possivelmente terão um efeito benéfico.[38]
Atualmente, não se considera que o rastreio de grandes grupos entre a população em geral seja eficaz, embora esteja a ser avaliado o rastreio de grupos específicos ou a introdução de novas técnicas.[50][51] No entanto, em pessoas que apresentam risco elevado devido a hereditariedade genética, recomenda-se o rastreio regular com ecografia endoscópica e RM/TC.[4][40][51][52]
Cancros exócrinos
Uma das principais avaliações feita após o diagnóstico é se possível ou não a remoção do tumor por via cirúrgica, uma vez que esta é a única cura para este tipo de cancro. A possibilidade de remoção depende de quanto é que o cancro se propagou. A localização exata do tumor é também um fator significativo, pelo que a TAC pode mostrar como é que o tumor se relaciona com os principais vasos sanguíneos que passam na proximidade do pâncreas. Também deve ser avaliado o estado de saúde geral da pessoa, embora a idade por si só não seja um obstáculo para a cirurgia.[3] Sempre que não é possível a realização da cirurgia, à maior parte das pessoas é oferecida a opção de realizar quimioterapia e, ainda que menos frequente, radioterapia. Os especialistas recomendam que o tratamento do cancro do pâncreas seja realizado por uma equipa multidisciplinar que inclua especialistas em diversas áreas de oncologia, pelo que é geralmente realizado em centros hospitalares de grande dimensão.[2][3]
Cirurgia

A cirurgia com a intenção de cura só é possível em cerca de 20% dos novos casos.[11] Embora as TAC ajudem, na prática pode ser bastante difícil determinar se o tumor pode ou não ser completamente removido. É ainda possível que só na própria cirurgia é que se torne aparente que não será possível remover de forma bem-sucedida o tumor sem danificar outros tecidos vitais. A possibilidade de poder oferecer, ou não, a remoção cirúrgica depende de vários fatores, entre os quais a dimensão precisa do tumor ou quantos vasos sanguíneos venosos ou arteriais estão envolvidos,[2] assim como a avaliação da perícia cirúrgica necessária e da previsão rigorosa da recuperação pós-operatória.[53][54] A idade da pessoa não é em si uma razão para não operar, mas a sua performance precisa de ser adequada a uma grande operação.[11]
Uma característica peculiar que é procurada é a presença encorajadora, ou ausência desencorajadora, de uma camada de gordura que atue como barreira entre o tumor e os vasos sanguíneos.[3] Por norma, é feita uma avaliação da proximidade do tumor em relação aos principais vasos arteriais ou venosos. Esta avaliação verifica se o tumor apenas toca no vaso até ao limite de metade da sua circunferência, se o tumor envolve a maior parte da circunferência do vaso, ou se o tumor envolve por completo o vaso.[55] Em alguns casos, pode ser possível remover secções envoltas de vasos sanguíneos,[56][57] sobretudo quando é possível proceder a terapia neoadjuvante,[58][59][60] usando quimioterapia[54][55][61] e/ou radioterapia.[55]
Mesmo nos casos em que a operação aparenta ter sido bem sucedida, durante o exame microscópico posterior são muitas vezes encontradas células cancerígenas na periferia dos tecidos removidos, o que indica que o cancro possa não ter sido completamente removido.[2] Para além disso, as células estaminais cancerígenas são pouco evidentes ao microscópio e, caso estejam presentes, podem continuar a desenvolver-se e propagar-se.[62][63] Para obter dados claros sobre o resultado pós-operatório, é possível realizar uma laparoscopia, uma pequena intervenção cirúrgica guiada por uma câmara.[64]

Nos cancros que envolvem a cabeça do pâncreas, o procedimento de Whipple é o tratamento cirúrgico curativo mais comum. Esta operação consiste na remoção em simultâneo da cabeça do pâncreas e da curva do dudodeno ("duodenopancreatectomia"), na criação de um bypass para os alimentos desde o estômago até ao jejuno ("gastro-jejunostomia") e na ligação do jejuno ao ducto cístico para drenar a bílis ("colecisto-jejunostomia"). Este procedimento só pode ser realizado caso a pessoa tenha condições de sobreviver a uma intervenção cirúrgica de risco e quando o cancro não invade estruturas locais ou apresenta metástases, pelo que só é possível numa minoria de casos. Os cancros da cauda do pâncreas podem ser removidos através de um procedimento denominado pancreatectomia distal, que em muitos casos implica também a remoção do baço.[2][3] Hoje em dia, este procedimento pode ser feito através de métodos minimamente invasivos.[2][3]
Embora a cirurgia com finalidade curativa já não esteja associada às elevadas taxas de mortalidade que ocorriam até à década de 1980, uma proporção significativa dos doentes (30–45%) continua a necessitar de tratamento para doenças pós-operatórias que não são provocadas pelo cancro em si. A complicação mais comum da cirurgia é a dificuldade em esvaziar o estômago.[3] Podem ainda ser utilizados alguns procedimentos cirúrgicos para aliviar determinados sintomas. Por exemplo, se o cancro estiver a invadir ou comprimir o duodeno ou o intestino grosso, um bypass pode reverter a obstrução e melhorar significativamente a qualidade de vida, embora a intervenção não se destine à cura.[11]
Quimioterapia
Após a cirurgia e um período de recobro de um ou dois meses, pode ser oferecida à pessoa a possibilidade de quimioterapia adjuvante com gencitabina ou 5-FU, desde que esteja apta fisicamente.[4][40] Em pessoas que não estejam aptas a receber cirurgia curativa, a quimioterapia pode ser usada para melhorar a qualidade de vida.[3] Em casos considerados limítrofes em relação à possibilidade de remoção, é possível recorrer a quimioterapia neoadjuvante ou quimioradioterapia de modo a reduzir o cancro até a um nível em que se possa proceder à cirurgia. Nos restantes casos, a terapia neoadjuvante permanece controversa, uma vez que atrasa a cirurgia.[3][4][65]
A gencitabina foi aprovada nos Estados Unidos em 1997, após um ensaio clínico ter verificado a melhorias na qualidade de vida e um prolongamento de cinco semanas na duração média de sobrevivência em pessoas com cancro pancreático avançado.[66] A quimioterapia unicamente com gencitabina foi a norma durante uma década, uma vez que as combinações com outros fármacos não demonstraram resultados significativamente melhores. No entanto, verificou-se que a combinação de gencitabina com erlotinibe aumentava ligeiramente a sobrevivência, tendo esta última sido licenciada para uso em cancro do pâncreas nos Estados Unidos em 2005.[67]
Verificou-se também que o protocolo para tratamento da quimioterapia FOLFIRINOX, que é uma combinação de quatro fármacos, é mais eficaz que a gencitabina. No entanto, possui também efeitos secundários significativos, pelo que só é adequado a pessoas devidamente aptas. Este é também o caso do paclitaxel ligado a proteína (nab-paclitaxel), licenciado pela primeira vez em 2013 para o uso com gencitabina em cancros do pâncreas.[68] Por volta do final de 2013, tanto o FOLFIRINOX como o nab-paclitaxel com gencitabina eram vistos como boas escolhas para pessoas capazes de tolerar os efeitos secundários, enquanto a gencitabina isolada continuava a ser uma opção eficaz para pessoas que não o eram. Está por realizar um ensaio que compare diretamente as duas opções, continuando a ser investigadas outras possíveis combinações. No entanto, as inovações introduzidas nos últimos anos apenas prolongaram o tempo médio de sobrevivência por alguns meses.[66][4]
Radioterapia
A radioterapia pode ser usada como parte do tratamento com o intuito de reduzir o tumor até uma dimensão operável, embora o seu uso em tumores inoperáveis permaneça controverso, uma vez que os resultados dos ensaios são contraditórios.[2] Desde a década de 1980 que o uso de radioterapia enquanto tratamento adjuvante após cirurgia potencialmente curativo tem sido também controverso.[3] A Sociedade Europeia de Oncologia Médica recomenda que a radioterapia adjuvante seja usada apenas em pessoas inscritas em ensaios clínicos.[40] No entanto, há uma crescente tendência entre médicos nos Estados Unidos para o uso de radioterapia. Desde a década de 1980 que vários ensaios clínicos têm testado diversas combinações de tratamentos, mas não existem ainda conclusões definitivas.[3][4]
PanNETs
O tratamento de tumores neuroendócrinos pancreáticos (PanNET), incluindo os tipos malignos menos comuns, pode ser realizado através de diversas abordagens.[44][69][70][71] Alguns tumores de pequena dimensão (< 1 cm) que sejam identificados acidentalmente (por exemplo, durante uma TAC), podem continuar a ser vigiados até haver eventuais alterações significativas.[44] Isto depende da avaliação do risco de cirurgia, o qual é inflenciado pela lozalização do tumor e da presença de outros problemas médicos.[44] Os tumores que estejam situados apenas no pâncreas (tumores localizados) ou com poucas metástases (por exemplo, apenas no fígado), podem ser removidos cirurgicamente. O tipo de cirurgia depende da localização do tumor e do grau de afetação dos gânglios linfáticos.[17]
No caso de tumores localizados, os procedimentos cirúrgicos podem ser muito menos intrusivos do que os tipos de cirurgia usados no tratamento de adenocarcinomas pancreáticos descritos acima. O prognóstico varia imenso; alguns tipos têm uma taxa de sobrevivência bastante elevada após a cirurgia, enquanto para outros o prognóstico é reservado. Uma vez que este grupo de tumores é raro, as recomendações salientam que o tratamento deve ser realizado num centro hospitalar especializado.[23][17] Em determinados casos onde existem metástases no fígado, pode ser considerado um transplante hepático.[72]
Em casos de tumores funcionais, a classe de medicamentos análogos da somatostatina, como a octreotida, pode reduzir a produção excessiva de hormonas.[17] O lanreotide pode atrasar o crescimento do tumor.[73] Se o tumor não permite remoção cirúrgica e provoca sintomas, esses sintomas podem ser diminuídos através de terapia orientada com everolimo ou sunitinib, atrasando o avanço da doença.[23][74][75] A quimioterapia citotóxica padrão é geralmente pouco eficaz no caso dos PanNET, mas pode ser usada quando os outros tratamentos não impedem a progressão da doença,[23][76] ou em cancros PanNET pouco diferenciados.[77]
A radioterapia é ocasionalmente usada quando se verifica dor por extensão anatómica, como no caso de metástases nos ossos. Alguns PanNET absorvem hormonas ou peptídeos específicos, podendo responder à terapia de medicina nuclear com peptídeos ou hormonas com radiotraçadores, como o iobenguano.[78][79][80][81] Podem também ser utilizadas ablação por radiofrequência, crioablação e embolização da artéria hepática.[82][83]
Cuidados paliativos
Cuidados paliativos é a prestação de cuidados de saúde focada no tratamento de sintomas de doenças graves, como o cancro, e na melhoria da qualidade de vida.[84] Uma vez que o adenocarcinoma pancreático geralmente só é diagnosticado quando já se encontra numa fase avançada, os cuidados paliativos são muitas vezes o único tratamento possível.[85] Os cuidados paliativos focam-se no tratamento de sintomas como a dor ou náuseas, e podem auxiliar a tomada de decisões, incluindo quando ou se é necessário o internamento numa unidade dedicada.[86]
A dor pode ser tratada com medicamentos como os opiáceos ou através de intervenções cirúrgicas, como o bloqueio de nervos no plexo solar. Este procedimento altera ou, dependendo da técnica, destrói os nervos que transmitem dor a partir do abdómen, constituindo uma forma segura e eficaz de reduzir a dor, reduzindo também a necessidade de analgésicos ou opiáceos, os quais têm efeitos adversos significativos.[3][87]
Outros sintomas ou complicações que podem ser tratados com cirurgia paliativa são obstruções por parte do tumor dos intestinos ou dos ductos biliares. Neste último caso, que ocorre em mais de metade dos casos de cancro pancreático, é inserido por via endoscópica um stent metálico que mantém a drenagem dos ductos.[27] Os cuidados paliativos também podem ajudar a tratar a depressão associada ao diagnóstico de cancro do pâncreas.[3]
Tanto a cirurgia como os tumores inoperáveis levam muitas vezes a distúrbios no aparelho digestivo, causadas pela ausência de produtos exócrinos no pâncreas (insuficiência exócrina). Estes distúrbios podem ser tratados com pancreatina, um medicamento que contém enzimas pancreáticas sintéticas.[11] A dificuldade em esvaziar o estômago é comum é pode ser um problema grave que necessita de hospitalização. O tratamento pode envolver uma série de abordagens, incluindo a drenagem do estômago por aspiração nasogástrica e por fármacos denominados inibidores da bomba de protões ou antagonistas do receptor H2, os quais reduzem a produção de ácido gástrico.[11]
O adenocarcinoma pancreático e os menos comuns cancros exócrinos apresentam um prognóstico bastante reservado, uma vez que geralmente só são diagnosticados em fases avançadas e quando o cancro já tem uma dimensão considerável ou se propagou para outras partes do corpo.[2] No caso dos PanNET, o prognóstico é superior, uma vez que muitos são benignos e não apresentam quaisquer sintomas clínicos, e mesmo os casos incuráveis apresnetam uma taxa de sobrevivência aos cinco anos superior a 16%.[42] No entanto, o prognóstico varia consideravelmente em função do tipo.[25]
No caso dos denocarcinomas pancreáticos já avançados ou com metástases, que juntos representam 80% dos casos, os diversos ensaios recentes que compararam os regimes de quimioterapia demonstraram uma melhoria no tempo média de sobrevivência, embora não seja superior a um ano.[2][66] Por exemplo, nos Estados Unidos, a taxa de sobrevivência ao quinto ano era de 2% entre 1975 e 1977, melhorando para 4% entre 1987 e 1989 e para 6% entre 2003 e 2009.[36] Nos restantes 20% de casos de adenocarcinoma pancreático com diagnóstico localizado e de pequeno crescimento (<2 cm e estágio T1), cerca de 20% dos norte-americanos sobrevive para além dos cinco anos.[15]

sem dados
<1
1
2
3
4
5
6
7
8
9
10
>10
Em 2012, o cancro do pâncreas foi a causa de 330 000 mortes à escala global,[6] o que representa um aumento em relação às 310 000 mortes em 2010 e 200 000 em 1990.[89] É a sétima principal causa de morte por cancro em todo o mundo.[6] Embora corresponda a apenas 2,5% dos novos casos de cancro, o cancro do pâncreas é responsável por 6% das mortes anuais por cancro.[90]
Globalmente, o cancro do pâncreas é a 11ª causa mais comum de cancro entre as mulheres e a 12ª entre os homens.[6] A maioria dos casos ocorre em países desenvolvidos.[6] As pessoas nos Estados Unidos apresentam um risco de cerca de 1 em 67 (ou 1,5%) de desenvolver a doença,[91] valor ligeiramente superior ao do Reino Unido, que é de 1 em 73 para os homens e 1 em 74 para as mulheres,[92][2][6] embora a diferença se tenha vindo a atenuar em décadas mais recentes. Nos Estados Unidos, o risco entre afro-americanos é cerca de 50% superior ao dos brancos, embora em África e no extremo oriente seja muito inferior ao da Europa e da América do Norte. As taxas de prevalência mais elevadas encontram-se nos Estados Unidos, na Europa central, Argentina e Uruguai.[6] No Reino Unido, o cancro do pâncreas é a 10ª causa de cancro mais comum e a 5ª causa de morte por cancro, tendo causado a morte a cerca de 8700 pessoas em 2012.[93]
PanNET
A incidência anual de PanNET diagnosticados é baixa (cerca de 5 por milhão de pessoas-ano) e é dominada pelos tipos não funcionais.[20] Pensa-se que entre 45 e 90% dos PanNET sejam de tipos não funcionais.[17][23] Os estudos realizados em autópsias têm revelado frequentemente a existência de PanNET, sugerindo que a prevalência de tumores que permanece inerte e assintomática possa ser relativamente elevada.[23] Em termos gerais, pensa-se que os PanNET correspondam a 1 - 2 % de todos os tumores pancreáticos.[20] A própria definição e classificação dos PanNET tem vindo a ser alterada, o que afeta os dados epidemiológicos e de relevância clínica.[47]
A mais antiga identificação de cancro pancreático tem sido atribuída ao cientista italiano do séc XVIII Giovanni Battista Morgagni, fundador da patologia anatómica contemporânea, que alegou ter observado vários casos de cancro no pâncreas. Durante os séculos XVIII e XIX, muitos médicos estavam céticos em relação à existência da doença, dada a semelhança com a pancreatite. Nas décadas de 1820 e 1830 foram publicados alguns estudos de caso, tendo também sido registado o primeiro diagnóstico histopatológico genuíno, da autoria do clínico norte-americano Jacob Mendes Da Costa, o qual também levantou várias dúvidas em relação à fiabilidade das interpretações de Morgagni. Por volta do início do século XX, o cancro da cabeça do pâncreas era já um diagnóstico perfeitamente estabelecido.[94]
Relativamente à identificação dos PanNET, a possibilidade da existência de cancro nas ilhotas de Langerhans foi sugerida pela primeira vez em 1888. O primeiro caso de hiperinsulinismo devido a um tumor deste tipo foi documentado em 1927. A primeira identificação de um PanNET de tipo não segregador de insulina é atribuída aos cirurgiões norte-americanos R. M. Zollinger e E. H. Ellison, que deram o nome à síndrome de Zollinger-Ellison após terem postulado a existência de um tumor pancreático segregador de gastrina num relatório de dois casos de úlceras pépticas invulgarmente graves publicado em 1955.[94] Em 2010, a Organização Mundial de Saúde recomendou que os PanNET fossem referidos como tumores "neuroendócrinos" em vez de "endócrinos".[22]
A primeira duodenopancreatectomia foi realizada pelo cirurgião italiano Alessandro Codivilla em 1898, embora o paciente só tenha sobrevivido por dezoito dias antes de morrer devido a complicações. As primeiras operações eram comprometidas, em parte, pela falsa crença de que a pessoa morreria se lhe fosse removido o duodeno e se fosse interrompida a afluência de secreções pancreáticas. Mais tarde chegou-se a pensar, também de forma equivocada, que o ducto pancreático poderia ser simplesmente atado sem quaisquer efeitos adversos graves.[95] Em 1912, o cirurgião alemão Walther Kausch foi o primeiro a remover partes significativas do duodeno e do pâncreas em simultâneo (en bloc). Em 1918, demonstrou-se em operações em animais de que a remoção por completo do duodeno é compatível com a vida, mas só em 1935 é que surgiu o primeiro caso documentado em seres humanos, quando o cirurgião norte-americano Allen Oldfather Whipple publicou os resultados de uma série de três operações em Nova Iorque. Só um dos pacientes é que teve o duodeno removido por completo, mas sobreviveu durante dois anos antes de ter morrido devido a metástases no fígado. No entanto, a primeira operação foi imprevista, uma vez que só no bloco operatório é que o cancro foi descoberto. A bem sucedida operação de Whipple mostrou o caminho para o futuro, embora a operação tenha permanecido difícil e de elevado risco até décadas recentes. Whipple publicou vários ajustes à sua técnica, incluindo a primeira remoção total do duodeno em 1940, embora só tenha realizado 37 operações no total.[95]
A partir do fim da década de 1930, a sobrevivência pós operatória foi melhorada com a descoberta de que a vitamina K prevenia hemorragias com icterícia e com a vulgarização das transfusões de sangue.[95] No entanto, até à década de 1970 que cerca de 25% das pessoas morria durante ou imediatamente após a cirurgia, levando inclusive um grupo de cirurgiões norte-americanos a propôr que esta técnica fosse abandonada.[96] No entanto, desde então que os resultados nos maiores centros têm melhorado consideravelmente e a taxa de mortalidade é hoje em dia inferior a 4%.[18] Em 2006, foi publicado um relatório sobre uma série de 1000 duodenopancreatectomias sucessivas realizadas no Johns Hopkins Hospital entre 1969 e 2003. Neste intervalo, a quantidade de operações foi aumentando progressivamente, tendo sido realizadas apenas 3 antes de 1980, ao mesmo tempo que a duração média da intervenção foi diminuindo, desde 8,8 horas na década de 1970 até 5,5 horas na década de 2000. A mortalidade no hospital ou no prazo de 30 dias foi de apenas 1%.[95][96] Outra série de 2050 operações no Massachusetts General Hospital entre 1941 e 2011 mostrou melhorias idênticas.[97]
Graças às técnicas de imagiologia médica modernas, estão a ser detectados a um ritmo sem precedentes várias pequenas neoplasias pré-cancerígenas de diversos cancros pancreáticos. Uma destas neoplasias, a neoplasia intraductal papilar mucinosa, foi descrita pela primeira vez por investigadores japoneses em 1982. Após uma década com pouca ou nenhuma atenção dada a este relatório, nos quinze anos que se seguiram verificou-se uma súbito e imenso interesse no reconhecimento destes tumores.[43]
Estão em curso diversas iniciativas à escala global para melhor compreender o cancro pancreático, embora os progressos tenham sido lentos, em particular no que diz respeito à compreensão das causas da doença.[98] Existem diversas questões fundamentais ainda sem resposta.[99][100] A natureza das alterações que causam a doença estão a ser amplamente investigadas, assim como o papel desempenhado por determinados genes como o KRAS ou o p53.[34][101][102] Uma questão fundamental é a cronologia dos eventos à medida que a doença se desenvolve e progride, em particular o papel da diabetes,[103] e como e quando a doença se propaga.[104]
Também estão em investigação métodos de deteção precoce.[50][51] Por exemplo, o ensaio do Registo Europeu de cancro do pâncreas familiar e pancreatite hereditária (EUROPAC) pretende determinar se o rastreio regular é apropriado para pessoas com antecedentes familiares da doença ou que apresentem pancreatite familiar.[105] A conclusão de que o aparecimento de diabetes possa ser um sintoma inicial da doença poderá vir a facilitar diagnósticos atempados, caso possa ser criada uma estratégia viável.[103][106][107]
Outra área de interesse é a avaliação da laparoscopia enquanto forma preferencial de tratamento em relação ao procedimento de Whipple no tratamento cirúrgico da doença, principalmente no que diz respeito ao tempo de recobro.[108] A eletroporação irreversível é uma técnica de ablação relativamente recente que se tem revelado promissora no prolongamento do tempo de sobrevivência em pessoas com doença localmente avançada. É particularmente adequada para o tratamento de tumores próximos de vasos peripancreáticos sem risco de trauma vascular.[109][110] Alguns resultados pós-cirurgia satisfatórios levaram à realização de uma série de ensaios em 2014 para testar os resultados usando quimioterapia ou radioquimioterapia pré-cirurgia. Embora anteriormente este procedimento não se tenha revelado útil, os novos ensaios usam combinações de fármacos que emergiram a partir de vários ensaios de terapias pós-cirúrgicas, como o FOLFIRINOX.[2]
Estão também a ser investigados novos fármacos.[34][111] Alguns envolvem terapias direcionadas contra os mecanismos moleculares das células cancerígenas.[112][113] Outros têm como alvo as células estaminais cancerígenas extremamente resistentes.[63][114] Outros ainda destinam-se a interferir com o estroma não neoplástico e com o microambiente do tumor, que se sabe que influencia a proliferação celular e a metástase.[113][114][115][116][117] Outra abordagem envolve o uso de imunoterapias, como os vírus oncolíticos.[118][119]
- «Pancreatic Cancer Treatment (PDQ®) Patient Version». National Cancer Institute. National Institutes of Health. 17 de abril de 2014. Consultado em 8 de junho de 2014
- Ryan DP, Hong TS, Bardeesy N (Setembro de 2014). «Pancreatic adenocarcinoma» (PDF). N. Engl. J. Med. 371 (11): 1039–49. PMID 25207767. doi:10.1056/NEJMra1404198
- Wolfgang CL, Herman JM, Laheru DA, Klein AP, Erdek MA, Fishman EK, Hruban RH (Setembro de 2013). «Recent progress in pancreatic cancer». CA: a Cancer Journal for Clinicians. 63 (5): 318–48. PMC 3769458
 . PMID 23856911. doi:10.3322/caac.21190
. PMID 23856911. doi:10.3322/caac.21190 - Vincent A, Herman J, Schulick R, Hruban RH, Goggins M (Agosto de 2011). «Pancreatic cancer» (PDF). Lancet. 378 (9791): 607–20. PMID 21620466. doi:10.1016/S0140-6736(10)62307-0
- «Can pancreatic cancer be prevented?». American Cancer Society. 11 de junho de 2014. Consultado em 13 de novembro de 2014
- «5.7». World Cancer Report 2014. [S.l.]: Organização Mundial de Saúde. 2014. ISBN 92-832-0429-8
- «Cancer Facts & Figures 2010» (PDF). American Cancer Society. 2010. Consultado em 5 de dezembro de 2014
- GBD 2015 Disease and Injury Incidence and Prevalence, Collaborators. (8 de outubro de 2016). «Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015». Lancet. 388 (10053): 1545–1602. PMC 5055577
 . PMID 27733282. doi:10.1016/S0140-6736(16)31678-6
. PMID 27733282. doi:10.1016/S0140-6736(16)31678-6 - GBD 2015 Mortality and Causes of Death, Collaborators. (8 de outubro de 2016). «Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980–2015: a systematic analysis for the Global Burden of Disease Study 2015». Lancet. 388 (10053): 1459–1544. PMC 5388903
 . PMID 27733281. doi:10.1016/s0140-6736(16)31012-1
. PMID 27733281. doi:10.1016/s0140-6736(16)31012-1 - National Institutes of Health (7 de março de 2014). «What is Cancer? Defining Cancer». National Cancer Institute. Consultado em 5 de dezembro de 2014
- Bond-Smith G, Banga N, Hammond TM, Imber CJ (2012). «Pancreatic adenocarcinoma» (PDF). BMJ (Clinical research ed.). 344: e2476. PMID 22592847. doi:10.1136/bmj.e2476
- Bussom S, Saif MW (5 de março de 2010). «Methods and rationale for the early detection of pancreatic cancer. Highlights from the "2010 ASCO Gastrointestinal Cancers Symposium". Orlando, FL, USA. January 22–24, 2010». JOP : Journal of the pancreas. 11 (2): 128–30. PMID 20208319
- Shahrokni A, Saif MW (10 de julho de 2013). «Metastatic pancreatic cancer: the dilemma of quality vs. quantity of life». JOP : Journal of the pancreas. 14 (4): 391–4. PMID 23846935. doi:10.6092/1590-8577/1663
- Bardou M, Le Ray I (dezembro de 2013). «Treatment of pancreatic cancer: A narrative review of cost-effectiveness studies». Best practice & research. Clinical gastroenterology. 27 (6): 881–92. PMID 24182608. doi:10.1016/j.bpg.2013.09.006
- «Pancreatic Cancer Treatment (PDQ®) Health Professional Version». National Cancer Institute. National Institutes of Health. 21 de fevereiro de 2014. Consultado em 24 de novembro de 2014
- Harris, RE (2013). «Epidemiology of pancreatic cancer». Epidemiology of Chronic Disease. [S.l.]: Jones & Bartlett. pp. 181–190. ISBN 978-0-7637-8047-0
- Öberg K, Knigge U, Kwekkeboom D, Perren A (Outubro de 2012). «Neuroendocrine gastro-entero-pancreatic tumors: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up». Annals of Oncology: Official Journal of the European Society for Medical Oncology / ESMO. 23 Suppl 7: vii124–30. PMID 22997445. doi:10.1093/annonc/mds295
- Govindan R (2011). «Chapter 35: Cancer of the Pancreas: Surgical Management». DeVita, Hellman, and Rosenberg's Cancer: Cancer: Principles & Practice of Oncology 9ª ed. [S.l.]: Lippincott Williams & Wilkins. ISBN 978-1-4511-0545-2
- Tobias JS, Hochhauser D (2010). Cancer and its Management 6th ed. [S.l.: s.n.] pp. 276–7. ISBN 978-1-1187-1325-9
- «Types of Pancreas Tumors». The Sol Goldman Pancreas Cancer Research Center. Johns Hopkins Medicine. 2012. Consultado em 18 de novembro de 2014
- Farrell JJ, Fernández-del Castillo C (Junho de 2013). «Pancreatic cystic neoplasms: management and unanswered questions». Gastroenterology. 144 (6): 1303–15. PMID 23622140. doi:10.1053/j.gastro.2013.01.073
- A denominação PanNET está de acordo com as recomendações da OMS para a classificação de tumores do sistema digestivo publicadas em 2010. Anteriormente, os PanNET eram referidos por diversos termos, sendo ainda hoje frequentemente denominados "tumores endócrinos pancreáticos". Ver: Klimstra DS, Modlin IR, Coppola D, Lloyd RV, Suster S (Agosto de 2010). «The pathologic classification of neuroendocrine tumors: a review of nomenclature, grading, and staging systems» (PDF). Pancreas. 39 (6): 707–12. PMID 20664470. doi:10.1097/MPA.0b013e3181ec124e
- Burns WR, Edil BH (Março de 2012). «Neuroendocrine pancreatic tumors: guidelines for management and update». Current treatment options in oncology. 13 (1): 24–34. PMID 22198808. doi:10.1007/s11864-011-0172-2
- O sistema de indexação Medical Subject Headings menciona "tumores de células das ilhotas", que se divide em gastrinoma, glucagonoma, somatostatinoma e VIPoma. Ver "Pancreatic Neoplasms [C04.588.322.475]" 16 de outubro de 2014
- «Islet Cell Tumors of the Pancreas / Endocrine Neoplasms of the Pancreas». The Sol Goldman Pancreas Cancer Research Center. Johns Hopkins Medicine. 2012. Consultado em 5 de janeiro de 2015
- Ducla Soares, José Luís (2007). Semiologia Médica: Princípios, Métodos e Interpretação. [S.l.: s.n.] ISBN 9789727574261
- Alberts, SR; Goldberg, RM (2009). «Chapter 9: Gastrointestinal tract cancers». In: Casciato, DA; Territo, MC. Manual of clinical oncology. [S.l.]: Lippincot Williams & Wilkins. pp. 188–236. ISBN 9780781768849
- Pannala R, Basu A, Petersen GM, Chari ST (janeiro de 2009). «New-onset diabetes: a potential clue to the early diagnosis of pancreatic cancer». The Lancet. Oncology. 10 (1): 88–95. PMC 2795483
 . PMID 19111249. doi:10.1016/S1470-2045(08)70337-1
. PMID 19111249. doi:10.1016/S1470-2045(08)70337-1 - «Chapter 15; Pancreas». Manual for Staging of Cancer (PDF) 2ª ed. [S.l.]: American Joint Committee on Cancer. pp. 95–8
- «Causes of pancreatic cancer». NHS Choices. National Health Service, England. 7 de outubro de 2014. Consultado em 5 de dezembro de 2014
- Bosetti C, Lucenteforte E, Silverman DT, Petersen G, Bracci PM, Ji BT, Negri E, Li D, Risch HA, Olson SH, Gallinger S, Miller AB, Bueno-de-Mesquita HB, Talamini R, Polesel J, Ghadirian P, Baghurst PA, Zatonski W, Fontham E, Bamlet WR, Holly EA, Bertuccio P, Gao YT, Hassan M, Yu H, Kurtz RC, Cotterchio M, Su J, Maisonneuve P, Duell EJ, Boffetta P, La Vecchia C (Julho de 2012). «Cigarette smoking and pancreatic cancer: an analysis from the International Pancreatic Cancer Case-Control Consortium (Panc4)». Annals of oncology : official journal of the European Society for Medical Oncology / ESMO. 23 (7): 1880–8. PMID 22104574. doi:10.1093/annonc/mdr541
- Reznik R, Hendifar AE, Tuli R (2014). «Genetic determinants and potential therapeutic targets for pancreatic adenocarcinoma». Front Physiol. 5: 87. PMC 3939680
 . PMID 24624093. doi:10.3389/fphys.2014.00087
. PMID 24624093. doi:10.3389/fphys.2014.00087 - Greenhalf W, Grocock C, Harcus M, Neoptolemos J (2009). «Screening of high-risk families for pancreatic cancer». Pancreatology. 9 (3): 215–22. PMID 19349734. doi:10.1159/000210262
- «Cancer Facts and Figures 2014» (PDF). American Cancer Society. Consultado em 5 de janeiro de 2015
- Larsson SC, Wolk A (Janeiro de 2012). «Red and processed meat consumption and risk of pancreatic cancer: meta-analysis of prospective studies». Br J Cancer. Online first (3): 603–7. PMC 3273353
 . PMID 22240790. doi:10.1038/bjc.2011.585
. PMID 22240790. doi:10.1038/bjc.2011.585 - Fitzgerald JE, White MJ, Lobo DN (Abril de 2009). «Courvoisier's gallbladder: law or sign?» (PDF). World Journal of Surgery. 33 (4): 886–91. PMID 19190960. doi:10.1007/s00268-008-9908-y
- Seufferlein T, Bachet JB, Van Cutsem E, Rougier P (Outubro de 2012). «Pancreatic adenocarcinoma: ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up». Annals of oncology : official journal of the European Society for Medical Oncology / ESMO. 23 Suppl 7: vii33–40. PMID 22997452. doi:10.1093/annonc/mds224
- Cascinu S, Falconi M, Valentini V, Jelic S (Maio de 2010). «Pancreatic cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up». Annals of Oncology: Official Journal of the European Society for Medical Oncology / ESMO. 21 Suppl 5: v55–8. PMID 20555103. doi:10.1093/annonc/mdq165
- «Staging of pancreatic cancer». American Cancer Society. 11 de junho de 2014. Consultado em 29 de setembro de 2014
- Silberman; Howard; Silberman, Allan W.; Nakeeb, Attila; Lillemoe, Keith; D. (2010). Principles and practice of surgical oncology : multidisciplinary approach to difficult problems online ed. Filadélfia: Wolters Kluwer/Lippincott Williams & Wilkins. capítulo 35. ISBN 978-0-7817-6546-6
- «Neuroendocrine tumors, NCCN Guidelines Version 1.2015» (PDF). NCCN Guidelines. National Comprehensive Cancer Network, Inc. 11 de novembro de 2014. Consultado em 25 de dezembro de 2014
- National Cancer Institute. «Pancreatic Neuroendocrine Tumors (Islet Cell Tumors) Treatment (PDQ®) Incidence and Mortality»
- Delpu Y, Hanoun N, Lulka H, Sicard F, Selves J, Buscail L, Torrisani J, Cordelier P (2011). «Genetic and epigenetic alterations in pancreatic carcinogenesis». Curr Genomics. 12 (1): 15–24. PMC 3129039
 . PMID 21886451. doi:10.2174/138920211794520132
. PMID 21886451. doi:10.2174/138920211794520132 - Lewis MA, Yao JC. «Molecular pathology and genetics of gastrointestinal neuroendocrine tumours». Current Opinion in Endocrinology & Diabetes and Obesity. 21 (1): 22–7. PMID 24310147. doi:10.1097/MED.0000000000000033
- Thakker RV, Newey PJ, Walls GV, Bilezikian J, Dralle H, Ebeling PR, Melmed S, Sakurai A, Tonelli F, Brandi ML (Setembro de 2012). «Clinical practice guidelines for multiple endocrine neoplasia type 1 (MEN1)» (PDF). The Journal of Clinical Endocrinology and Metabolism. 97 (9): 2990–3011. PMID 22723327. doi:10.1210/jc.2012-1230
- «Diet and activity factors that affect risks for certain cancers: Pancreatic cancer section». American Cancer Society. 20 de agosto de 2012. Consultado em 4 de novembro de 2014
- He XY, Yuan YZ (Agosto de 2014). «Advances in pancreatic cancer research: moving towards early detection». World J. Gastroenterol. 20 (32): 11241–8. PMC 4145762
 . PMID 25170208. doi:10.3748/wjg.v20.i32.11241
. PMID 25170208. doi:10.3748/wjg.v20.i32.11241 - Okano K, Suzuki Y (Agosto de 2014). «Strategies for early detection of resectable pancreatic cancer». World J. Gastroenterol. 20 (32): 11230–40. PMC 4145761
 . PMID 25170207. doi:10.3748/wjg.v20.i32.11230
. PMID 25170207. doi:10.3748/wjg.v20.i32.11230 - Stoita A, Penman ID, Williams DB (Maio de 2011). «Review of screening for pancreatic cancer in high risk individuals». World J. Gastroenterol. 17 (19): 2365–71. PMC 3103788
 . PMID 21633635. doi:10.3748/wjg.v17.i19.2365
. PMID 21633635. doi:10.3748/wjg.v17.i19.2365 - Gurusamy KS, Kumar S, Davidson BR, Fusai G (2014). «Cochrane Database of Systematic Reviews». The Cochrane database of systematic reviews. 2: CD010244. PMID 24578248. doi:10.1002/14651858.CD010244.pub2
- Mollberg N, Rahbari NN, Koch M, Hartwig W, Hoeger Y, Büchler MW, Weitz J (2011). «Arterial resection during pancreatectomy for pancreatic cancer: A systematic review and meta-analysis». Annals of Surgery. 254 (6): 882–93. PMID 22064622. doi:10.1097/SLA.0b013e31823ac299
- «Pancreatic adenocarcinoma. NCCN Guidelines Version 1.2015» (PDF). NCCN Guidelines. National Comprehensive Cancer Network, Inc. 4 de dezembro de 2014. Consultado em 26 de dezembro de 2014
- Alamo JM, Marín LM, Suarez G, Bernal C, Serrano J, Barrera L, Gómez MA, Muntané J, Padillo FJ (2014). «Improving outcomes in pancreatic cancer: key points in perioperative management». World J. Gastroenterol. 20 (39): 14237–45. PMC 4202352
 . PMID 25339810. doi:10.3748/wjg.v20.i39.14237
. PMID 25339810. doi:10.3748/wjg.v20.i39.14237 - Lopez NE, Prendergast C, Lowy AM (2014). «Borderline resectable pancreatic cancer: definitions and management». World J. Gastroenterol. 20 (31): 10740–51. PMC 4138454
 . PMID 25152577. doi:10.3748/wjg.v20.i31.10740
. PMID 25152577. doi:10.3748/wjg.v20.i31.10740 - Polistina F, Di Natale G, Bonciarelli G, Ambrosino G, Frego M (2014). «Neoadjuvant strategies for pancreatic cancer». World J. Gastroenterol. 20 (28): 9374–83. PMC 4110569
 . PMID 25071332. doi:10.3748/wjg.v20.i28.9374
. PMID 25071332. doi:10.3748/wjg.v20.i28.9374 - Gillen S, Schuster T, Meyer Zum Büschenfelde C, Friess H, Kleeff J (2010). «Preoperative/neoadjuvant therapy in pancreatic cancer: a systematic review and meta-analysis of response and resection percentages». PLoS Med. 7 (4): e1000267. PMC 2857873
 . PMID 20422030. doi:10.1371/journal.pmed.1000267
. PMID 20422030. doi:10.1371/journal.pmed.1000267 - Christians KK, Evans DB (2014). «Additional Support for Neoadjuvant Therapy in the Management of Pancreatic Cancer». Ann. Surg. Oncol. PMID 25519932. doi:10.1245/s10434-014-4307-0
- Tsvetkova EV, Asmis TR (2014). «Role of neoadjuvant therapy in the management of pancreatic cancer: is the era of biomarker-directed therapy here?». Curr Oncol. 21 (4): e650–7. PMC 4117630
 . PMID 25089113. doi:10.3747/co.21.2006
. PMID 25089113. doi:10.3747/co.21.2006 - Zhan HX, Xu JW, Wu D, Zhang TP, Hu SY (2015). «Pancreatic cancer stem cells: New insight into a stubborn disease». Cancer Lett. 357 (2): 429–37. PMID 25499079. doi:10.1016/j.canlet.2014.12.004
- Tanase CP, Neagu AI, Necula LG, Mambet C, Enciu AM, Calenic B, Cruceru ML, Albulescu R (2014). «Cancer stem cells: Involvement in pancreatic cancer pathogenesis and perspectives on cancer therapeutics». World Journal of Gastroenterology. 20 (31): 10790-801. PMC 4138459
 . PMID 25152582. doi:10.3748/wjg.v20.i31.10790
. PMID 25152582. doi:10.3748/wjg.v20.i31.10790 - Allen VB, Gurusamy KS, Takwoingi Y, Kalia A, Davidson BR (2013). «Diagnostic accuracy of laparoscopy following computed tomography (CT) scanning for assessing the resectability with curative intent in pancreatic and periampullary cancer». Cochrane Database Syst Rev. 11: CD009323. PMID 24272022. doi:10.1002/14651858.CD009323.pub2
- «Cancer Drug Information: FDA Approval for Erlotinib Hydrochloride». National Cancer Institute. National Institutes of Health. 3 de julho de 2013. Consultado em 5 de dezembro de 2014
- Borazanci E, Von Hoff DD; Von Hoff, DD (Setembro de 2014). «Nab-paclitaxel and gemcitabine for the treatment of people with metastatic pancreatic cancer». Expert Rev Gastroenterol Hepatol. 8 (7): 739–47. PMID 24882381. doi:10.1586/17474124.2014.925799
- Falconi M, Bartsch DK, Eriksson B, Klöppel G, Lopes JM, O'Connor JM, Salazar R, Taal BG, Vullierme MP, O'Toole D (2012). «ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms of the digestive system: Well-differentiated pancreatic non-functioning tumors». Neuroendocrinology. 95 (2): 120–34. PMID 22261872. doi:10.1159/000335587
- Jensen RT, Cadiot G, Brandi ML, de Herder WW, Kaltsas G, Komminoth P, Scoazec JY, Salazar R, Sauvanet A, Kianmanesh R (2012). «ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms: Functional pancreatic endocrine tumor syndromes». Neuroendocrinology. 95 (2): 98–119. PMC 3701449
 . PMID 22261919. doi:10.1159/000335591
. PMID 22261919. doi:10.1159/000335591 - Pavel M, Baudin E, Couvelard A, Krenning E, Öberg K, Steinmüller T, Anlauf M, Wiedenmann B, Salazar R (2012). «ENETS Consensus Guidelines for the management of patients with liver and other distant metastases from neuroendocrine neoplasms of foregut, midgut, hindgut, and unknown primary». Neuroendocrinology. 95 (2): 157–76. PMID 22262022. doi:10.1159/000335597
- Rossi RE, Massironi S, Conte D, Peracchi M (2014). «Therapy for metastatic pancreatic neuroendocrine tumors». Annals of Translational Medicine. 2 (1): 8. PMID 25332984. doi:10.3978/j.issn.2305-5839.2013.03.01
- Nick Mulcahy (17 de dezembro de 2014). «FDA Approves Lanreotide for Neuroendocrine Tumors». Medscape Medical News. WebMD LLC. Consultado em 25 de dezembro de 2014
- «Everolimus Approved for Pancreatic Neuroendocrine Tumors.». The ASCO Post. 2 (8). 15 de maio de 2011
- National Cancer Institute. Cancer Drug Information. «FDA Approval for Sunitinib Malate. Pancreatic Neuroendocrine Tumors»
- Tejani MA, Saif MW (2014). «Pancreatic neuroendocrine tumors: Does chemotherapy work?». JOP: Journal of the pancreas. 15 (2): 132–4. PMID 24618436. doi:10.6092/1590-8577/2301
- Benson AB, Myerson RJ, Sasson AR. «Pancreatic, neuroendocrine GI, and adrenal cancers. Cancer Management: A Multidisciplinary Approach 13th edition 2010.». ISBN 978-0-615-41824-7
- Gulenchyn KY, Yao X, Asa SL, Singh S, Law C (2012). «Radionuclide therapy in neuroendocrine tumours: A systematic review». Clinical Oncology. 24 (4): 294–308. PMID 22221516. doi:10.1016/j.clon.2011.12.003
- Vinik AI (2014). «Advances in Diagnosis and Treatment of Pancreatic Neuroendocrine Tumors (PNETS)». Endocrine Practice. 20 (11): 1–23. PMID 25297671. doi:10.4158/EP14373.RA
- Kwekkeboom DJ, de Herder WW, van Eijck CH, Kam BL, van Essen M, Teunissen JJ, Krenning EP (2010). «Peptide receptor radionuclide therapy in patients with gastroenteropancreatic neuroendocrine tumors». Seminars in Nuclear Medicine. 40 (2): 78–88. PMID 20113677. doi:10.1053/j.semnuclmed.2009.10.004
- Bodei L, Cremonesi M, Kidd M, Grana CM, Severi S, Modlin IM, Paganelli G (2014). «Peptide receptor radionuclide therapy for advanced neuroendocrine tumors». Thoracic Surgery Clinics. 24 (3): 333–49. PMID 25065935. doi:10.1016/j.thorsurg.2014.04.005
- Castellano D, Grande E, Valle J, Capdevila J, Reidy-Lagunes D, O'Connor JM, Raymond E (2014). «Expert consensus for the management of advanced or metastatic pancreatic neuroendocrine and carcinoid tumors». Cancer Chemotherapy and Pharmacology. PMID 25480314. doi:10.1007/s00280-014-2642-2
- Singh S, Dey C, Kennecke H, Kocha W, Maroun J, Metrakos P, Mukhtar T, Pasieka J, Rayson D, Rowsell C, Sideris L, Wong R, Law C (2014). «Consensus Recommendations for the Diagnosis and Management of Pancreatic Neuroendocrine Tumors: Guidelines from a Canadian National Expert Group». Annals of Surgical Oncology. PMID 25366583. doi:10.1245/s10434-014-4145-0
- «Palliative or Supportive Care». American Cancer Society. 2014. Consultado em 20 de agosto de 2014
- Buanes TA (14 de agosto de 2014). «Pancreatic cancer-improved care achievable». World journal of gastroenterology : WJG. 20 (30): 10405–18. PMID 25132756. doi:10.3748/wjg.v20.i30.10405
- «If treatment for pancreatic cancer stops working». American Cancer Society. 11 de junho de 2014. Consultado em 20 de agosto de 2014
- Arcidiacono PG, Calori G, Carrara S, McNicol ED, Testoni PA (2011). Arcidiacono, Paolo G, ed. «Celiac plexus block for pancreatic cancer pain in adults». Cochrane Database Syst Rev (3): CD007519. PMID 21412903. doi:10.1002/14651858.CD007519.pub2
- «WHO Disease and injury country estimates». World Health Organization. 2009. Consultado em 11 de novembro de 2009
- Lozano R, Naghavi M, Foreman K, Lim S, Shibuya K, Aboyans V, Abraham J, Adair T, Aggarwal R; et al. (Dezembro de 2012). «Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010». Lancet. 380 (9859): 2095–128. PMID 23245604. doi:10.1016/S0140-6736(12)61728-0
- Jemal A, Siegel R, Ward E, Murray T, Xu J, Thun MJ (2007). «Cancer statistics, 2007». CA. 57 (1): 43–66. PMID 17237035. doi:10.3322/canjclin.57.1.43
- «What are the key statistics about pancreatic cancer?». American Cancer Society. 11 de junho de 2014. Consultado em 11 de novembro de 2014
- «Pancreatic cancer statistics». Cancer Research UK. Consultado em 18 de dezembro de 2014
- «Pancreatic cancer statistics». Cancer Research UK. Consultado em 28 de outubro de 2014
- Busnardo AC, DiDio LJ, Tidrick RT, Thomford NR (1983). «History of the pancreas» (PDF). American Journal of Surgery. 146 (5): 539–50. PMID 6356946. doi:10.1016/0002-9610(83)90286-6
- Are C, Dhir M, Ravipati L (Junho de 2011). «History of pancreaticoduodenectomy: early misconceptions, initial milestones and the pioneers». HPB : the official journal of the International Hepato Pancreato Biliary Association. 13 (6): 377–84. PMID 21609369. doi:10.1111/j.1477-2574.2011.00305.x
- Cameron JL, Riall TS, Coleman J, Belcher KA (Julho de 2006). «One thousand consecutive pancreaticoduodenectomies». Annals of surgery. 244 (1): 10–5. PMID 16794383. doi:10.1097/01.sla.0000217673.04165.ea
- Fernández-del Castillo C, Morales-Oyarvide V, McGrath D, Wargo JA, Ferrone CR, Thayer SP, Lillemoe KD, Warshaw AL (Setembro de 2012). «Evolution of the Whipple procedure at the Massachusetts General Hospital». Surgery. 152 (3 Suppl 1): S56–63. PMC 3806095
 . PMID 22770961. doi:10.1016/j.surg.2012.05.022
. PMID 22770961. doi:10.1016/j.surg.2012.05.022 - Wolpin BM, Stampfer MJ (Julho de 2009). «Defining determinants of pancreatic cancer risk: are we making progress?». J. Natl. Cancer Inst. 101 (14): 972–3. PMID 19561317. doi:10.1093/jnci/djp182
- «What's new in pancreatic cancer research and treatment?». American Cancer Society. 11 de junho de 2014. Consultado em 17 de julho de 2014
- «Pancreatic cancer research». Cancer Research UK. Consultado em 17 de julho de 2014
- «Australian Pancreatic Genome Initiative». Garvan Institute. Consultado em 17 de julho de 2014
- Biankin AV, Waddell N, Kassahn KS, Gingras MC, Muthuswamy LB, Johns AL, Miller DK, Wilson PJ; et al. (Novembro de 2012). «Pancreatic cancer genomes reveal aberrations in axon guidance pathway genes». Nature. 491 (7424): 399–405. PMC 3530898
 . PMID 23103869. doi:10.1038/nature11547
. PMID 23103869. doi:10.1038/nature11547 - Pannala R, Basu A, Petersen GM, Chari ST (Janeiro de 2009). «New-onset diabetes: a potential clue to the early diagnosis of pancreatic cancer». Lancet Oncol. 10 (1): 88–95. PMC 2795483
 . PMID 19111249. doi:10.1016/S1470-2045(08)70337-1
. PMID 19111249. doi:10.1016/S1470-2045(08)70337-1 - Graham JS, Jamieson NB, Rulach R, Grimmond SM, Chang DK, Biankin AV (Novembro de 2014). «Pancreatic cancer genomics: where can the science take us?». Clin. Genet. PMID 25388820. doi:10.1111/cge.12536
- «About EUROPAC». European Registry of Hereditary Pancreatitis and Familial Pancreatic Cancer (EUROPAC). University of Liverpool. Consultado em 17 de julho de 2014
- Subar D, Gobardhan PD, Gayet B. «Laparoscopic pancreatic surgery». Best Practice & Research Clinical Gastroenterology. 28 (1): 123–32. doi:10.1016/j.bpg.2013.11.011
- Moir J, White SA, French JJ, Littler P, Manas DM (Dezembro de 2014). «Systematic review of irreversible electroporation in the treatment of advanced pancreatic cancer». European journal of surgical oncology : the journal of the European Society of Surgical Oncology and the British Association of Surgical Oncology. 40 (12): 1598–1604. PMID 25307210
- Al Haddad AH, Adrian TE (Novembro de 2014). «Challenges and future directions in therapeutics for pancreatic ductal adenocarcinoma». Expert Opin Investig Drugs. 23 (11): 1499–515. PMID 25078674. doi:10.1517/13543784.2014.933206
- Kleger A, Perkhofer L, Seufferlein T (Julho de 2014). «Smarter drugs emerging in pancreatic cancer therapy». Ann. Oncol. 25 (7): 1260–70. PMID 24631947. doi:10.1093/annonc/mdu013
- Tang SC, Chen YC (Agosto de 2014). «Novel therapeutic targets for pancreatic cancer». World Journal of Gastroenterology. 20 (31): 10825–44. PMC 4138462
 . PMID 25152585. doi:10.3748/wjg.v20.i31.10825
. PMID 25152585. doi:10.3748/wjg.v20.i31.10825 - Schober M, Jesenofsky R, Faissner R, Weidenauer C, Hagmann W, Michl P, Heuchel RL, Haas SL, Löhr JM (2014). «Desmoplasia and chemoresistance in pancreatic cancer». Cancers (Basel). 6 (4): 2137–54. PMC 4276960
 . PMID 25337831. doi:10.3390/cancers6042137
. PMID 25337831. doi:10.3390/cancers6042137 - Rossi ML, Rehman AA, Gondi CS (2014). «Therapeutic options for the management of pancreatic cancer». World J. Gastroenterol. 20 (32): 11142–59. PMC 4145755
 . PMID 25170201. doi:10.3748/wjg.v20.i32.11142
. PMID 25170201. doi:10.3748/wjg.v20.i32.11142 - Neesse A, Krug S, Gress TM, Tuveson DA, Michl P (2013). «Emerging concepts in pancreatic cancer medicine: targeting the tumor stroma». Onco Targets Ther. 7: 33–43. PMC 3872146
 . PMID 24379681. doi:10.2147/OTT.S38111
. PMID 24379681. doi:10.2147/OTT.S38111 - Heinemann V, Reni M, Ychou M, Richel DJ, Macarulla T, Ducreux M (Fevereiro de 2014). «Tumour-stroma interactions in pancreatic ductal adenocarcinoma: rationale and current evidence for new therapeutic strategies». Cancer Treat. Rev. 40 (1): 118–28. PMID 23849556. doi:10.1016/j.ctrv.2013.04.004
- Fong Y, Ady J, Heffner J, Klein E. «Oncolytic viral therapy for pancreatic cancer: current research and future directions». Oncolytic Virotherapy: 35. doi:10.2147/OV.S53858
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.