From Wikipedia, the free encyclopedia
I kjemi er HOMO og LUMO typer molekylære orbitaler. Forkortelsene står for henholdsvis høyest okkupert molekylær orbital og lavest ubebodd molekylær orbital.


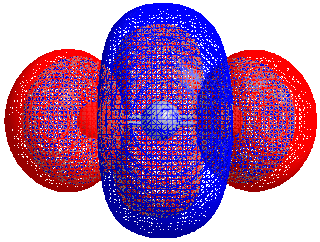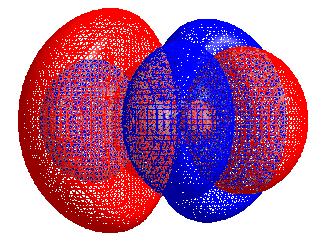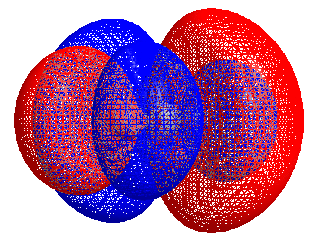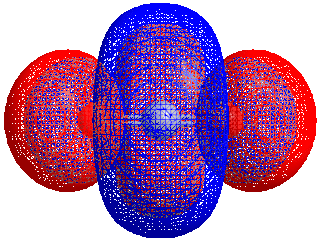
Energiforskjellen mellom HOMO og LUMO kalles HOMO–LUMO gap. HOMO og LUMO kalles noen ganger kollektivt grenseorbitaler, slik som i teorien om molekylær orbital. Forskjellen i energi mellom disse to grenseorbitalene kan brukes til å forutsi styrken og stabiliteten til innskuddsmetallkomplekser, så vel som fargene de produserer i løsning.[1]
HOMO-nivået til organiske halvledere er omtrent det maksimale valensbåndet til uorganiske halvledere og kvantepunkter. Den samme analogien kan gjøres mellom LUMO-nivået og ledningsbåndets minimum.[2]
I organometallisk kjemi kan størrelsen på LUMO-lappen bidra til å forutsi hvor tillegg til pi-ligander vil forekomme.
En SOMO er en enkelt okkupert molekylær bane, for eksempel halvfylt HOMO av en radikal.[3] Denne forkortelsen kan også utvides til semi okkupert molekylær bane.
Hvis det eksisterer, er det også funnet at molekylære orbitaler på ett energinivå under HOMO og ett energinivå over LUMO spiller en rolle i teorien om molekylær orbital. De blir kalt NHOMO for det nest høyeste okkuperte molekylære orbitalet og SLUMO for det nest laveste ubebodde molekylære orbitalet.[4] Disse blir ofte referert til som henholdsvis HOMO-1 og LUMO + 1.[trenger referanse]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.