Top Qs
Tijdlijn
Chat
Perspectief
Kwarts
kristallijn mineraal op basis van silica, een van de polymorfen van silica Van Wikipedia, de vrije encyclopedie
Remove ads
Kwarts is een polymorfe vorm van siliciumdioxide SiO2. Het vormt meer dan 12% van het volume van de aardkorst en is daarmee een van de meest voorkomende mineralen in de aardkorst. Zand en graniet bestaan hoofdzakelijk uit kwarts.

Remove ads
Geschiedenis
De kristallen zijn reeds bekend vanuit de klassieke oudheid. De naam kwarts komt van het Duitse Quarz, van Slavische oorsprong, wat 'hard' betekent. De Romeinen dachten dat kwarts permanent gestold water was, dus ijs.
Vorming
Samenvatten
Perspectief
Kwarts ontstaat bij het afkoelen van een gesmolten massa silicaat, maar ook het afkoelen van een hete oplossing van orthokiezelzuur kan tot kwarts leiden. Het afkoelen moet langzaam verlopen. Dan ontstaan grote kristallen. Omdat het kristalliseren vrij traag gaat, ontstaat bij snelle afkoeling van gesmolten silica vaak de amorfe vorm van kwarts, dit wordt kwartsglas genoemd.
Kwarts kan zowel heel grote kristallen vormen als microscopisch kleine. De grootst bekende kwartskristallen komen voor in Farm Verloren in Namibië. Deze kristallen zijn tot 20 meter groot, mogelijk 50 meter. Deze grootste kristallen ontstaan door de invloed van heet water op gesteenten. Hierbij lost SiO2-houdend gesteente op in de vorm van orthokiezelzuur. Bij afkoeling van de oplossing slaat het zuur neer in holtes of geoden en scheuren.
Kwarts komt veel voor in de aardkorst en is een belangrijk mineraal in stollingsgesteenten, zoals graniet. Kwarts is chemisch vrij inert. Onder atmosferische omstandigheden lost het slecht op in water. De oplosbaarheid in water is bij 25 °C tussen de 6 en 11 mg/l. Dit betekent dat bij verwering van kwartshoudende gesteenten kwarts nauwelijks oplost. Hierdoor zijn de verweerde vormen van kwarts, zoals zand en zandsteen, de meest voorkomende vormen.
Remove ads
Eigenschappen
Samenvatten
Perspectief
Structuur
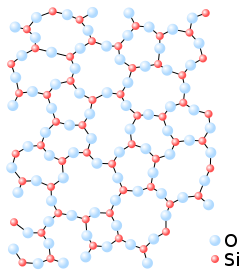
Kwarts heeft de molecuulformule SiO2 en is een van de polymorfe vormen van silica. De bindingen tussen de atomen silicium Si en zuurstof O zijn polair covalent van aard.
Een molecuul dat uit silicium- en zuurstofatomen is opgebouwd heeft normaal een tetraëdrische moleculaire geometrie. Ieder siliciumatoom is hierin met vier zuurstofatomen verbonden en ieder zuurstofatoom met één siliciumatoom. Deze losse moleculen hebben de molecuulformule SiO4, maar die komen los alleen in de gasfase voor, bij een temperatuur boven de 2230 °C. Een vast kwartskristal bestaat daarom ook niet uit losse moleculen. Het is geen moleculaire stof maar een zogenoemd covalent netwerk dat is opgebouwd uit SiO2-moleculen, die zijn gerangschikt. Voor kristallijne vormen van silica is dit in een bepaald regelmatig continu patroon, het kristalrooster. De rangschikking is voor amorfe vormen willekeurig.[1]
Elk siliciumatoom is weer met vier zuurstofatomen verbonden, maar elk zuurstofatoom is nu aan twee siliciumatomen verbonden. Ieder siliciumatoom Si 'deelt' dus vier keer een half zuurstofatoom, oftewel twee zuurstofatomen O2. Op deze manier ontstaat een driedimensionaal netwerk van regelmatige viervlakken van SiO4, waarbij elk zuurstofatoom is gedeeld tussen twee viervlakken.[1] Vanwege het driedimensionale netwerk wordt kwarts tot de tectosilicaten gerekend.
Kwarts-polymorfie
Kristallijn kwarts heeft twee fasen, waarbij de configuratie van de silica-viervlakken verschillend is. Dit verschil in oriëntatie van de atomen geeft de twee fasen een verschillend kristalrooster:
- α-kwarts heeft een trigonaal kristalstelsel
- β-kwarts, gevormd bij een hoge temperatuur, heeft een hexagonaal kristalstelsel.
Daarnaast bestaat er een amorfe vorm van kwarts, het kwartsglas.
Polymorfen zijn vaste materialen uit dezelfde samengestelde stof, die in verschillende kristalstructuren bestaan.[2] Zo komt siliciumdioxide behalve de twee polymorfe vormen van kwarts, α- en β-kwarts, nog in veel andere kristalstructuren voor, zoals:
- α- en β-cristobaliet
- tridymiet
- coesiet
- lechatelieriet
- Polymorfie in kwarts
- Eenheidscel van α-kwarts.
- Eenheidscel van β-kwarts.
- Kristallijne SiO2-structuur in een regelmatig gerangschikt kristalrooster. Het vierde zuurstofatoom ligt steeds boven het siliciumatoom.
- Amorfe SiO2-structuur in een willekeurige rangschikking zonder kristalrooster.
Kwartsvariëteit
Behalve de twee verschillende polymorfen van kwarts met elk hun eigen kristalstructuur is er ook onderscheid te maken tussen de verschillende kwartsvariëteiten. Deze verschillen in kleur, onzuiverheden of habitus. Natuurlijk zijn ze allemaal hoofdzakelijk opgebouwd uit het amorfe kwartsglas of het kristallijne α- of β-kwarts, anders zouden het geen kwartsen[3] zijn.
Onzuiverheden
Zuiver kwarts komt in bergkristal voor. Echter, onzuiverheden van andere elementen dan silicium en zuurstof komen van nature vaak voor in kwarts. Tijdens de groei van het kristal worden deze elementen (ionen) in het kristalrooster opgenomen. In de tabel hiernaast staan de meest voorkomende elementen vermeld met de concentratie onder- en bovengrens in ppm (parts per million).
Het aluminium en ijzer zijn verantwoordelijk voor de kleur van een aantal kwartsvariëteiten. Vooral in combinatie met ioniserende straling treedt er een kleureffect op. Kwartskristallen kunnen over andere mineralen heen groeien zoals bij rutielkwarts het geval is.
Remove ads
Industriële toepassing
Kwartsglas
Kwartsglas is een amorfe (niet-kristallijne) vorm van kwarts. Het blazen van kwartsglas is moeilijker dan "echt" glas, doordat het verwekingspunt veel hoger ligt en veel abrupter start. Het vereist goede ventilatie, omdat er gasvormig SiO2 bij ontstaat; dit kan de longen aantasten.
Kwartsglas wordt veel toegepast vanwege de bruikbare materiaaleigenschappen als:
- Het is sterk, zet weinig uit en kan dus grote temperatuurverschillen doorstaan.
- Het is chemisch vrij inert en het verwekingspunt ligt hoog (1665 °C). De sterke covalente bindingen tussen de atomen zorgen hiervoor.
- Het is transparant voor ultraviolette straling, in tegenstelling tot de meeste andere vormen van glas. Het wordt daarom toegepast als cuvetmateriaal in de spectroscopie van het ultraviolette deel van het spectrum.
Kristallijn kwarts
Kristallijn kwarts is de bron van silicium voor de halfgeleiderindustrie en de siliciumchemie. Daarnaast is kwarts een piëzo-elektrisch materiaal. De trillingen die men in het kristal kan opwekken worden gebruikt in elektronische apparatuur zoals kristaloscillator in kwartsuurwerken en radio's.
Remove ads
Kwartsvariëteiten
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads