Loading AI tools
chemische verbinding Van Wikipedia, de vrije encyclopedie
Antimoon(III)fluoride is een anorganische verbinding met de formule . De verbinding wordt soms ook aangeduid met de naam Swarts' reagens. Deze stof is een van de twee voornaamste fluorides van antimoon, de andere is antimoon(V)fluoride, . In zuivere vormt de verbinding witte kristallen, die vaak door verontreiniging meer of minder grijs zijn.
| Antimoon(III)fluoride | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
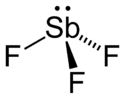 | |||||
Structuurformule van | |||||
 | |||||
Ruimtelijk model van | |||||
| Algemeen | |||||
| Molecuulformule | |||||
| IUPAC-naam | Antimoon(III)fluoride | ||||
| Andere namen | Trifluorstibaan, Trifluoroantimoon | ||||
| Molmassa | 178,76 g/mol | ||||
| SMILES | F[Sb](F)F | ||||
| InChI | 1S/3FH.Sb/h3*1H;/q;;;+3/p-3 | ||||
| CAS-nummer | 7783-56-4 | ||||
| EG-nummer | 232-009-2 | ||||
| PubChem | 24554 | ||||
| Wikidata | Q419591 | ||||
| Beschrijving | Lichtgrijze tot witte kristallen | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H301 - H311 - H331 - H314 - H411 | ||||
| P-zinnen | P260 - P273 - P280 - P303+P361+P353 - P304+P340+P310 - P305+P351+P338 | ||||
| VN-nummer | UN 2923 | ||||
| Fysische eigenschappen | |||||
| Dichtheid | 4,379 g/cm³ | ||||
| Smeltpunt | 292 °C | ||||
| Kookpunt | 376 °C | ||||
| Oplosbaarheid in water | Hydrolyseert ook langzaam (0 °C) 3850 g/L (20 °C) 4430 g/L (30 °C) 5620 g/L | ||||
| Goed oplosbaar in | Methanol, Aceton | ||||
| Onoplosbaar in | Ammonia | ||||
| Thermodynamische eigenschappen | |||||
| ΔfH |
−915,5 kJ/mol | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
wordt gemaakt door antimoon(III)oxide met waterstoffluoride te laten reageren.[2]
In vast hebben de antimooncentra een octaedrische omringing van fluoratomen. De antimoonatomen zijn bovendien via fluorbruggen aan elkaar gekoppeld, waardoor een polymere structuur ontstaat. Deze polymere structuur is ook de oorzaak van de in vergelijking met verwante verbindingen als en lage vluchtigheid.[3]
De verbinding is een zwak lewiszuur. In water treedt langzaam ontleding op. Met fluor wordt het pentafluoride gevormd.
Antimoon(III)fluoride kent zowel industriële[4] als laboratoriumtoepassingen. In het laboratorium is het een fluoriderend reagens in de organofluorchemie.[5] In 1882 publiceerde de Belgische chemicus Frédéric Swarts zijn werk aan het omzetten van organische chlorides in fluorides.[6] Centraal in de omzetting staat de verbinding antimoon(V)dichloridetrifluoride. Deze kan op twee manieren verkregen worden:
Voor deze component is ook een technische synthesemethode bekend.[7] De swartsreactie wordt algemeen toegepast in de synthese van organofluorverbindingen, al wordt er momenteel ook gekeken naar silanen als flouriderend reagens.[8] Voor het verbod op de freonen werd de reactie gebruikt om freon te maken.
wordt toegepast bij het kleuren van aardewerk en glas.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.