хемиско соединение From Wikipedia, the free encyclopedia
Селен тетрахлорид е неорганско соединение составено со формулата SeCl 4 . Ова соединение постои како жолто до бело испарливо цврсто тело. Тој е еден од двата вообичаено достапни селен хлориди, другиот пример е селен монохлорид, Se 2 Cl 2 . SeCl 4 се користи во синтезата на други соединенија на селен .
 | |
 | |
Назив според МСЧПХ Селен тетрахлорид | |
Други називи Селен(IV) хлорид, тетрахлоро-λ4-селан | |
| Назнаки | |
|---|---|
| 10026-03-6 | |
| ChemSpider | 59590 |
| EC-број | 233-053-5 |
| 3Д-модел (Jmol) | Слика |
| PubChem | 66205 |
| RTECS-бр. | VS7875000 |
| |
| UNII | 4GB8868P5J |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | бели до жолти кристали |
| Густина | 2.6 g/cm3, солидна |
| Точка на топење | |
| се распаѓа во вода | |
| Структура | |
| Кристална структура | Monoclinic, mS80 |
Просторна група |
C12/c1, No. 15 |
| Геометрија на молекулата | Seesaw (gas phase)[се бара извор] |
| Опасност | |
| GHS-ознаки: | |
Пиктограми |
   |
Сигнални зборови |
Опасност |
Изјави за опасност |
H301, H331, H373, H410 |
Изјави за претпазливост |
P260, P261, P264, P270, P271, P273, P301+P310, P304+P340, P311, P314, P321, P330, P391, P403+P233, P405, P501 |
| NFPA 704 | |
| Температура на запалување | non-flammable |
| Слични супстанци | |
| Други анјони | Selenium tetrafluoride Selenium tetrabromide Selenium dioxide |
| Други катјони | Dichlorine monoxide Sulfur tetrachloride Tellurium tetrachloride |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Соединението се подготвува со третирање на селен со хлор .[1] Кога селенот што реагира се загрева, производот се сублимира од реакционата колба. Нестабилноста на селен тетрахлорид може да се искористи за прочистување на селенот.
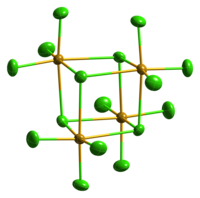
Цврстата SeCl 4 е всушност кластер од тетрамерен кубански тип, за кој атомот Se на октаедарот SeCl 6 се наоѓа на четири агли на коцката, а премостувачките Cl атоми се сместени на другите четири агли. Премостувачките растојанија Se-Cl се подолги од терминалните растојанија Se-Cl, но сите агли на Cl-Se-Cl се приближно 90°.[2]
SeCl 4 често се користи како пример за учење на правилата на VSEPR за хипервалентни молекули . Како таква, би можеле да се предвидат четири врски, но пет електронски групи што доведуваат до геометрија на клацкалка . Ова очигледно не е случај во кристалната структура . Други сугерираат дека кристалната структура може да се претстави како SeCl 3 + и Cl - . Оваа формулација би предвидела пирамидална геометрија за SeCl 3 + катјонот со агол на врската Cl-Se-Cl од приближно 109 °. Сепак, оваа молекула е одличен пример за ситуација кога максималното поврзување не може да се постигне со наједноставната молекуларна формула. Формирањето на тетрамерот (SeCl 4 ) 4,[3] со делокализирана сигма врска на премостувачкиот хлорид е јасно претпочитана во однос на „хипервалентна“ мала молекула. Гасниот SeCl 4 содржи SeCl 2 и хлор, кои се рекомбинираат при кондензација.
Селен тетрахлорид може да се редуцира на самото место до дихлорид користејќи трифенилстибин :
Селен тетрахлорид реагира со вода и дава селен и хлороводородна киселина :[4]
По третманот со селен диоксид, тој дава селен оксихлорид :[4]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.