Во хемијата, хибридизацијата е концепт на мешање на атомските орбитали при што се образуваат нови, хибридни орбитали, погодни за квалитативно опишување на атомските сврзувачки својства. Хибридизираните орбитали се многу корисни при објаснувањето на обликот на молекулските орбитали на молекулите. Хибридизацијата е составен дел на Теоријата за валентно сврзување и VSEPR теоријата


Историски развој
Хибридизационата теорија беше промовирана од хемичарот Лајнус Полинг за да се објасни структурата на молекулите, како оние на метанот (CH4). Историски, овој концепт бил развиен за такви, прости хемиски системи, но подоцна пристапот се употребувал (и сè уште се употребува) пошироко. Денес тој е делотворен при рационализирањето на органските соединенија.
Како и да е, хибридизационата теорија е сметана за помалку корисна и помалку информативна од Теоријата на молекулски орбитали. Проблемите со хибридизацијата се особено забележливи кога d орбиталите се вмешани во сврзувањето, како во координативната хемија и органометалската хемија. Иако шемите за хибридизација можат да се користат во хемијата на транзитивните метали, тие не се прецизни и имаат мала предвидувачка моќ.
Важно е да се забележи дека орбиталите се модел-репрезентација на однесувањето на електроните во молекулите. Во случајот на простата хибридизација, оваа апроксимација е заснована на атомските орбитали на водородот. Хибридизираните орбитали се претпоставува дека се мешавини на овие атомски орбитали, преклопени меѓусебно во најразлични пропорции. Водородните орбитали се користат како основа за едноставни хибридизациони шеми бидејќи се едни од неколкуте примери на орбитали за кои е познато аналитичкото решение на Шредингеровата равенка. Овие орбитали се сметаат за малку, но не значајно изобличени во потешките атоми, како јаглеродот, азотот и кислородот. Под овие претпоставки, теоријата за хибридизација е најприфатлива. Хибридизациониот концепт се применува кај молекулите составени од јаглерод, азот и кислород (во помала мерка и кај сулфурот и фосфорот).
Хибридизационата теорија најмногу се употребува во органската хемија.
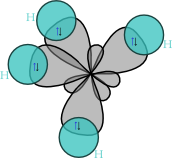
sp3 (тетраедарски) хибриди
Овие хибриди настануваат со мешање (хибридизација) на 2s орбиталата и трите 2p орбитали. Бидејќи орбиталите се всушност електронски облаци, тие меѓу себе се одбиваат. Четирите хибридни орбитали, подеднакво и максимално ќе се оддалечат една од друга доколку се распоредат кон ќошињата на тетраедар. Значи, геометрискиот распоред на sp3 орбиталите во просторот е тетраедарски, па затоа и оваа хибридизација се нарекува тетраедарска. Аголот меѓу тетраедарските орбитали е ист како и оној на аглите во тетраедарот и изнесува 109o28'. Пример за соединенија со sp3 хибридизирани (јаглеродни) атоми се алканите. Кај најпростиот алкан, метан (CH4), ситуацијата е следна: јаглеродот има електронска конфигурација 1s² 2s² 2px¹ 2py¹, или графички:
(Забележите: 1s орбиталата е на пониско енергетско ниво отколку 2s орбиталата, додека 2s орбиталата е на пониско енергетско ниво отколку 2p орбиталите).
При образувањето на молекула од метанот, едниот јаглероден атом кој тој го содржи ја добива конфигурацијата:
Во секоја од новодобиените (хибридни) орбитали има по еден неспарен електрон, што значи дека тие можат да градат четири единечни сигма-врски како со други јаглеродни атоми, така и со атоми од други елементи.
sp2 хибриди
Структурата на други слични соединенија може да се објасни на сличен начин како онаа на метанот. На пример, етенот (C2H4) има двојна врска помеѓу два јаглеродни атоми. Кекулеовската структура на ова соединение (кое инаку спаѓа во алкените) изгледа вака:

Јаглеродните атоми ќе подлегнат на sp2 хибридизација, бидејќи хибридните орбитали ќе формираат само σ-врски, а една пи-врска е потребна за двојната врска помеѓу С-атомите. Водород-јаглерод врските се со еднаква силина и должина, што е потврдено со експериментални податоци.
При sp2 хибридизацијата, една 2s орбитала се меша само со две од трите можни 2p орбитали:
формирајќи вкупно 3 sp2 орбитали, при што останува една нехибридизирана р-орбитала. Кај етиленот, двата С-атоми формираат σ-врска со препокривање на две sp2 орбитали, при што секој С-атом формира две ковалентни врски со Н-атомите преку препокривање на s и sp2 орбиталите. Пи врската помеѓу јаглеродните атоми нормално со молекулската рамнина се формира со препокривање на 2pи 2p орбиталите (сепак, пи-врската не мора да се создаде).
sp-хибриди
Хемиското врзување кај соединенијата како алкините, каде има тројни врски, се објаснува со sp хибридизацијата:
При овој модел, 2s орбиталата се меша само со една од трите р-орбитали, што резултира во добивање на две sp орбитали и две нехибридизирани р орбитали. Хемиското поврзување во ацетиленот (или етинот, C2H2) се состои од 'sp–sp препокривање помеѓу двата С-атоми, формирајќи σ-врска и две додатни пи-врски, образувани со p–p препокривање. Исто така, секој С-атом се врзува за Н-атом преку сигма 's–sp препокривање.
Надворешни врски
- Ковалентната врска и молекуларната структура Архивирано на 10 февруари 2009 г. (англиски)
- Флеш-филм за хибридизацијата (англиски)
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.