Карбонилна група
From Wikipedia, the free encyclopedia
Карбонилна група — функционална група со формулата C=O, сочинета од јаглероден атом двојно врзани за кислородниот атом, и е двовалентен во C-атомот. It is common to неколку класи на органски соединенија (како алдехиди, кетони и карбоксилни киселини), како дел од многу поголеми функционални групи. Соединението кое содржи карбонилна група често се нарекува карбонилно соединение.[1]
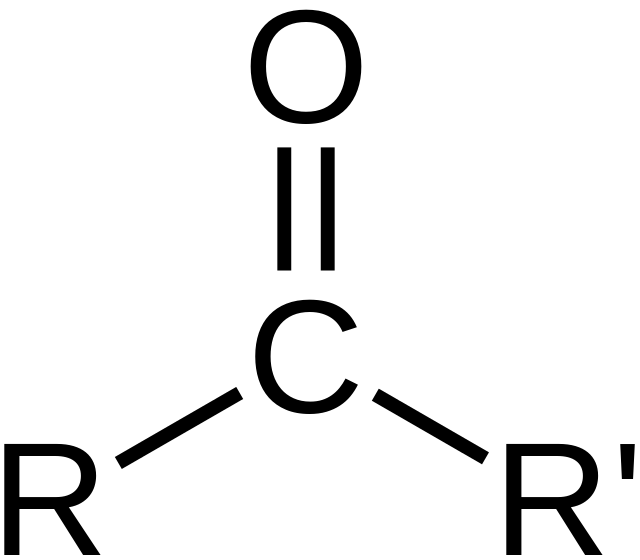
Поимот карбонил може да се однесува и на јаглерод моноксид како лиганд во неогански или органометален компекс (метален карбонил, како на пр. никел карбонил).
Остатокот од оваа статија го обработува карбонилот во органска смисла, каде јаглеродот и кислородот делат двојна врска.
Карбонилни соединенија
Во органската хемија, карбонилната група е својствена за следниве видови соединенија:
| Соединение | Алдехид | Кетон | Карбоксилна киселина | Карбоксилатен естер | Амид |
| Структура |  |  |  | ||
| Општа формула | RCHO | RCOR' | RCOOH | RCOOR' | RCONR'R'' |
| Соединение | Енон | Ацил халид | Анхидрид | Имид |
| Структура |  |  |  | |
| Општа формула | RC(O)C(R')CR''R''' | RCOX | (RCO)2O | RC(O)N(R')C(O)R'' |
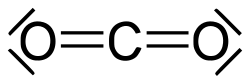
Други органски карбонили се уреата и карбаматите, деривати на ацил хлориди, хлороформати и фозген, карбонатни естри, тиоестри, лактони, лактами, хидроксамати и изоцијанати. Примери за неоргански карбонилни соединенија се јаглерод диоксидот и карбонил сулфидот.
Посебна група на карбонилни соединенија се дикарбонилните, кои имаат посебни својства.
Структура и реактивност
Кај органските соединенија, должината на врската C-O не отстапува многу од 120 пикометри. Нроганските карбонили имаат покуси C-O-растојанија: CO, 113; CO2, 116; а COCl2, 116 пм.[2]
Карбонилниот јаглерод типично е електрофилен. Квалитативниот редослед елелтрофилност е RCHO (алдехиди) > R2CO (кетони) > RCO2R' (естри) > RCONH2 (амиди). Напаѓаат различни нуклеофили, раскинувајќи ја двојната врска јаглерод-кислород.
Заемодејствата пмеѓу карбонилните групи и другите заменители се утврдени при проучување на колагенот.[3] Заменителите влијаат на карбонилните групи со додавање или одземање на електронска густина по пат на сигма-врска.[4] ΔHσ-вредностите се многу повисоки кога заменителите на карбонилната група се повеќе електронегативни од јаглеродот.[4]

Поларноста на врската C=O исто така ја зајакнува киселоста на соседните врски C-H. Поради позитивниот набој на јаглеродот и негативниот набој на кислородот, карбонилните групи подлежат на додавање и/или нуклеофилни напади. Напаѓаат најразлични нуклеофили, прекинувајќи ја јаглеродно-кислородната двојна врска, што води до реакции на додавање-елеминација. Нуклеофилната реактивност често е сразмерна на базноста на нуклеофилот; со зголемувањето на нуклеофилноста се намалува стабилноста во карбонилното соединение.[5] pKa-вредностите на ацеталдехидот и ацетонот изнесуваат 16,7 и 19.[6]
Спектроскопија
- Инфрацрвена спектроскопија: двојна врска C=O впива инфрацрвена светлина при бранови броеви помеѓу ~1600 и 1900 см−1(5263 до 6250 нм). Точното место на впивање е прилично добро познато во однос на геометријата на молекулата. Ова впивање е познато како „карбонилно растегање“ кога се прикажува на инфрацрвениот впивен спектар.[7] Покрај тоа, ултравиолетово-видливите спектри на пропанонот во вода овозможуваат впивање на карбонил на 257 нм.[8]
- Јадрена магнетна резонанција (ЈМР): двојата врска C=O има различни резонанции зависно од околните атоми, начелно ниско во полето. ЈМР со 13C на карбонилен јаглерод е во опег од 160 до 220 милионитини.
Поврзано
- Органска хемија
- Функционална група
- Метален карбонил
- Електрофилна адиција
Наводи
Надворешни врски
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
