Дишенова мускулна дистрофија
From Wikipedia, the free encyclopedia
Дишенова мускулна дистрофија (ДМД) (Muscular Dystrophy Duchene) е тежок вид мускулна дистрофија.[1] Симптомот на слабост на мускулите обично започнува околу четиригодишна возраст кај момчиња и брзо се влошува.[2] ДМД е невромускуларна болест која се одликува со брза прогресија на слабеење на мускулите и дегенрација на скелетни и срцеви мускули. Примарно се појавува кај машката популација со инциденца 1 на 33000 родени машки деца. Женските деца се најчесто асимптоматични, но кај мал процент од женските носители може да се манифестираат слаби форми на болеста.[3] Обично губење на мускулите се јавува прво во бутовите и карлицата проследено со оние на рацете. Ова може да резултира во проблеми со станување. Повеќето не се во можност да одат по 12-годишна возраст. Погодените мускули може да изгледаат поголеми заради зголемената содржина на маснотии . Сколиозата е исто така честа појава. Некои може да имаат интелектуална попреченост . Женската популација со единечна копија на неисправниот ген може да покажат благи симптоми.

Околу две третини од случаите се наследуваат од мајка на едно лице, додека една третина од случаите се должат на нова мутација. Таа е предизвикана од мутација во генот за белковинскиот дистрофин . Дистрофинот е важен за одржување на клеточната мембрана на мускулните влакна. Генетското тестирање често може да ја направи дијагнозата уште при раѓање. Оние кои се погодени, исто така, имаат високо ниво на креатин киназа во крвта .
Иако не постои познат лек, физикална терапија, загради и корективна хирургија може да помогне кај некои симптоми. Може да биде потребна помошна вентилација кај оние со слабост на мускулите на дишење.[1] Користените лекови вклучуваат стероиди за да се забави дегенерацијата на мускулите, антиконвулзиви за контрола на напади и некои активности на мускулите и имуносупресиви за да се одложи оштетување на умираните мускулни клетки.[2]
ДМД влијае на околу еден од 5.000 мажи при раѓање.[1] Тоа е најчестиот вид на мускулна дистрофија. Просечниот животен век е 26 години,[4] меѓутоа, со одлична грижа, некои може да живеат во своите 30-ти или 40-ти. Генетската терапија, како третман, е во раните фази на студии кај луѓето.
Знаци и симптоми
Главниот симптом на ДМД, прогресивно невромускулно нарушување, е мускулна слабост поврзана со губење на мускулите со доброволните мускули. Најпрво биле погодени , особено на колковите, карлицата, бутовите и рамената. Мускулна слабост се јавува и подоцна, во рацете, вратот и во други области. Симптомите обично се појавуваат пред шестгодишна возраст и може да се појават во раната детска возраст. Најчесто болеста се појавува во рано детство, и децата може да покажат одложен развој на моторни функции или глобално застој во развојот. Децата со ДМД генерално никогаш не успеваат да трчаат или да скокаат. Состојбата напредува брзо и кај детето се развива тетераво одење и позитивен Гауер знак (Кога детето се исправа користејќи ги своите раце, заради слабост на долна мускулатура). Искачувањето на скали постанува тешко и детето почнува често да паѓа. Загуба на независна ампулација настанува помеѓу 6 и 13 години, во просек на 9,5 години кај пациенти кои не примале стероиди. Откако настанува загубата, се случуваат контрактури на зглобови и брз развој на сколиоза. Кардиомиопатија и респираторна инсуфициенција се причина за смрт на млади години.[5]
Причина
ДМД е предизвикана од мутација на генот дистрофин кај локусот Xp21, сместена на кратката рака на Х-хромозомот. Дистрофинот е одговорен за поврзување на цитоскетот на секое мускулно влакно со основната базална ламина ( вонклеточна матрица ), преку белковински комплекс кој содржи многу подединици. Отсуството на дистрофин дозволува вишок калциум да навлезе во сарколемата (клеточната мембрана).[6] Промените во калциумските и сигналните патишта предизвикуваат вода да навлегува во митохондриите, кои потоа пукнале.
Кај дистрофијата на скелетните мускули, митохондриската дисфункција предизвикува засилување на цитозолните сигнали на калциум предизвикани од стрес и засилување на производството на реактивни кислород предизвикани од стрес. Во сложениот процес на каскадување што вклучува неколку патеки и не е јасно разбран, зголемениот оксидативен стрес во клетката ја оштетува сарколемата и на крајот резултира со смрт на клетката. Мускулните влакна се подложуваат на некроза и на крајот се заменуваат со масно и сврзно ткиво.
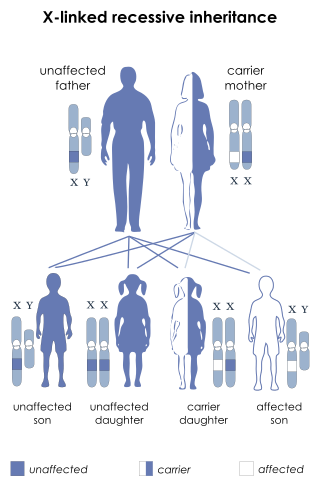
ДМД се наследува во Х-рецесивна шема . Женските единки обично се носители на генетската одлика, додека машките се засегнати. Жената преносник нема да биде свесна дека носи мутација сè додека не го погоди синот. Синот на мајка-преносничка има 50% шанса да го наследи неисправниот ген од неговата мајка. Ќерката на мајка-превозничка има 50% шанси да биде носител и 50% шанса да има две нормални копии на генот. Во сите случаи, несаканиот татко или му пренесува нормален Y на неговиот син или нормален Х на неговата ќерка. Женските носители на рецесивна состојба поврзана со Х, како што е ДМД, можат да покажат симптоми во зависност од нивната шема на Х-инактивација. Понуда ДМД има зачестеност на една кај 3.600 машки доенчиња. Мутациите во генот дистрофин можат да бидат наследни или да се појават спонтано за време на преносот на герминот.
ДМД е исклучително редок кај жени (околу 1 на 50,000,000 женски раѓања). Може да се појави кај жени кај заболен татко и мајка носител, кај оние на кои им недостасува Х- хромозом, или кај оние кои имаат онеспособен Х- хромозом (најчест од ретки причини).[7] Ќерката на мајка-превозникот и погодениот татко ќе бидат зафатени или преносник со еднаква веројатност, бидејќи таа секогаш ќе го наследи погодениот Х-хромозом од нејзиниот татко и има 50% шанса да го наследи и погодениот Х-хромозом од нејзината мајка .[8]
Нарушувањето на крвно-мозочната бариера се смета дека е забележана одлика во развојот на ДМД.[9]
Дијагноза
Генетско советување се советува за лица со семејна историја на нарушување. ДМД може да се открие со околу 95% точност со генетски студии спроведени за време на бременоста.
Тест за ДНК
Мускулната специфична мускулатура на генот дистрофин е составена од 79 егзони, а ДНК-тестирањето и анализата обично можат да го идентификуваат специфичниот вид мутација на егзонот или егзоните што се засегнати. Тестирањето со ДНК ја потврдува дијагнозата во повеќето случаи.[10]
Мускулна биопсија
Ако ДНК-тестот не успее да ја пронајде мутацијата, може да се изврши тест за биопсија на мускулите.[11] Мал примерок на мускулното ткиво се извлекува со помош на игла за биопсија. Клучните тестови извршени на примерокот за биопсија за ДМД се имуноцитохемија и имуноблотирање на дистрофин и треба да бидат толкувани од искусен невромускулен патолог.[12] Овие тестови даваат информации за присуството или отсуството на белковината. Отсуството на белковината е позитивен тест за ДМД. Онаму каде е присутен дистрофин, тестовите ја означуваат количината и молекуларната големина на дистрофинот, помагајќи да се направи разлика ДМД од поблага дистрофинопатија фенотипови.[13] Во текот на изминатите неколку години, развиени се ДНК-тестови кои откриваат повеќе од многуте мутации што ја предизвикуваат состојбата, а не е потребна биопсија на мускулите толку често за да се потврди присуството на ДМД.[14]
Пренатални тестови
ДМД го носи Х-поврзан рецесивен ген. Мажите имаат само еден Х-хромозом, така што една копија на мутираниот ген ќе предизвика ДМД. Татковците не можат да им пренесат својства на Х- поврзани, на нивните синови, па мутацијата ја пренесува мајката.[15]
Ако мајката е носителка, и затоа еден од нејзините два Х-хромозоми има мутација на ДМД, постои 50% шанса дека женско дете ќе ја наследи таа мутација како еден од нејзините два Х-хромозоми и ќе биде носител. Ако тој носител има машко дете, постои 50% шанса тој да го наследи Х-хромозомот со мутација, и ќе има ДМД. Пренаталните тестови можат да кажат дали нероденото дете има најчести мутации. Многу мутации се одговорни за ДМД, а некои не се идентификувани, па генетското тестирање работи само кога членовите на семејството со ДМД имаат идентификувана мутација.
Пред инвазивно тестирање, е важно да се утврди полот на фетусот, додека мажите понекогаш се засегнати од оваа болест поврзана со Х, женски ДМД е исклучително редок. Ова може да се постигне со ултразвучно скенирање на 16 недели или неодамна со бесплатно тестирање на ДНК на фетусот. Земањето мостри од хоризон вирус (CVS) може да се направи на 11-14 недела и има ризик од абортус од 1%. Амниоцентезата може да се направи по 15 недели, и има 0,5% ризик од спонтан абортус. Земање на примероци на крв од плод може да се направи околу 18 недели. Друга опција во случај на нејасни резултати генетски тест е феталниот мускулна биопсија.
Третман

Не е познат лек за ДМД и тековната медицинска потреба е призната од регулаторните органи.[16] За оваа болест е од суштинска важноста да има мултидисциплинарна нега. Физиотерапијата вклучува пасивно истегнување и за време на ноќта ортози за намалување на тендо-Ахиловите контрактури. Третман со кортикостероиди како преднизоне или дефлазакорт се златен стандард. Треба да се започне со нив на 5-7 годишна возраст. Компликациите од кортикостероидната терапија мора да се менаџираат соодветно: контрола на тежина, гастрична заштита, регуларна контрола и третман за остеопороза, и офталмична проценка за перде и глаукома. Редовна кардио контрола е потребна за да се овозможи рана терапија со АKЕ инхибитори. Операција може да е потребна за исправка на сколиоза и ноќен БИПАП (апарат за неинвазивна вентилација) е од бенефитр за третман на рестриктивна респираторна инсуфициенција.[17]
Третманот е генерално насочен кон контролирање на појавата на симптомите за да се зголеми квалитетот на животот што може да се мери со помош на специфични прашалници,[18] и да вклучува:
- Кортикостероидите како што се преднизолонот и дефлазакорт доведуваат до краткорочни подобрувања во јачината на мускулите и функционираат до 2 години.[19] Кортикостероидите исто така се пријавени да помогнат во продолжување на одењето, иако доказите за тоа не се стабилни.[20]
- Рандомизирани испитувања контрола покажаа дека β <sub id="mw7A">2</sub> агонисти се зголеми мускулната сила, но не ја менувате прогресија на болеста. Follow-up време за повеќето RCTs на β 2 агонисти е само околу 12 месеци, со тоа резултатите не можат да се екстраполираат надвор од таа рамка.
- Охрабрена е лесна физичка активност, како што е пливањето. Неактивноста (како што е одмор во кревет ) може да ја влоши мускулната болест.
- Физичката терапија е корисна за одржување на мускулната сила, флексибилноста и функцијата.
- Ортопедските уреди (како што се протези и инвалидски колички) можат да ја подобрат подвижноста и можноста за само-грижа. Отстранливи загради на нозете што можат да се обликуваат на форма кои го држат глуждот на место за време на спиењето може да го одложат почетокот на контракциите .
- Соодветна респираторна поддршка како што напредува болеста е важна.
- Срцеви проблеми може да бараат пејсмејкер .[21]
Лекот етпларисен е одобрен во Соединетите Држави за третман на мутации подложни на дистрофин егзон 51 што прескокнува. Одобрувањето во САД е контроверзно [22] бидејќи етпларисен не успеа да воспостави клиничка корист;[23] е одбиено одобрување од Европската агенција за лекови.[24]
Аталуренот на лекови е одобрен за одредени случаи во Европската унија.[25]
Сеопфатни мултидисциплинарни упатства за грижа за ДМД беа развиени од Центрите за контрола и превенција на болести и беа објавени во два дела во „Нантологијата Лансет“ во 2010 година.[11]
Физикална терапија
Физикалните терапевти се занимаваат со овозможување на пациентите да го достигнат максималниот физички потенцијал. Нивната цел е:
- минимизирајте го развојот на контрактури и деформитети преку развивање програма за истегнување и вежби каде што е соодветно
- предвидување и минимизирање на други секундарни компликации од физичка природа со препорачување на заграда и трајна медицинска опрема
- следете ја респираторната функција и советувајте за техники кои помагаат при вежби за дишење и методи за расчистување на секретите
Помош за респирација

Современите „ вентилатори / респиратори на волумен“, кои му доставуваат прилагодлив волумен (количина) на воздух на лицето со секој здив, се вредни за третман на лица со респираторни проблеми поврзани со мускулна дистрофија. Вентилаторот може да бара инвазивна ендотрахеална или трахеотомија цевка преку која директно се испорачува воздухот, но за некои луѓе, неинвазивно породување преку маска за лице или уста за лице е доволно. Позитивните машини за притисок на дишните патишта, особено оние со жолчката, понекогаш се користат на овој втор начин. Респираторната опрема лесно може да се смести на фиоката за вентилатор на дното или задниот дел од инвалидска количка со надворешна батерија за преносливост.
Третманот на вентилаторот може да започне во средината на доцните тинејџери кога респираторните мускули можат да почнат да пропаѓаат. Ако виталниот капацитет се спушти под 40% од нормалното, може да се користи вентилатор / респиратор за волумен во текот на спиењето, време кога лицето најверојатно ќе биде поттикнувачко (хиповешто). Хиповентилацијата за време на спиењето се утврдува со темелна историја на нарушување на спиењето со студија на оксиметрија и капиларен крвен гас (види тестирање на белодробна функција ).
Уред за помагање на кашлица може да помогне при вишок слуз во белите дробови со хиперинфлација на белите дробови со позитивен притисок на воздухот, потоа негативен притисок за да се подигне слузта. Ако виталниот капацитет продолжува да се спушта на помалку од 30 проценти од нормалното, може да биде потребен и вентилатор / респиратор за волумен за поголема помош. Лицето постепено ќе ја зголемува количината на време користејќи вентилатор / респиратор во текот на денот по потреба. Сепак, во своите 20-тина години има и луѓе со заболување кои немаат потреба од вентилатор.
Прогноза
Дишенова мускулна дистрофија е ретка прогресивна болест која на крајот влијае на сите доброволни мускули и ги вклучува мускулите на срцето и дишењето во подоцнежните фази. Очекуваниот животен век се проценува на околу 25-26,[4] но тоа варира. Со одлична медицинска нега, мажите често живеат во своите 30-ти години.[26]
Најчеста директна причина за смрт кај лица со ДМД е респираторна слабост . Компликациите од третманот, како што се механичката вентилација и процедурите на трахеотомија, се исто така загриженост. Следната водечка причина за смрт е состојбата поврзана со срцето, како што е срцевата слабост, предизвикана од проширената кардиомиопатија . Со респираторна помош, средната старост на преживување може да достигне до 40. Во ретки случаи, се смета дека луѓето со ДМД преживуваат во своите четириесетти години или раните педесетти години, со соодветно позиционирање во инвалидски колички и кревети и употреба на поддршка за вентилатор (преку трахеостомија или уста), дозвола за дишење на патиштата и лекови за срце.[27] Раното планирање на потребните поддржувачи за подоцнежна нега, покажа поголема долговечност кај лицата со ДМД.[28]
Недостатокот на дистрофин е поврзан со зголемено ниво на калциум и мионекроза на скелетните мускули. Внатрешните ларингеални мускули (ИЛМ) се заштитени и не подлежат на мионекроза.[29] ИЛМ имаат профил на систем за регулирање на калциум кој укажува на подобра способност за справување со промените на калциумот во споредба со другите мускули, а тоа може да обезбеди механистички увид за нивните уникатни патофизиолошки својства.[30] ИЛМ може да го олесни развојот на нови стратегии за превенција и третман на губење на мускулите во различни клинички сценарија.[31]
Епидемиологија
ДМД е најчестиот вид на мускулна дистрофија; тоа влијае на околу еден од 5.000 мажи при раѓање.[1]
Во САД, една студија од 2010 година покажа поголема количина на оние со возраст ДМБ кои се движат од пет до педесет и четири кои се шпанци во споредба со белци нехиспанското и нехиспанското црнците.[32]
Историја

Болеста за првпат ја опишал неаполскиот лекар Џовани Семола во 1834 година и Гаетано Конте во 1836 година.[33][34][35] Како и да е, ДМД го носи името на францускиот невролог Гијом Бенџамин Аманд Душен (1806-1875), кој во изданието од 1861 година на својата книга „ Параплеги хипертрофик де ла'енфанс де каурерал“, го опиша и детализира случајот на едно момче кое го имаше ова состојба. Една година подоцна, тој презентираше фотографии од својот пациент во патологиите на албумот за фотографии . Во 1868 година, тој дал извештај за 13 други погодени деца. Духен беше првиот што направи биопсија за да добие ткиво од жив пациент за микроскопски преглед.[36]
Забележителни случаи
Алфредо („Дино“, „Алфредино“) Ферари (роден во јануари 1932 година во Модена ), син на Енцо Ферари, го дизајнирал моторот 1,5 Л DOHC V6 за моделот Ф2 на крајот на 1955 година. Но, Дино никогаш не го видел произведен моторот. Починал на 30 јуни 1956 година во Модена на 24-годишна возраст, пред да се направат неговите имиња Дино и Фиат Дино .
Раперот Дариус Веемс имал болест и го користел своето озлогласеност за да ја подигне свеста и средствата за лекување.[37] Почина на 27-годишна возраст (неговиот брат, исто така, страдал од оваа болест, до неговата смрт на 19-годишна возраст). Филмот Дариус оди на Запад го документира патувањето на Веем во растот и прифаќањето на заболување.
Романот на Џонатан Евисон, „Ревидираните основи на грижата“, објавен во 2012 година, прикажа еден млад човек, заболен од оваа болест. Во 2016 година, Нетфликс го објави Основи на грижата, филм заснован на романот.
Истражување
Тековните истражувања вклучуваат егзон-прескокнување, терапија за замена на матични клетки, аналогни дополнувања, замена на гени и поддршка за да се забави напредувањето на болестите.
Во тек се напори да се најдат лекови или да се врати можноста да се направи дистрофин или утрофин.[38] Други напори вклучуваат обид да се блокира влезот на јони на калциум во мускулните клетки.[39]
Ексон-прескокнување
Антисенсен олигонуклеотиди (олиго), структурни аналози на ДНК, се основа на потенцијален третман за 10% од луѓето со ДМД.[40] Соединенијата дозволуваат да се прескокнат неисправните делови од генот дистрофин кога се препишува на РНК за производство на белковини, дозволувајќи им на уште скратената, но пофункционална верзија на белковината.[41] Познат е и како глупост терапија за сузбивање.[42]
Два вида олигос против чувствителност, 2'-О-метил фосфоротиоат олигос (како дрисаперсен ) и Морфолино олигос (како етпларисен ), имаат пробен доказ за корист и се изучуваат. Етпларисен е насочена кон прескокнување на егзон 51. „Како пример, прескокнувањето на егзон 51 ја враќа рамката за читање од 15% of од сите момчиња со бришење. Се сугерираше дека со 10 АОН да прескокнете 10 различни егзони би било можно да се справите со повеќе од 70% од сите момчиња од ДМД со бришење. “ [40] Ова претставува околу 1,5% од случаите.

Луѓето со Бакерова мускулна дистрофија, што е поблаго од ДМД, имаат форма на дистрофин која е функционална и покрај тоа што е пократка од нормалната дистрофин.[43] Во 1990 година Англија et al. забележал дека на пациент со лесна мускулна дистрофија Бекер му недостасува 46% од неговиот кодирачки регион за дистрофин. Оваа функционална, но сепак скратена форма на дистрофин, предизвика идеја дека пократкиот дистрофин сè уште може да биде терапевтски корисен. Истовремено, Коле и сор. има изменето спојување со таргетирање пред-mRNA со антисензен олигонуклеотиди (AONs).[44] Коле покажа успех со користење сплетка, насочени AONs на точната missplicing во клетките отстранети од пациентите бетаталасемија [45][46] тестирани група ексон скокнеш Вилтон е за мускулна дистрофија.[47][48]
Генетска терапија

Истражувачите работат на метод за уредување на гени за да ја поправат мутацијата што доведува до мускулна дистрофија Duchenne (DMD).[49] Истражувачите користеле техника наречена CRISPR / Cas9-посредувана монтажа на геном, што точно може да отстрани мутација во генот дистрофин во ДНК, дозволувајќи им на механизмите за поправка на ДНК на телото да ја заменат со нормална копија на генот.[50][51] Придобивката од ова во однос на другите техники на генска терапија е тоа што може трајно да го поправи „дефектот“ во ген, наместо само привремено да додава „функционален“.
Уредувањето на геномот преку системот CRISPR / Cas9 во моментов не е можно кај луѓето. Сепак, можно е, преку напредокот во технологијата, да се користи оваа техника за развој на терапии за ДМД во иднина.[52][53] Во 2007 година, истражувачите го направија првото тестирање на клинички (вирусно-посредувани) генетска терапија во светот за Д-р Душен.[54]
Биостофин е вектор за испорака за генска терапија во третманот на мускулна дистрофија на Душен и Бекер мускулна дистрофија .[55]
Наводи
Надворешни врски
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
