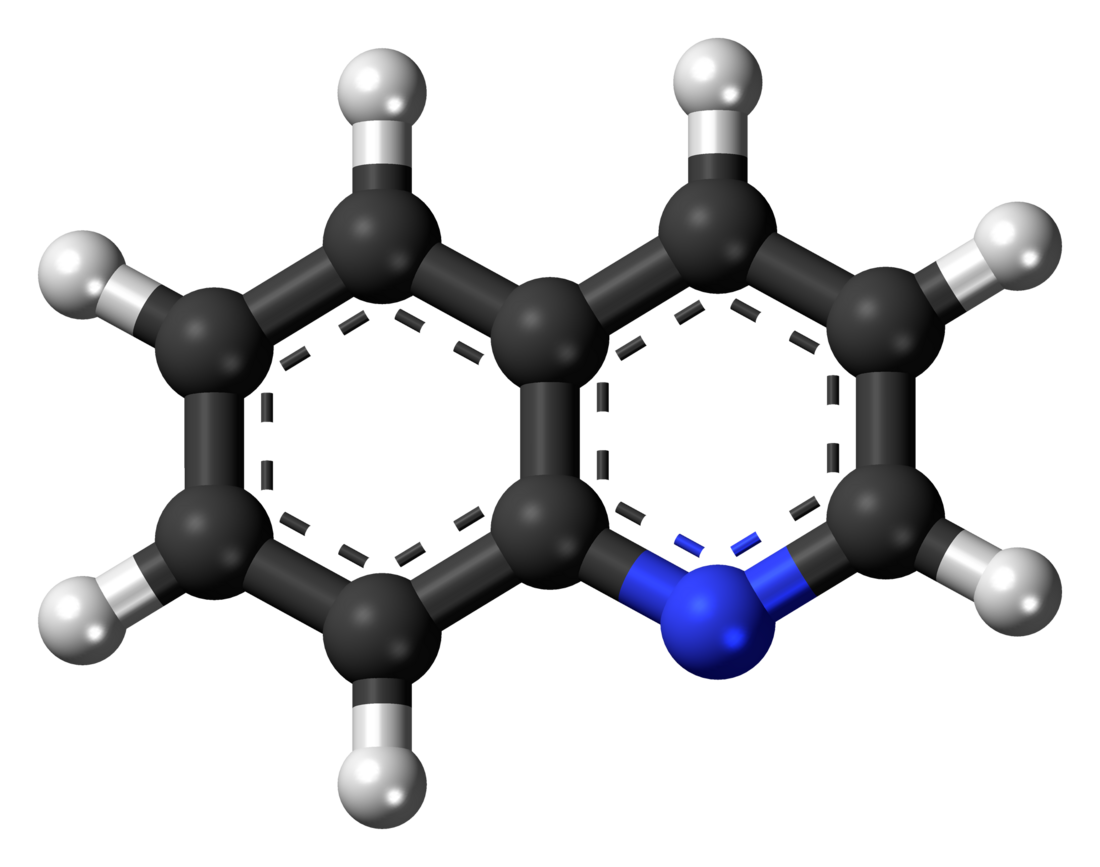
Hinolīns (C9H7N) ir heterociklisks slāpekli saturošs organiskais savienojums. Hinolīna molekula sastāv no kondensētiem benzola un piridīna gredzeniem (atšķirībā no izohinolīna molekulas hinolīnam slāpekļa atoms atrodas tuvāk pie benzola gredzena). Hinolīnam piemīt aromātiskas īpašības, jo tā π elektronu sistēma ir delokalizēta tāpat kā naftalīnam. Hinolīns ir iedzeltens šķidrums ar raksturīgu nepatīkamu smaku. Ūdenī šķīst ļoti vāji. Hinolīnam ir bāziskas īpašības, kas ir nedaudz vājākas nekā piridīnam vai izohinolīnam. Ar stiprām neorganiskām skābēm tas veido sāļus, kurus sauc par hinolīnija sāļiem.
| Hinolīns | |
|---|---|
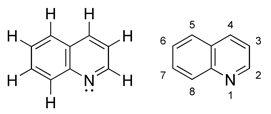 Hinolīna struktūrformulas   Hinolīna molekulas modeļi | |
| Citi nosaukumi |
benzo[b]azīns, benzo[b]azabenzols, leikols, leikonīns, benzo[b]piridīns, 1-azanaftalīns, hinoleīns |
| CAS numurs | 91-22-5 |
| Ķīmiskā formula | C9H7N |
| Molmasa | 129,16 g/mol |
| Blīvums | 1093 kg/m3 |
| Kušanas temperatūra | −15 °C |
| Viršanas temperatūra | 237 °C |
| Šķīdība ūdenī | slikta |
Vēsture
Hinolīnu pirmo reizi izolēja vācu ķīmiķis Fridlībs Ferdinands Runge (Friedlieb Ferdinand Runge) 1834. gadā no akmeņogļu darvas. Pirmo hinolīna sintēzi veica čehu ķīmiķis Zdenko Hanss Skraups (Zdenko Hans Skraup) 1880. gadā.
Atrašanās dabā
Hinolīna struktūra ir dažu alkaloīdu pamatā, no kuriem svarīgākais ir hinīnkoka mizas alkaloīds — hinīns (no tā cēlies arī hinolīna un daudzu citu savienojumu nosaukums). Hinīns un tam līdzīgas mākslīgas ārstniecības vielas (plazmohins, plazmocīds) ir svarīgi medikamenti malārijas ārstēšanai.
Iegūšana
Hinolīnu un tā metilatvasinājumus (piemēram, hinaldīnu) rūpnieciski iegūst no akmeņogļu darvas hinolīna-izohinolīna frakcijas.
Lai sintētiski iegūtu hinolīna sistēmu saturošus savienojumus (saslēgtu hinolīna ciklu), izmanto Skraupa sintēzi. Šī reakcija nosaukta atklājēja Zdenko Skraupa vārdā un tās laikā arilamīni (piemēram, anilīns) reaģē ar glicerīnu un sērskābi paaugstinātā temperatūrā oksidētāju klātienē. Par oksidētājiem var izmantot nitrobenzolu, arsēna pentoksīdu u.c. vielas. Vispirms no glicerīna sērskābes iedarbībā rodas akroleīns, kura dubultsaitei pēc tam pievienojas arilamīns. Izveidojies starpsavienojums ciklizējas, atšķeļ ūdens molekulu un visbeidzot oksidējas (zaudē ūdeņradi).

Otra svarīga hinolīna atvasinājumu iegūšanas metode ir Dēbnera—Millera sintēze, kuru atklājuši vācu ķīmiķi Oskars Dēbners (Oscar Döbner) un Vilhelms fon Millers (Wilhelm von Miller) 1881. gadā. Arī šajā reakcijā izmanto arilamīnus. Tie reaģē ar nepiesātinātajiem karbonilsavienojumiem (α,β-nepiesātinātiem aldehīdiem vai ketoniem) sālsskābes vai cinka hlorīda klātienē, pie kam nepiesātinātos savienojumus iegūst turpat reakcijas vidē no piesātinātiem aldehīdiem vai ketoniem. Bez tam reakcijas laikā arilamīni un aldehīdi kondensējas savā starpā, veidojot aldimīnus (C6H5N=CHR), kuri kalpo kā oksidētāji (reakcijas mehānisms līdzīgs Skraupa reakcijas mehānismam).

Īpašības
Skābā vidē protonējoties, hinolīns veido hinolīnija jonu un hinolīnija sāļus. Alkilējoties viegli veido ceturtējos sāļus (N-alkilhinolīnija sāļus). Elektrofilās aizvietošanas reakcijas (bromēšana, nitrēšana u.c.) hinolīnam parasti notiek pie 6. vai 8. oglekļa atoma.
Nukleofilie reaģenti parasti mēdz iedarboties uz hinolīna molekulas 2. atomu. Karsējot ar kālija hidroksīdu, rodas 2-hidroksihinolīns, ar nātrija amīdu (Čičibabina reakcija) — 2-aminohinolīns). Sevišķi viegli ar šādiem reaģentiem reaģē hinolīnija katjons, kas viegli veido lādiņa pārneses kompleksus.
Hidrogenējot hinolīnu platīna katalizatora klātienē, vispirms rodas 1,2,3,4-tetrahidrohinolīns (pirmais reaģē piridīna cikls), pilnīgi hidrējot — cis-dekahidrohinolīns.
Oksidējot ar kālija permanganātu vai HNO3, vispirms reaģē benzola gredzens un veidojas piridīn-2,3-dikarbonskābe (hinolīnskābe). Oksidējot ar peroksiskābēm (Karo skābi) vai ūdeņraža peroksīdu, rodas hinolīn-N-oksīds.
Izmantošana
Organiskajā sintēzē izmanto par šķīdinātāju (hinolīnā šķīst sērs un fosfors, kā arī sveķi un terpēni). Hinolīns ir arī dažādu bioloģiski aktīvu savienojumu (piemēram, nikotīnskābes) un analītiskās ķīmijas reaģentu sintēzes izejviela.
Literatūra
- O. Neilands. Organiskā ķīmija. Rīga: Zvaigzne, 1977, 718.—724. lpp.
Ārējās saites
 Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Hinolīns.
Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Hinolīns.- Encyclopædia Britannica raksts (angliski)
- Krievijas Lielās enciklopēdijas raksts (krieviski)
| Hetero- atomi |
Trīslocekļu cikli | Četrlocekļu cikli | Pieclocekļu cikli | Sešlocekļu cikli | Septiņlocekļu cikli | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Piesātinātie | Ne- piesātinātie |
Piesātinātie | Ne- piesātinātie |
Piesātinātie | Ne- piesātinātie |
Piesātinātie | Ne- piesātinātie |
Piesātinātie | Ne- piesātinātie | |
| O | Oksirāns | Oksirēns | Oksetāns | Oksets | Tetrahidrofurāns | Furāns | Tetrahidropirāns | Pirāns | Oksepāns | Oksepīns |
| S | Tiirāns | Tiirēns | Tietāns | Tiets | Tetrahidrotiofēns | Tiofēns | Tiāns | Tiīns | Tiepāns | Tiepīns |
| N | Aziridīns | Azirīns | Azetidīns | Azets | Pirolidīns | Pirols Pirolīns Indols*** Karbazols**** |
Piperidīns Hinuklidīns* |
Piridīns Hinolīns*** Izohinolīns*** Akridīns**** |
Azepāns | Azepīns |
| 2O | Dioksetāns | Dioksolāns | Dioksāns | |||||||
| 2N | Diazets | Pirazolidīns Imidazolidīns |
Pirazols Imidazols Pirazolīns Imidazolīns |
Piperazīns | Pirazīns Pirimidīns Piridazīns |
Diazepāns | Diazepīns | |||
| 3N | Triazols Benztriazols*** |
Triazīns | ||||||||
| 4N | Tetrazols | Tetrazīns | ||||||||
| 5N | Pentazols** | |||||||||
| S + N | Tiazolidīns | Tiazols Izotiazols |
Tiomorfolīns | Tiazīns | ||||||
| O + N | Oksaziridīns | Izoksazols Oksazols |
Morfolīns | Oksazīns | ||||||
| O + 2N | Furazāns | Oksadiazīns | ||||||||
- *divi sajūgti sešlocekļu cikli **cikls sastāv tikai no slāpekļa atomiem ***satur kondensētu benzola gredzenu ****satur 2 kondensētus benzola gredzenus
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.