아세트알데하이드
화합물 위키백과, 무료 백과사전
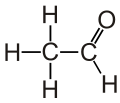
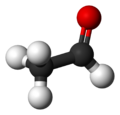
아세트알데하이드(영어: acetaldehyde 애시트앨더하이드[*] /ˌæsitˈædəhˌaid/) 또는 아세트알데히드(독일어: acetaldehyd)는 알데하이드 화합물의 일종이다. 에탄알(Ethanal)이라고도 한다.
| |||
| |||
| 이름 | |||
|---|---|---|---|
| 우선명 (PIN)
Acetaldehyde[1] | |||
| 체계명
Ethanal[1] | |||
| 별칭 | |||
| 식별자 | |||
3D 모델 (JSmol) |
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.761 | ||
| EC 번호 |
| ||
| KEGG | |||
PubChem CID |
|||
| RTECS 번호 |
| ||
| UNII | |||
CompTox Dashboard (EPA) |
|||
| |||
| |||
| 성질 | |||
| C2H4O | |||
| 몰 질량 | 44.053 g·mol−1 | ||
| 겉보기 | Colourless liquid | ||
| 냄새 | Ethereal | ||
| 밀도 | 0.784 g·cm−3 (20 °C)[4]
0.7904–0.7928 g·cm−3 (10 °C)[4] | ||
| 녹는점 | −123.37 °C (−190.07 °F; 149.78 K) | ||
| 끓는점 | 20.2 °C (68.4 °F; 293.3 K) | ||
| miscible | |||
| 용해도 | miscible with ethanol, ether, benzene, toluene, xylene, turpentine, acetone slightly soluble in chloroform | ||
| log P | -0.34 | ||
| 증기 압력 | 740 mmHg (20 °C)[5] | ||
| 산성도 (pKa) | 13.57 (25 °C, H2O)[6] | ||
자화율 (χ) |
-.5153−6 cm3/g | ||
굴절률 (nD) |
1.3316 | ||
| 점도 | 0.21 mPa-s at 20 °C (0.253 mPa-s at 9.5 °C)[7] | ||
| 구조 | |||
| trigonal planar (sp²) at C1 tetrahedral (sp³) at C2 | |||
| 2.7 D | |||
| 열화학 | |||
표준 몰 엔트로피 (S |
250 J·mol−1·K−1 | ||
표준 생성 엔탈피 (ΔfH⦵298) |
−166 kJ·mol−1 | ||
| 위험 | |||
| 주요 위험 | potential occupational carcinogen[8] | ||
| 물질 안전 보건 자료 | HMDB | ||
| GHS 그림문자 |    [9] [9] | ||
GHS 유해위험문구 |
H224, H319, H335, H351[9] | ||
GHS 예방조치문구 |
P210, P261, P281, P305+351+338[9] | ||
| NFPA 704 (파이어 다이아몬드) | |||
| 인화점 | −39.00 °C; −38.20 °F; 234.15 K | ||
| 175.00 °C; 347.00 °F; 448.15 K[5] | |||
| 폭발 한계 | 4.0–60% | ||
| 반수 치사량 또는 반수 치사농도 (LD, LC): | |||
LD50 (median dose) |
1930 mg/kg (rat, oral) | ||
LC50 (median concentration) |
13,000 ppm (rat), 17,000 ppm (hamster), 20,000 ppm (rat)[8] | ||
| NIOSH (미국 건강 노출 한계): | |||
PEL (허용) |
200 ppm (360 mg/m3)[5] | ||
IDLH (직접적 위험) |
2000 ppm[5][8] | ||
| 관련 화합물 | |||
관련 알데하이드 |
폼알데하이드 Propionaldehyde | ||
관련 화합물 |
Ethylene oxide | ||
분자식은 CH3CHO이다. 상온에서는 무색 액체로 존재한다. 녹는점은 -123.5°C, 끓는점은 20.2°C이다.[10] 물, 에탄올, 에테르와 잘 섞인다. 연소열은 218.9kcal이다.
체내에서는 술의 주성분인 에탄올의 대사과정에서 형성되는 대사산물이며, 숙취의 원인이다. 간에 있는 알데하이드 탈수소효소(Aldehyde Dehydrogenase, ALDH)는 아세트알데하이드를 다시 아세트산으로 분해해 알코올 대사를 진행하게 되는데, ALDH가 부족할 경우 술을 마시면 얼굴이 금방 붉어지게 된다.[11][12]
감에서 떫은맛이 사라지는 이유와 관련되어 있는데, 감의 무기호흡 과정에서 생성되어 떫은맛의 원인인 타닌과 중합을 일으키기 때문에 감의 떫은맛이 사라지게 된다.[13]
반응
아세트알데하이드가 관여된 반응으로는 주로 다음과 같은 것이 있다.[10]
- 암모니아성 질산 은 용액(톨렌스 시약)과 반응하여 은을 생성한다. 이 반응을 은거울반응이라고도 한다.
- 펠링 용액과 반응하여 산화 구리(I)을 생성한다.
- 아황산으로 인해 탈색된 로자닐린과 반응하면 로자닐린의 분홍색이 다시 나타난다.
- 산과 0°C 이하에서 반응하여 메타알데하이드를 생성한다.
- 오염화 인과 반응하여 1,1-다이클로로에테인을 생성한다.
- 염소와 반응하여 클로랄(CCl3CHO)를 생성한다.
- 황화 수소와 반응하여 싸이오아세트알데하이드(CH3CHS)나 (CH3CHS)3를 생성한다.
- 페닐 하이드라진과 반응하여 아세트알데하이드 페닐하이드라존(CH3-CH=N-NH-C6H5)를 생성한다.
- 세미카바자이드와 반응하여 아세트알데하이드 세미카바자이드(CH3-CH=N-NH-CO-NH2)를 생성한다.
이중 암모니아성 질산 은 용액, 로자닐린, 페닐 하이드라진, 세미카바자이드와의 반응은 아세트알데하이드의 검출에 널리 사용된다.[10]
제법
공업적으로 아세트알데하이드를 대량생산하는 방법으로는 다음과 같은 것이 있다.[10]
용도
아세트알데하이드는 주로 다음과 같은 용도로 사용된다.[10]
안전성
섭취 시 위장에 자극을 주고 구역질, 구토, 설사를 일으킬 수 있다. 삼킬 경우 해롭다. 중추신경억제제로 작용한다.[14]
흡입 시 기도에 자극을 줄 수 있으며, 고농도에는 마취 효과가 있을 수 있다. 노출될 경우 중추신경억제 효과가 있을 수 있다. 증기는 어지러움 또는 질식을 일으킬 수 있으며, 폐수종이 있을 수 있다. 다량을 흡입할 경우 호흡 항진이 있을 수 있으며 그 뒤 호흡 불량, 경련, 호흡계 마비로 인한 사망에 이를 수 있다.[14]
피부를 자극하고, 민감하게 만든다. 알레르기 반응이 있을 수 있다.[14]
눈에 심각한 염증을 일으킬 수 있다. 증기는 눈을 자극할 수 있다. 일시적인 각막의 손상을 줄 수 있다. 최루 효과가 있다.[14]
같이 보기
각주
외부 링크
참고 문헌
Wikiwand - on
Seamless Wikipedia browsing. On steroids.