표피포도상구균
포도상구균에 속하는 그람 양성균 위키백과, 무료 백과사전
표피포도상구균(학명: Staphylococcus epidermidis) 또는 백색포도상구균(학명: Staphylococcus albus)은 그람 양성균으로 포도상구균(Staphylococcus)에 속하는 40여 종 중 하나이다.[1] 정상적인 인간 마이크로바이옴의 일부이며, 일반적으로 피부 미생물로 존재하며 덜 일반적으로는 점막 미생물로도 존재한다. 해양의 해면동물에서도 발견된다.[2][3] 통성 혐기성 미생물이다. 표피포도상구균은 일반적으로 병원성이 없지만 면역계가 손상된 환자는 표피포도상구균으로 인한 감염이 발생할 위험이 있다. 이러한 감염은 일반적으로 병원에서 일어나는 원내감염이다.[4] 표피포도상구균은 카테터나 기타 외과용 이식 장치를 사용하는 사람들에게 특히 걱정되는 요소인데, 표피포도상구균이 이러한 장치에서 자라서 생물막을 형성하는 것으로 알려져 있기 때문이다.[5] 정상 피부 미생물의 일부인 표피포도상구균은 진단 실험실로 보내지는 표본의 빈번한 오염 물질 중 하나이다.[6]
표피포도상구균의 일부 균주는 높은 농도의 소금에 버티는 내염성이 매우 높으며 해양 환경에서 흔히 발견된다.[3] SI Paul et al.(2021)[3]은 방글라데시 벵골만의 세인트마틴섬의 클리오나 비리디스(Cliona viridis)라는 해면에서 표피포도상구균의 내염성 균주(균주 ISP111A, ISP111B 및 ISP111C )를 분리하여 확인했다.

어원
'Staphylococcus'는 포도와 같은 과일더미라는 뜻을 가지며 'epidermidis'는 표피(epidermis)라는 뜻이다.[7]
발견
프리드리히 율리우스 로젠바흐는 1884년에 표피포도상구균을 황색포도상구균과 구별하여 처음에는 S. epidermidis가 아닌 S. albus로 명명했다.[8] 그는 황색포도상구균과 표피포도상구균이 각각 노란색과 흰색 균락을 형성했기 때문에 종명으로 aureus 와 albus 를 선택했다.
세포 형태 및 생화학
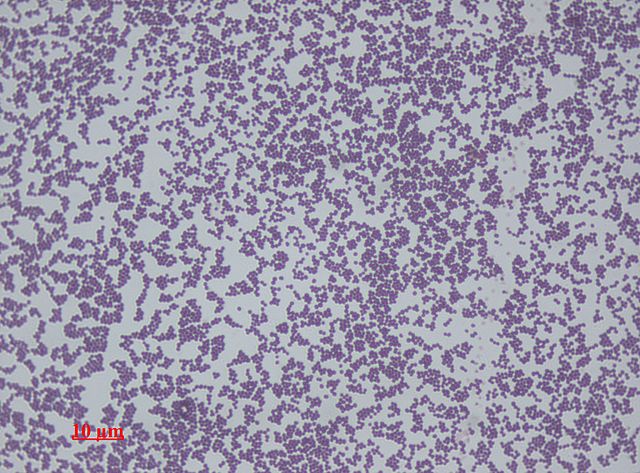
표피포도상규균은 운동성이 없는 그람 양성의 구균으로 구성된 매우 강인한 미생물로 포도 모양의 군집을 이루며 배열되어 있다. 융기되어 있고 응집력 있는 흰색 집락을 형성한다. 하룻밤 배양 후 직경 1-2mm의 집락을 이루며 혈액한천배지에서 용혈되지 않는다.[5] 호기성 호흡이나 발효 양쪽 모두에 의해 자랄 수 있는 통성 혐기성이며 카탈레이스 양성,[9] 응고효소 음성이다. 일부 균주는 발효를 하지 못할 수 있다.[3][10]
생화학적 검사에 따르면 이 미생물은 질산염 환원효소 검사에서도 약한 양성 반응을 보인다. 유레이스(요소분해효소) 생산 양성이고 산화효소 음성이며 포도당, 수크로스(자당), 락토스(유당)를 사용하여 산성 생성물을 만들 수 있다. 락토스가 있으면 기체도 생성된다. 비병원성 표피포도상구균은 병원성 황색포도상구균과 달리 젤라티네이스 효소가 없어 젤라틴을 가수분해하지 못한다.[11][12] 표피포도상구균은 노보비오신에 민감하며 이 성질은 같은 응고효소 음성이지만 노보비오신에 내성을 가지는 부생성포도상구균(S. saprophyticus)과 구별하는 중요한 검사 포인트가 된다.[4]
황색포도상구균의 세포벽과 유사하게 표피포도상구균의 세포벽에는 유기체가 트랜스페린으로부터 철을 얻는 데 도움이 되는 트랜스페린 결합 단백질이 있다. 표면에 노출된 단백질 사량체인 글리세르알데하이드 3-인산 탈수소효소는 트랜스페린에 결합하여 철을 제거하는 것으로 여겨진다. 이후에는 철을 표면 지질단백질로 이동시킨 다음 철을 세포로 운반하는 단백질을 이동시킨다.[5]
생화학적 특징
해양 표피포도상구균의 균락, 형태학적, 생리학적, 생화학적 특성은 아래 표와 같다.[3]
| 검사 유형 | 검사 | 특징 |
| 균락 특징 | 크기 | 매우 작음 |
| 유형 | 둥글다 | |
| 색깔 | 불투명 | |
| 모양 | 볼록함 | |
| 형태학적 특징 | 모양 | 구균 |
| 생리학적 특징 | 운동성 | – |
| 6.5% NaCl에서의 성장 | + | |
| 생화학적 특징 | 그람 염색 | + |
| 산화효소 | – | |
| 카탈레이스 | + | |
| 산화-발효 | 발효 | |
| 운동성 | – | |
| 메틸 레드 | – | |
| 보주-프로스카우어 | + | |
| 인돌 | – | |
| 황화수소 생산 | + | |
| 유레이스 | + | |
| 질산염 환원효소 | + | |
| β-갈락토시데이스 | + | |
| 가수분해 | 젤라틴 | – |
| 에스쿨린 | + | |
| 카세인 | + | |
| 트윈 40 | + | |
| 트윈 60 | + | |
| 트윈 80 | + | |
| 산 생산 | 글리세린 | – |
| 갈락토스 | W | |
| D-글루코스 | + | |
| D-과당 | + | |
| D-만노스 | + | |
| 만니톨 | – | |
| N-아세틸글루코사민 | + | |
| 아미그달린 | + | |
| 말토오스 | + | |
| D-멜리비오스 | + | |
| D-트레할로스 | + | |
| 글리코겐 | + | |
| D-투라노스 | + |
참고: + = 양성, – = 음성, W= 약한 양성
독성과 항생제 내성
각종 의학 장치에서 생물막을 형성하는 능력은 표피포도상구균의 주요 독력인자이다. 생물막을 만드는 한 가지 가능한 원인은 혈액과 세포외기질의 단백질에 결합하는 표면 단백질이다. 표면 단백질은 황산화 다당류로 구성된 다당류 세포간 접착소(polysaccharide intercellular adhesin, PIA)라는 세포외 물질을 생성한다. PIA는 다른 세균이 이미 존재하는 생물막에 결합하여 다층의 생물막을 생성하도록 한다. 이러한 생물막은 그 안에 있는 세균의 대사 활동을 감소시킨다. 대사가 감소되면 항생제의 확산에 장애가 생겨 항생제가 감염을 효과적으로 제거하는 것을 어렵게 만든다.[5] 표피포도상구균 균주는 종종 리파마이신, 플루오로퀴놀론, 겐타마이신, 테트라사이클린, 클린다마이신, 설폰아마이드와 같은 항생제에 내성을 가진다.[13] 메티실린 내성은 특히 광범위하며 병원의 75-90%에서 메티실린 내성 균주를 분리한다.[13] 저항성 균주는 창자에서 가장 흔하게 발견되지만 피부에 정상적으로 자유롭게 살고 있는 표피포도상구균도 땀에서 분비되는 항생물질에 일상적인 노출되며 내성을 가질 수 있다.
질병

위에서 언급한 바와 같이 표피포도상구균은 체내에 배치된 의료 장치에서 생물막이 자라도록 한다.[13] 생물막은 정맥 카테터와 의료용 보철물에서 가장 흔하게 발생한다.[14] 표피포도상구균 감염은 투석을 받는 중인 환자나 오염된 의료 장치를 이식한 사람에게서도 발생할 수 있다. 또한 심장 판막에 결함이 있는 환자에서 가장 흔하게 심내막염을 유발한다. 패혈증의 원인균이기도 하다.[15]
항생제는 생물막을 제거하는 데는 거의 효과가 없다. 이러한 감염에 대한 가장 일반적인 치료법은 감염된 보철물을 제거하거나 교체하는 것이지만 모든 경우에 예방이 이상적이다. 선택 약물은 종종 반코마이신이며 여기에 리팜핀 또는 아미노글리코사이드를 추가할 수 있다.[16] 손 씻기는 감염 확산을 줄이는 것으로 나타났다.
예비 연구에 따르면 표피포도상구균은 일반적으로 여드름균(Cutibacterium acnes, 이전 학명은 Propionibacterium acnes) 혼자 감염된 상태인 여드름 모공 내부에서 자주 발견된다.[17]
여드름에서의 역할
정상 피부의 표피포도상구균은 비병원성이다. 그러나 비정상적인 병변에서는 병원성이 되고 여드름에서 이런 병원성 균주가 나타날 가능성이 크다. 표피포도상구균은 피지샘(여드름을 일으키는 주된 원인균인 여드름균이 이곳에 집락을 이룸)에 침입하여 지방 분해 효소를 생산한다. 효소로 인해 피지를 조밀하고 두꺼운 형태로 변화시켜 염증을 일으키고 모낭을 손상시킨다.[18]
더욱이 PIA를 방출하며 표피포도상구균 생물막이 형성되면 여드름균이 집락을 이루기 쉬운 혐기성 환경이 만들어지고 인간의 선천면역 분자로부터 균이 보호된다.[19]
여드름균과 표피포도상구균은 서로 상호작용하며 병원체 집락으로부터 숙주 피부 건강을 보호할 수 있다. 그러나 두 균이 경쟁하는 경우에는 동일한 탄소원(예: 글리세롤)을 사용하여 서로에 대한 항균제 역할을 하는 짧은사슬 지방산을 생산한다. 또한 표피포도상구균은 피부 염증을 유발하는 톨유사수용체 2(TLR2) 단백질 생성을 감소시켜 피부 항상성에 도움을 주고 여드름균으로 인한 병원성 염증을 감소시킨다.[20]
식별
표피포도상구균을 검출하는 일반적인 방법은 선택배지에서의 집락 모양, 광학 현미경으로 봤을 때의 세균 형태, 카탈레이스와 슬라이드 응고효소 검사를 사용하는 것이다. 조벨(Zobell) 한천배지는 해양 생물로부터 표피포도상구균을 분리하는 데 유용하다.[3] 달걀 노른자가 첨가된 베어드-파커 한천배지(Baird-Parker agar)에서는 집락이 작고 검게 보인다. 포도상구균 균주의 신속한 검출과 식별을 위해 정량적 PCR(qPCR)과 같은 기술이 점점 더 많이 사용되고 있다.[21][22] 일반적으로 데스페록사민에 대한 감수성은 똑같이 데스페록사민 감수성을 가지는 스타필로코커스 호미니스(Staphylococcus hominis)의 경우를 제외하고 대부분의 다른 포도상구균과 구별하는 데 사용할 수 있다.[23] 이 경우 S. hominis가 트레할로스에서 생산하는 산을 사용하여 두 종을 구분할 수 있다.
같이 보기
각주
추가 자료
외부 링크
Wikiwand - on
Seamless Wikipedia browsing. On steroids.

