ಇಂಗಾಲ
ಪರಮಾಣು ಸಂಖ್ಯೆ 6 ರ ರಾಸಾಯನಿಕ ಅಂಶ From Wikipedia, the free encyclopedia
Remove ads
Remove ads
ಇಂಗಾಲ (Carbon - ಕಾರ್ಬನ್)ವು ಬ್ರಹ್ಮಾಂಡದಲ್ಲಿ ೪ನೇ ಅತಿ ಹೇರಳ ಮೂಲಧಾತು. ಗ್ರಾಫೈಟ್, ವಜ್ರ ಮತ್ತು ಇದ್ದಲು ಇಂಗಾಲದ ಪ್ರಮುಖ ರೂಪಗಳು. ಇದರ ಪರಮಾಣು ಸಂಖ್ಯೆ ೬, ಸಂಕೇತ C, ಪರಮಾಣುಭಾರ ೧೨,೦೧೧೧೫.
ಇಂಗಾಲ ಮೆಂಡಿಲೀಫನ ಆವರ್ತಕೋಷ್ಟಕದಲ್ಲಿ ನಾಲ್ಕನೆಯ ಗುಂಪಿನಲ್ಲಿ (ಗ್ರೂಪ್) ಇದೆ.[೧] ಈ ಗುಂಪಿನಲ್ಲಿ ಸಿಲಿಕಾನ್, ಜರ್ಮೇನಿಯಂ, ತವರ ಮತ್ತು ಸೀಸಗಳಿವೆ. ಇವುಗಳಲ್ಲಿ ಇಂಗಾಲ ಮತ್ತು ಸಿಲಿಕಾನುಗಳು ಮಾತ್ರ ಅಲೋಹಗಳು. ಉಳಿದವು ಲೋಹಗಳು. ಇಂಗಾಲದ ರಸಾಯನಶಾಸ್ತ್ರವನ್ನು ಅರಿಯಲು ಅದರ ವೇಲೆನ್ಸಿ ನಾಲ್ಕು ಎಂದೂ ಈ ವೇಲೆನ್ಸಿಗೆ ಋಣ ವಿದ್ಯುತ್ಕಣಗಳ (ಎಲೆಕ್ಟ್ರಾನ್) ಲಾಭ ಅಥವಾ ನಷ್ಟಗಳಲ್ಲದೆ ಇತರ ಪರಮಾಣುಗಳೊಡನೆ ಆಗುವ ಹಂಚಿಕೆಯೇ ಕಾರಣವೆಂದೂ ಮನದಟ್ಟು ಮಾಡಿಕೊಳ್ಳಬೇಕು. ಈ ಬಗೆಯ ವೇಲೆನ್ಸಿಗೆ ಕೋವೇಲೆನ್ಸಿ ಎಂದು ಹೆಸರು.
ಪ್ರಕೃತಿಯಲ್ಲಿ ಇಂಗಾಲ ಮುಕ್ತಸ್ಥಿತಿಯಲ್ಲಿಯೂ ಸಂಯೋಜಿತ ರೂಪದಲ್ಲಿಯೂ ಹೇರಳವಾಗಿ ದೊರೆಯುತ್ತದೆ. ರಾಸಾಯನಿಕವಾಗಿ ಇದು ಜಡವಸ್ತು. ಆದರೆ ಇದನ್ನೊಳಗೊಂಡಿರುವ ಸಂಯುಕ್ತಗಳ ಸಂಖ್ಯೆ ಅನೇಕ. ಇಷ್ಟು ಸಂಖ್ಯೆಯ ಸಂಯುಕ್ತಗಳಿರುವ ಮೂಲವಸ್ತು ಇನ್ನೊಂದಿಲ್ಲ.[೨] ಇದಕ್ಕೆ ಕಾರಣ ಇಂಗಾಲದ ಕೋವೇಲೆನ್ಸಿ. ಇದರಿಂದ ಇಂಗಾಲದ ಪರಮಾಣುಗಳು ಒಂದರೊಡನೊಂದು ಕೂಡಿಕೊಂಡು ಉದ್ದನೆಯ ಸರಪಳಿಗಳು, ವೃತ್ತಗಳು ಮೊದಲಾಗಿ ಅನೇಕ ಆಕಾರಗಳಿರುವ ಹಿರಿಯ ಗಾತ್ರದ ಅಣುಗಳ ಸೃಷ್ಟಿಗೆ ಕಾರಣವಾಗಬಲ್ಲವು. ಅಂತೆಯೇ ಸಂಯುಕ್ತಗಳ ವೈವಿಧ್ಯವೂ ಹೆಚ್ಚುತ್ತದೆ. ಪ್ರಕೃತಿಯಲ್ಲಿರುವ ಜೀವಜನ್ಯ ಸಂಯುಕ್ತಗಳೆಲ್ಲವೂ ಇಂಗಾಲವನ್ನೊಳಗೊಂಡಿವೆ ಎಂದರೆ ಪ್ರಪಂಚದಲ್ಲಿ ಇಂಗಾಲದ ಪ್ರಸರಣದ ವ್ಯಾಪ್ತಿ ಅರ್ಥವಾದಂತಾಗುತ್ತದೆ. ಗಾಳಿಯಲ್ಲಿಯೂ ಇದು ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡ್ ರೂಪದಲ್ಲಿವೆ. ಖನಿಜಗಳಾದ ಸುಣ್ಣಕಲ್ಲು (ಲೈಮ್ಸ್ಟೋನ್, CaCO3), ಅಮೃತಶಿಲೆ (ಮಾರ್ಬಲ್ CaCO3), ಡೋಲೋಮೈಟ್ (MgCO3) ಮೊದಲಾದುವು ಇಂಗಾಲವನ್ನೊಳಗೊಂಡಿವೆ. ಧಾತುರೂಪದಲ್ಲಿರುವ ಇಂಗಾಲ ಮತ್ತು ಅದರ ಹಲವು ಸರಳ ಸಂಯುಕ್ತಗಳನ್ನು ಕುರಿತು ಇಲ್ಲಿ ಬರೆದಿದೆ.
Remove ads
ಮುಕ್ತ ಸ್ಥಿತಿಯಲ್ಲಿ ದೊರೆಯುವ ಇಂಗಾಲ
ಮೂರು ಮುಖ್ಯ ಬಹುರೂಪಗಳಲ್ಲಿ (ಅಲೊಟ್ರೋಪಿಕ್ ಫಾರ್ಮ್ಸ್) ಮುಕ್ತಸ್ಥಿತಿಯ ಇಂಗಾಲ ದೊರೆಯುತ್ತದೆ: (೧) ವಜ್ರ. (೨) ಗ್ರಾಫೈಟ್:- ಇವು ಸ್ಫಟಿಕ (ಕ್ರಿಸ್ಟಲ್ಲೈನ್) ರೂಪಗಳು: (೩) ಅಸ್ಫಟಿಕ (ಅಮಾರ್ಫಸ್) ಇಂಗಾಲ. ಇದ್ದಲುಗಳು, ಕಲ್ಲಿದ್ದಲು, ದೀಪದ ಎಣ್ಣೆಯ ಮತ್ತು ವಿವಿಧ ಅನಿಲ ಉರುವಲುಗಳ ಮಸಿಗಳು-ಇವು ಅಸ್ಫಟಿಕ ರೂಪಗಳು. ವಿವಿಧ ರೂಪಗಳಲ್ಲಿರುವ ಇಂಗಾಲಗಳ ಭೌತಗುಣಗಳಲ್ಲಿ ಬಲು ವ್ಯತ್ಯಾಸವಿದ್ದರೂ ರಾಸಾಯನಿಕ ಗುಣಲಕ್ಷಣಗಳಲ್ಲಿ ವ್ಯತ್ಯಾಸವಿಲ್ಲ ಮತ್ತು ಅವನ್ನು ರಾಸಾಯನಿಕ ಕ್ರಿಯೆಗಳಿಗೆ ಒಳಪಡಿಸದೆ ಒಂದು ರೂಪದಿಂದ ಮತ್ತೊಂದು ರೂಪಕ್ಕೆ ಪರಿವರ್ತಿಸಬಹುದು.
ವಜ್ರ
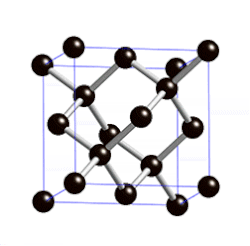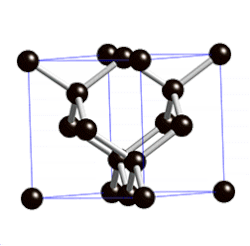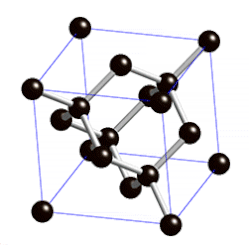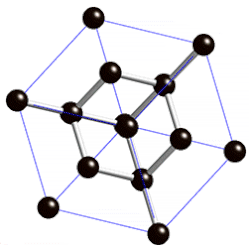
ವಜ್ರದಲ್ಲಿ ಪರಮಾಣುವಿನಿಂದ ಪರಮಾಣುವಿಗೆ ಇರುವ ದೂರ ೧.೫೪೪ ಆಂಗ್ಸ್ಟ್ರಾಮ್ ಎಂದೂ ಬಂಧಗಳ ನಡುವಿನ ಕೋನ ೧೦೯೦೨೮’ ಗಳೆಂದೂ ಎಕ್ಸ್ಕಿರಣನಮನ (ಎಕ್ಸ್ರೇ ಡಿಫ್ರ್ಯಾಕ್ಷನ್) ವಿಧಾನದಿಂದ ಅಳೆಯಲಾಗಿದೆ. ಪ್ರತಿಯೊಂದು ಇಂಗಾಲದ ಪರಮಾಣುವೂ ಆಕಾಶದಲ್ಲಿ (ಸ್ಪೇಸ್) ನಾಲ್ಕು ಬಂಧಗಳನ್ನು ಹೊಂದಿದ್ದು ಇತರ ನಾಲ್ಕು ಪರಮಾಣುಗಳೊಡನೆ ಸಂಪರ್ಕ ಪಡೆದಿರುವುದು ವಜ್ರದ ಮೂರು ಆಯಾಮದ ರಚನೆ ಚಿತ್ರದಲ್ಲಿ ತೋರಿಸಿದೆ.
ಇಂಥ ರಚನೆಯಲ್ಲಿ ಅಣುಬಂಧಗಳ ಮೇಲೆ ಯಾವ ಒತ್ತಡವೂ ಇಲ್ಲದಿರುವುದರಿಂದ ಬಂಧಗಳ ಬಂಧನ ಶಕ್ತಿ ಬಲು ಹೆಚ್ಚಿದ್ದು ಈ ರಚನೆಯೇ ವಜ್ರದ ಕಠಿಣತೆಗೆ (ಹಾರ್ಡ್ನೆಸ್) ಕಾರಣವಾಗಿದೆ. ಘನಾಕೃತಿ ಅಥವಾ ಅಷ್ಟಮುಖ ಸ್ಫಟಿಕಾಕೃತಿಯಲ್ಲಿ ದೊರೆಯುವ ವಜ್ರ ಕಠಿಣತೆಯಲ್ಲಿ ಇತರ ಎಲ್ಲ ವಸ್ತುಗಳನ್ನೂ ಮೀರಿಸಿದೆ. ಮೋಸ್ಕಠಿಣತೆಯಮಾನದಲ್ಲಿ (Moh's scale of hardness) ವಜ್ರದ ಮಾನ ೧೦. ಆದರೆ ವಜ್ರ ಸಾಕಷ್ಟು ಪೆಡಸೂ (ಬ್ರಿಟಲ್) ಹೌದು. ವಜ್ರದ ಸಾಂದ್ರತೆ ೩.೫೧. ಇದಕ್ಕೆ ಬೆಳಕನ್ನು ಪ್ರಸರಿಸುವ ಶಕ್ತಿ ಅಧಿಕವಾಗಿದೆ. ಇದು ಬಿಳಿಯ ಬೆಳಕನ್ನು ಬಣ್ಣ ಬಣ್ಣದ ಕಿರಣಗಳಾಗಿ ಒಡೆಯುವುದರಿಂದ ಮನೋಹರವಾಗಿ ಕಾಣಬಲ್ಲುದು. ರಾಸಾಯನಿಕವಾಗಿ ವಜ್ರ ಬಲು ಜಡ. ಶೂನ್ಯ ವಾತಾವರಣದಲ್ಲಿ ವಜ್ರವನ್ನು ೧೫೦೦೦ ಸೆ. ವರೆಗೆ ಕಾಸಿದಾಗಲೂ ಬದಲಾವಣೆ ಕಂಡುಬರುವುದಿಲ್ಲ. ಆದರೆ ೧೮೦೦೦ ಸೆ. ಉಷ್ಣತೆಯಲ್ಲಿ ಇದು ಗ್ರಾಫೈಟ್ ಆಗಿ ಪರಿವರ್ತಿತವಾಗುತ್ತದೆ. ೭೦೦೦-೯೦೦೦ ಸೆ. ಉಷ್ಣತೆಯಿರುವಾಗ ಗಾಳಿ, ಆಕ್ಸಿಜನ್ಗಳಲ್ಲಿ ಹೊತ್ತಿ ಉರಿದು ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡನ್ನು ನೀಡುತ್ತದೆ. ಬಲುಮಟ್ಟಿಗೆ ಎಲ್ಲ ರಾಸಾಯನಿಕ ವಸ್ತುಗಳನ್ನು ವಜ್ರ ನಿರೋಧಿಸಬಲ್ಲುದು.
ಗ್ರಾಫೈಟ್
ಗ್ರಾಫೈಟಿನಲ್ಲಿ ಸಹ ಇಂಗಾಲದ ಅಣುಗಳ ಜೋಡಣೆ ಕ್ರಮಬದ್ಧವಾಗಿದೆ. ಆದರೆ ವಜ್ರದಲ್ಲಿನ ಜೋಡಣೆಗಿಂತ ಇದು ಭಿನ್ನ. ಗ್ರಾಫೈಟಿನಲ್ಲಿ ಇಂಗಾಲದ ಅಣುಗಳು ಹಾಳೆಗಳಾಗಿ ಜೋಡಣೆಯಾಗಿದ್ದು ಹಾಳೆಯಿಂದ ಹಾಳೆಗೆ ಸಡಿಲಬಂಧವಿದೆ.[೩] ಅಂಥ ಹಾಳೆ ಅಥವಾ ಪದರಗಳಲ್ಲಿ ಇಂಗಾಲದ ಅಣುಗಳ ನಡುವಿನ ಅಂತರ ೧.೪೨೧ ಆಂಗ್ಸ್ಟ್ರಾಮ್, ಬಂಧಗಳ ನಡುವಿನ ಕೋನ ೧೨೦೦ ಮತ್ತು ಹಾಳೆಗಳ ನಡುವಣ ಅಂತರ ೩.೩೫೪ ಆಂಗ್ಸ್ಟ್ರಾಮ್. ಈ ಅಂತರ ಹೆಚ್ಚಾಗಿರುವುದರಿಂದಲೇ ಹಾಳೆಯಿಂದ ಹಾಳೆಗಿರುವ ಬಂಧ ಸಡಿಲವಾಗಿದ್ದು ಅವು ಒಂದನ್ನೊಂದು ಬಿಟ್ಟು ಜಾರಬಲ್ಲವು. ಗ್ರಾಫೈಟ್ ಮೆದುವಾಗಿರುವುದಕ್ಕೂ ಇದೇ ಕಾರಣ. ಕಾಗದದ ಮೇಲೆ ಉಜ್ಜಿದಾಗ ಪದರಗಳು ಬೇರ್ಪಡೆಯಾಗಿ ತೆಳುಪದರವೊಂದು ಕಾಗದದ ಮೇಲೆ ಉಳಿಯುತ್ತದೆ. ಗ್ರಾಫೈಟ್ ಪದರಗಳು ಒಂದರ ಮೇಲೊಂದು ಸುಲಭವಾಗಿ ಸರಿಯಬಲ್ಲವಾದ್ದರಿಂದ ಗ್ರಾಫೈಟ್ ಉತ್ತಮ ಘರ್ಷಣ ಕ್ಷೀಣಕಾರಿ ಅಥವಾ ಮೃದುಚಾಲಕ (ಲ್ಯೂಬ್ರಿಕೆಂಟ್). ಗ್ರಾಫೈಟ್ ಗಣಿಗಳು ಯೂರೋಪಿನ ಅನೇಕ ಭಾಗಗಳಲ್ಲಿ, ದಕ್ಷಿಣ ಅಮೆರಿಕದ ಹಲವು ಭಾಗಗಳಲ್ಲಿ ಮತ್ತು ಕೆನಡಾದಲ್ಲಿ ಇವೆ.

ಉತ್ತಮ ದರ್ಜೆಯ ಗ್ರಾಫೈಟಿನ ಅತಿದೊಡ್ಡ ಗಣಿಗಳು ಸಿಲೋನ್ ಮತ್ತು ಮಲೇಷ್ಯ ದ್ವೀಪಗಳಲ್ಲಿವೆ. ಗ್ರಾಫೈಟಿನ ಸಾಂದ್ರತೆ ೨.೨೫. ದುರ್ಬಲ ಆಮ್ಲಗಳಾಗಲೀ ಕ್ಷಾರವಸ್ತುಗಳಾಗಲೀ ಗ್ರಾಫೈಟಿನೊಡನೆ ವರ್ತಿಸಲಾರವು. ತೀವ್ರ ಉತ್ಕರ್ಷಕಾರಿಗಳ ಸಾನ್ನಿಧ್ಯದಲ್ಲಿ ಮತ್ತು ೭೦೦೦ ಸೆ. ಉಷ್ಣತೆಯಲ್ಲಿ ಹೊತ್ತಿ ಉರಿದು ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ ಆಗಿ ಪರಿವರ್ತಿತವಾಗುತ್ತದೆ. ಗ್ರಾಫೈಟನ್ನು ಸೀಸದ ಕಡ್ಡಿಗಳಲ್ಲಿ, ಅನೇಕ ಘರ್ಷಣಕ್ಷೀಣಕಾರಿ ತೈಲಗಳಲ್ಲಿ, ಹಲವು ಲೋಹಗಳ ತಯಾರಿಕೆಗಳಲ್ಲಿ ವಿದ್ಯುದ್ಧ್ರುವಗಳಾಗಿ ಮತ್ತು ಮೂಸೆಗಳನ್ನು ತಯಾರಿಸಲು ಹೇರಳವಾಗಿ ಉಪಯೋಗಿಸಲಾಗುತ್ತದೆ.
ಮರಳು ಮತ್ತು ಆಂಥ್ರಸೈಟ್ ಅಥವಾ ಕೋಕುಗಳ ಮಿಶ್ರಣವನ್ನು ವಿದ್ಯುಚ್ಚಾಪ ಒಲೆಯೊಂದರಲ್ಲಿ ದೀರ್ಘಕಾಲ ೩೫೦೦೦ ಸೆ. ಉಷ್ಣತೆಯಲ್ಲಿ ಕಾಸಿದಾಗ ಕೃತಕ ಗ್ರಾಫೈಟ್ ದೊರೆಯುತ್ತದೆ. ಈ ಬಗೆಯ ಗ್ರಾಫೈಟ್ ಕಲ್ಮಷಗಳಿಲ್ಲದೇ ಸ್ವಚ್ಛವಾಗಿರುತ್ತದಾದರೂ ಇದರ ಬೆಲೆ ಹೆಚ್ಚಾದ್ದರಿಂದ ಸೀಸದ ಕಡ್ಡಿಗಳಿಗೆ ಉಪಯೋಗಿಸುವುದಿಲ್ಲ. ಎಲೆಕ್ಟ್ರೋಡ್ಸ್, ಶುಷ್ಕಕೋಶಗಳು (ಡ್ರೈಸೆಲ್ಸ್), ಘರ್ಷಣ ಕ್ಷೀಣಕಾರಿಗಳು, ವಿದ್ಯುತ್ಕೂರ್ಚಗಳು (ಬ್ರಷ್ ಆಫ್ ಎಲೆಕ್ಟ್ರಿಕ್ ಮೋಟಾರ್ಸ್ ಆರ್ ಜನರೇಟರ್ಸ್) ಇವುಗಳ ತಯಾರಿಕೆಗಳಲ್ಲಿ ಉಪಯೋಗಿಸುತ್ತಾರೆ.
ಅಸ್ಫಟಿಕ ಇಂಗಾಲ
ಕಲ್ಲಿದ್ದಲ ಕಿಟ್ಟ ಅಥವಾ ಕೋಕ್, ಇದ್ದಲುಗಳು ಮತ್ತು ಮಸಿ ಕಪ್ಪುಗಳು ಅಸ್ಫಟಿಕ ಇಂಗಾಲದ ಗುಂಪಿಗೆ ಸೇರುತ್ತವೆ. ಸಸ್ಯಜನ್ಯ ಮತ್ತು ಪ್ರಾಣಿಜನ್ಯ ಇಂಗಾಲಪೂರಿತ (ಕಾರ್ಬನೇಶಿಯಸ್) ವಸ್ತುಗಳನ್ನು ಕಡಿಮೆ ಗಾಳಿಯಲ್ಲಿ ದಹಿಸಿದಾಗ ದೊರೆಯುವುದೇ ಇದ್ದಲು. ಮರಗಿಡಗಳನ್ನು ದಹಿಸಿ ತಯಾರಿಸಿದ ಇದ್ದಲನ್ನು ಉರುವಲಾಗಿ ಉಪಯೋಗಿಸುತ್ತೇವೆ. ಸಾಮಾನ್ಯವಾಗಿ ದೊರೆಯುವ ಮರದ ಇದ್ದಲು ಕಪ್ಪು, ಪೆಡಸು (ಬ್ರಿಟಲ್) ಮತ್ತು ಮರದ ಆಕಾರದಲ್ಲಿಯೇ ಇರುತ್ತದೆ. ಇದು ಸಚ್ಛಿದ್ರವಾಗಿದ್ದು ರಂಧ್ರಗಳಲ್ಲಿ ಗಾಳಿಯನ್ನು ತುಂಬಿಕೊಂಡಿರುತ್ತದೆ. ಸಚ್ಛಿದ್ರವಾಗಿರುವುದರಿಂದ ಇತರ ಅನಿಲಗಳನ್ನು ಹೀರಿಕೊಳ್ಳುವ ಶಕ್ತಿಯೂ ಇದೆ. ಪ್ರಾಣಿಗಳ ಮೂಳೆ, ರಕ್ತಗಳು ವಿರಳ ವಾತಾವರಣದಲ್ಲಿ ದಹಿಸಿದಾಗ ಪ್ರಾಣಿಜನ್ಯ ಇದ್ದಲು ದೊರೆಯುತ್ತದೆ. ಇದು ಮರದ ಇದ್ದಲಿಗಿಂತಲೂ ಹೆಚ್ಚು ಸಚ್ಛಿದ್ರವಾಗಿರುವುದರಿಂದ ಅದಕ್ಕಿಂತಲೂ ಹೆಚ್ಚು ಅನಿಲಗಳನ್ನು ಹೀರಿಕೊಳ್ಳಬಲ್ಲುದು. ಮೂಳೆಯ ಇದ್ದಲು ಅನಿಲಗಳನ್ನು ಮಾತ್ರವಲ್ಲದೆ ದ್ರಾವಣಗಳಿಂದ ಅನೇಕ ಸಂಯುಕ್ತಗಳನ್ನು ಹೀರಿಕೊಳ್ಳಬಲ್ಲ ಪಟುತ್ವ ಪಡೆದಿದೆ.
ಖನಿಜವಾಗಿ ದೊರೆಯುವ ಕಲ್ಲಿದ್ದಲಿನ ಮುಖ್ಯ ಭಾಗ ಇಂಗಾಲ.[೪] ಹಲವು ಆಂಥ್ರಸೈಟ್ ಖನಿಜಗಳಲ್ಲಿ ೯೦%ಕ್ಕೂ ಮೀರಿ ಇಂಗಾಲವಿದೆ.[೫] ನೆಲದಲ್ಲಿ ಲಕ್ಷಾಂತರ ವರ್ಷಗಳ ಹಿಂದೆ ಹೂತು ಹೋದ ಮರಗಿಡಗಳು ನಿಧಾನವಾಗಿ ರಾಸಾಯನಿಕ ವಿಭಜನೆಗೆ ಒಳಗಾದುದರ ಪರಿಣಾಮವೇ ಕಲ್ಲಿದ್ದಲು. ವಿಭಜನೆಯ ಹಲವಾರು ಹಂತಗಳ ಅನಂತರ ದೊರೆಯುವುದು ಹೆಚ್ಚು ಇಂಗಾಲವಿರುವ ಆಂಥ್ರಸೈಟ್. ಯಾವ ಬಗೆಯ ಕಲ್ಲಿದ್ದಲನ್ನೇ ಆಗಲಿ ಗಾಳಿಯ ಸಂಪರ್ಕವಿಲ್ಲದಂತೆ ದಹಿಸಿದಾಗ ಅಥವಾ ಬಟ್ಟಿಯಿಳಿಸಿದಾಗ ಅದರಲ್ಲಿ ಸೆರೆಯಾಗಿರುವ ಇಂಗಾಲ ಸಂಯುಕ್ತಗಳು ಮತ್ತು ಅನಿಲಗಳು ಬಿಡುಗಡೆಯಾಗಿ ಸಾಕಷ್ಟು ಶುದ್ಧವಾದ ಇಂಗಾಲ ಮಾತ್ರ ಉಳಿಯುತ್ತದೆ. ಇದೇ ಕಲ್ಲಿದ್ದಲ ಕಿಟ್ಟ ಅಥವಾ ಕೋಕ್. ಕಲ್ಲಿದ್ದಲು, ಕೋಕುಗಳು ಹೆಚ್ಚು ಉಷ್ಣ ಕೊಡುವ ಉತ್ತಮ ಉರುವಲುಗಳು. ಕೋಕ್ ಸಾಂದ್ರೀಕರಿಸಿದ ಇಂಗಾಲವಾದ್ದರಿಂದ ಇದನ್ನು ಲೋಹ ವಿದ್ಯೆಯಲ್ಲಿ ಲೋಹದ ಆಕ್ಸೈಡುಗಳನ್ನು ಅಪಕರ್ಷಿಸಲೂ ಉಪಯೋಗಿಸುತ್ತಾರೆ.
ಹೈಡ್ರೊಜನ್-ಕಾರ್ಬನ್ ಸಂಯುಕ್ತಗಳನ್ನೊಳಗೊಂಡಿರುವ ಅನಿಲಗಳು ಮತ್ತು ಎಣ್ಣೆಗಳನ್ನು ವಿರಳ ವಾತಾವರಣದಲ್ಲಿ ಉರಿಸಿ ಸುಡದಿರುವ ಇಂಗಾಲವನ್ನು ಮಸಿಯಾಗಿ ಸಂಗ್ರಹಿಸಬಹುದು. ಈ ಬಗೆಯ ಮಸಿಗಳನ್ನು ಉತ್ತಮಗೊಳಿಸಲು ರಬ್ಬರಿನೊಡನೆ ಬೆರೆಸುತ್ತಾರೆ. ಸಾಕಷ್ಟು ಪ್ರಮಾಣದಲ್ಲಿ ಈ ಮಸಿಗಳನ್ನು ಮುದ್ರಣ ಮಸಿ, ಬಣ್ಣಗಳು, ಮಸಿ ಕಾಗದ, ಪಾದರಕ್ಷೆ ಮತ್ತು ಲೋಹಗಳ ಮೆರುಗುಗಳಲ್ಲಿ ಉಪಯೋಗಿಸುತ್ತಾರೆ.
ಬೆಂದ ಇಂಗಾಲ
ಯಾವುದೇ ಬಗೆಯ ಇಂಗಾಲವನ್ನು ೧೦೦೦೦-೨೦೦೦೦ ಸೆ. ಉಷ್ಣತೆಯಲ್ಲಿ ಹಲವು ಗಂಟೆಗಳ ಕಾಲ ಕಾಸಿದಾಗ ದೊರೆಯುವುದು ಬೆಂದ ಇಂಗಾಲ. ಈ ಬಗೆಯ ಇಂಗಾಲವನ್ನು ವಿದ್ಯುಚ್ಚಾಪ ಕುಲುಮೆ, ವಿದ್ಯುಚ್ಚಾಪ ದೀಪಗಳಲ್ಲಿನ ಧ್ರುವಗಳು, ಇತರ ಬಗೆಯ ವಿದ್ಯುತ್ಕುಲುಮೆಗಳ ಧ್ರುವಗಳು, ವಿದ್ಯುತ್ಕೂರ್ಚಗಳು ಮೊದಲಾದುವನ್ನು ತಯಾರಿಸಲು ಉಪಯೋಗಿಸಲಾಗುತ್ತದೆ.
Remove ads
ಪಟುಗೊಳಿಸಿದ ಇಂಗಾಲ
ಮಿತ ಪ್ರಮಾಣ ಗಾಳಿಯಲ್ಲಿ ಸೌದೆಯನ್ನು ಉರಿಸಿದರೆ ಇದ್ದಲಾಗುವುದು. ಇದು ಸರಂಧ್ರಪದಾರ್ಥ. ಅನಿಲಗಳನ್ನೂ ದ್ರಾವಣಗಳಿಂದ ವಿಲೀನ ವಸ್ತುಗಳನ್ನೂ ಸರಾಗವಾಗಿ ಹೀರಿಕೊಳ್ಳುವ ಶಕ್ತಿ ಇದಕ್ಕಿದೆ. ಅವಘೋಷಿತ ವಸ್ತುಗಳು ಇದ್ದಲಿನ ಮೈಮೇಲೆ ಶೇಖರಿಸುತ್ತವೆ. ಈ ಗ್ರಹಣ ಸಾಮರ್ಥ್ಯವನ್ನು ಕೃತಕ ವಿಧಾನಗಳಿಂದ ಹೆಚ್ಚಿಸಬಹುದು. ಹೀಗೆ ಕಾಯಕಲ್ಪ ಹೊಂದಿದ ಇದ್ದಲಿಗೆ ಪಟುಗೊಳಿಸಿದ ಇಂಗಾಲ ಎಂದು ಹೆಸರು. ಇದರ ಮೇಲ್ಮೈ ವಿಸ್ತೀರ್ಣ ಒಂದು ಗ್ರಾಮಿಗೆ ೬೦೦-೨೦೦೦ ಚದರ ಮೀಟರುಗಳಷ್ಟು ಇರುತ್ತದೆ. ಇದು ಇದ್ದಲಿನ ರಂಧ್ರಗಳಲ್ಲಿರುವ ಸ್ಥಳಾವಕಾಶದ ಸೂಚಕವಾಗಿದೆ. ಸಾಮಾನ್ಯ ಇದ್ದಲಿನ ಮೈಗೆ ಹೈಡ್ರೊಕಾರ್ಬನ್ ಪದರಗಳು ಅಂಟಿಕೊಂಡಿರುವುವು. ಅವುಗಳನ್ನು ಉಚ್ಚಾಟಿಸಿ ಕ್ರಿಯಾಕ್ಷೇತ್ರವನ್ನು ವಿಸ್ತರಿಸಬಹುದು. ಇದೇ ಪಟುಗೊಳಿಸುವ ವಿಧಾನಗಳ ಮೂಲೋದ್ದೇಶ.
ಇಂಗಾಲವನ್ನು ಪಟುಗೊಳಿಸಲು ಇರುವ ನಾನಾ ವಿಧಾನಗಳಲ್ಲಿ ಹೆಚ್ಚು ಬಳಕೆಯಲ್ಲಿರುವ ಒಂದು ವಿಧಾನವನ್ನು ಮಾತ್ರ ಇಲ್ಲಿ ಪ್ರಸ್ತಾಪಿಸಲಾಗಿದೆ. ಇಂಗಾಲಯುಕ್ತ ಕಚ್ಚಾವಸ್ತುವನ್ನು (ತೆಂಗಿನ ಚಿಪ್ಪು, ಮರದ ಹೊಟ್ಟು ಇತ್ಯಾದಿ) ಮೊದಲು ಜಿಂಕ್ ಕ್ಲೋರೈಡು ಅಥವಾ ಫಾಸ್ಫಾರಿಕ್ ಆಮ್ಲದಲ್ಲಿ ಚೆನ್ನಾಗಿ ನೆನೆಸಿ ೮೫೦೦ ಸೆ. ಉಷ್ಣತೆಗೆ ಕಾಸುವರು. ಲಭ್ಯವಾದ ಇದ್ದಲನ್ನು ತೊಳೆದರೆ ಅದಕ್ಕೆ ಅಂಟಿರುವ ಈ ರಾಸಾಯನಿಕಗಳು ನಿವಾರಣೆಯಾಗುವುವು. ಅನಂತರ ಹಬೆ ಅಥವಾ ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡಿನ ಸಂಪರ್ಕದಲ್ಲಿ ೮೫೦೦-೧೦೦೦೦ ಸೆ. ಉಷ್ಣತಾಮಿತಿಯಲ್ಲಿ ಬಿಡಲಾಗುವುದು. ಈ ಉತ್ಕರ್ಷಕ ವಾತಾವರಣದ ಫಲವಾಗಿ ಇದ್ದಲಿನ ಮೈ ಸ್ವಚ್ಛವಾಗಿ, ಮುಚ್ಚಿಹೋಗಿದ್ದ ರಂಧ್ರಗಳೂ ಕ್ರಿಯಾ ಕೇಂದ್ರಗಳಾದ ಅಸಂತೃಪ್ತ ಇಂಗಾಲದ ಪರಮಾಣುಗಳೂ ವ್ಯಕ್ತವಾಗುವುವು. ಇದ್ದಲಿನ ಮೈ ಅಲ್ಲಲ್ಲಿ ತರಚಿದಂತಾಗಿ ಹೊಸ ಅಸಂತೃಪ್ತ ಪರಮಾಣುಗಳು ಹುಟ್ಟಿಕೊಳ್ಳುವುವು. ಪರಿಣಾಮವಾಗಿ ಇದ್ದಲಿನ ವಸ್ತುಗ್ರಾಹಕ ಶಕ್ತಿ ವೃದ್ಧಿಯಾಗುವುದು.
ದರ್ಜೆಗಳು: ಪಟುಗೊಳಿಸಿದ ಇಂಗಾಲದಲ್ಲಿ ಎರಡು ಮುಖ್ಯ ದರ್ಜೆಗಳಿವೆ. ೧. ತೆಂಗಿನ ಚಿಪ್ಪು ಮುಂತಾದ ವಸ್ತುಗಳಿಂದ ತಯಾರಿಸಿದ ಗಟ್ಟಿಯಾದ ಕಾಳುಗಳ ರೂಪದಲ್ಲಿರುವ ಇಂಗಾಲ. ಇದು ಅನಿಲಗಳನ್ನು ಸರಾಗವಾಗಿ ಹೀರಿಕೊಳ್ಳುವುದರಿಂದ ಅನಿಲಗ್ರಾಹಿ ಇಂಗಾಲ ಎನಿಸಿಕೊಂಡಿದೆ. ಇದರಲ್ಲಿ ರಂಧ್ರಗಳ ಸಂಖ್ಯೆ ಹೆಚ್ಚು. ಪ್ರತಿಯೊಂದು ರಂಧ್ರದ ವ್ಯಾಸ ೨೦ ಆಂಗ್ಸ್ಟ್ರಾಮ್ ಮೀರಿರುವುದಿಲ್ಲ. ೨. ಎರಡನೆಯ ಬಗೆಯ ಇಂಗಾಲ ದ್ರಾವಣಗಳಿಂದ ಅನಗತ್ಯ ಬಣ್ಣ, ವಾಸನೆಗಳನ್ನು ಹೀರಿಕೊಳ್ಳಬಲ್ಲುದು. ಆದ್ದರಿಂದ ಇದನ್ನು ವರ್ಣಗ್ರಾಹಿ ಎಂದು ಕರೆಯುತ್ತಾರೆ. ಸಸ್ಯಾಂಗಾರ (ಪೀಟ್), ಕಂದುಕಲ್ಲಿದ್ದಲು (ಲಿಗ್ನೈಟ್) ಮತ್ತು ಮರದ ಹೊಟ್ಟು ಇದರ ತಯಾರಿಕೆಗೆ ಸೂಕ್ತ ಕಚ್ಚಾ ವಸ್ತುಗಳು. ಕಾಗದ ಕಾರ್ಖಾನೆಗಳು ವಿಸರ್ಜಿಸುವ ಪದಾರ್ಥಗಳಿಂದಲೂ ಇದನ್ನು ರೂಪಿಸಬಹುದು. ಹುಡಿಯ ರೂಪದಲ್ಲಿ ಇದು ಬಳಸಲ್ಪಡುತ್ತದೆ. ವರ್ಣಗ್ರಾಹಕ ಇಂಗಾಲ ಮೇಲೆ ಹೇಳಿದಂತೆ ಸಸ್ಯಜನ್ಯ ವಸ್ತುಗಳಿಂದ ಆಗಿರಬಹುದು; ಇಲ್ಲವೇ ಪ್ರಾಣಿಮೂಲಗಳಿಂದ ಪಡೆದುದಾಗಿರಬಹುದು. ಪ್ರಾಣಿಗಳ ಎಲುಬುಗಳಿಂದ ತಯಾರಿಸಿದ ಮೂಳೆ ಇದ್ದಲು ಇದಕ್ಕೆ ಉದಾಹರಣೆ. ಇದರಲ್ಲಿ ೯೦% ಹೈಡ್ರಾಕ್ಸಿ ಅಪಟೈಟ್ ಆಗಿದ್ದು ಉಳಿದ ಭಾಗ ಇಂಗಾಲವಾಗಿರುತ್ತದೆ.
ರಾಸಾಯನಿಕ ಮತ್ತು ಆಹಾರ ಉತ್ಪನ್ನಗಳನ್ನು ಶುದ್ಧಿ ಮಾಡಲು ಬಳಸುವ ಇಂಗಾಲದಲ್ಲಿ ನಿರವಯವಕಲ್ಮಷಗಳು ಇರಕೂಡದು. ಇದರ ಸಲುವಾಗಿ ಮೊದಲು ಖನಿಜಾಮ್ಲಗಳಿಂದ ಅನಂತರ ನೀರಿನಿಂದ ತೊಳೆಯಬೇಕು. ಉತ್ತಮ ದರ್ಜೆಯ ಪಟುಗೊಳಿಸಿದ ಇಂಗಾಲದಲ್ಲಿ ೧% ಕ್ಕಿಂತ ಹೆಚ್ಚು ದ್ರಾವ್ಯಕಲ್ಮಶಗಳು ಇರಕೂಡದು.
ಉಪಯೋಗಗಳು: ಯುದ್ಧಕಾಲದಲ್ಲಿ ಸೈನಿಕರಿಗೆ ವಿಷವಾಯು ಪ್ರಯೋಗವಾಗದಂತೆ ಕಾಪಾಡಲು ಮೊಗವಾಡಗಳನ್ನು ಧರಿಸಲೇಬೇಕೆಂಬ ನಿಯಮವಿದೆ. ಅಂಥ ಮೊಗವಾಡಗಳಲ್ಲಿ ಪಟುಗೊಳಿಸಿದ ಇಂಗಾಲವಿರುತ್ತದೆ. ಅಂದರೆ ಪಟುಗೊಳಿಸಿದ ಇಂಗಾಲದ ಬಳಕೆ ಸೇನಾಕ್ಷೇತ್ರಕ್ಕೇ ಸೀಮಿತವಾಗಿಲ್ಲ. ನಾಗರಿಕ ಜನಜೀವನದಲ್ಲೂ ಅದು ನಿರ್ವಹಿಸುತ್ತಿರುವ ಜವಾಬ್ದಾರಿ ಗುರುತರವಾದುದು. ಅದಕ್ಕೆ ಅಸಂಖ್ಯಾತ ನಿದರ್ಶನಗಳನ್ನು ನೀಡಬಹುದು. ಅನೇಕ ಕೈಗಾರಿಕೆಗಳಲ್ಲಿ ಉಪಯುಕ್ತ ಲೀನಕಾರಿಗಳು ಆವಿಯ ರೂಪದಲ್ಲಿ ಕಾರ್ಖಾನೆಯ ಗಾಳಿ ಅಥವಾ ಧೂಮದಲ್ಲಿ ಬೆರೆತು ಹಾಳಾಗಿಹೋಗುವ ಸಂಭವವಿದೆ. ಅದನ್ನು ಪಾರು ಮಾಡಲು ಪಟುಗೊಳಿಸಿದ ಇಂಗಾಲದ ಪದರಗಳ ಮೂಲಕ ಹಾಯಿಸುವರು. ಆಗ ಲೀನಕಾರಿ ಹೀರಲ್ಪಡುವುದು ನಿರ್ದಿಷ್ಟ ಅವಧಿಯ ಅನಂತರ ಹಬೆಯನ್ನು ಹಾಯಿಸಿದರೆ ಅದರೊಡನೆ ಅವಶೋಷಿತ ಲೀನಕಾರಿ ಹೊರಬೀಳುವುದು. ತಣಿಸಿದಾಗ ಲೀನಕಾರಿ ಪ್ರತ್ಯೇಕವಾಗುವುದು. ಸುಮಾರು ಇದೇ ತತ್ತ್ವದ ಅನ್ವಯದಿಂದ ಪೆಟ್ರೋಲಿಯಂ ಎಣ್ಣೆಯಲ್ಲಿರುವ ಹೈಡ್ರೊಕಾರ್ಬನ್ನುಗಳನ್ನು ಬೇರ್ಪಡಿಸುವರು. ಕಿರಿಯ ಪ್ಯಾರಫಿನ್ನುಗಳ ಕುದಿಯುವ ಬಿಂದುಗಳಲ್ಲಿ ಗಣನೀಯ ಅಂತರವಿರುವುದಿಲ್ಲ. ಆದ್ದರಿಂದ ಆಂಶಿಕ ಬಾಷ್ಪೀಕರಣ ವಿಧಾನದಿಂದ ಬೇರ್ಪಡಿಸುವಂತಿಲ್ಲ. ಆದರೆ ಪಟುಗೊಳಿಸಿದ ಇಂಗಾಲ ಅವನ್ನು ಹಂತ ಹಂತವಾಗಿ ತನ್ನ ಒಲವಿಗೆ ಅನುಗುಣವಾಗಿ ಹೀರಿಕೊಳ್ಳುವುದರಿಂದ ಆಂಶಿಕ ಅವಶೋಷಣಾ ವಿಧಾನ ಅನುಕರಣಯೋಗ್ಯವಾಗಿದೆ.
ಹೈಡ್ರೊಜನ್, ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡ್, ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡ್, ಅಸಿಟಲಿನ್ ಮುಂತಾದ ಅನಿಲಗಳನ್ನು ಕಲುಷಿತಗೊಳಿಸುವ ತೈಲದ ಆವಿ ಮತ್ತು ಗಂಧಕದ ಸಂಯುಕ್ತಗಳನ್ನು ಪಟುಗೊಳಿಸಿದ ಇಂಗಾಲ ಹೀರಿಕೊಳ್ಳಬಲ್ಲದು. ಚಲನಚಿತ್ರ ಮಂದಿರಗಳು, ಉಪಾಹಾರ ಗೃಹಗಳು, ಆಡಳಿತ ಭವನಗಳು, ರೈಲುಬಂಡಿಗಳು, ವಿಮಾನಗಳು ಮುಂತಾದ ಸಾರ್ವಜನಿಕ ಸ್ಥಳಗಳಲ್ಲಿ ಗಾಳಿನಿಯಂತ್ರಣ ವ್ಯವಸ್ಥೆ ಇರುವುದಷ್ಟೆ. ಅಲ್ಲಿ ಪಟುಗೊಳಿಸಿದ ಇಂಗಾಲದ ಬಳಕೆ ಅನಿವಾರ್ಯ. ವೀನೈಲ್ ಕ್ಲೋರೈಡ್, ಕಾರ್ಬೊನಿಲ್ ಕ್ಲೋರೈಡ್ ಮತ್ತು ಸಲ್ಫ್ಯೂರಿಕ್ ಕ್ಲೋರೈಡುಗಳ ಸಂಯೋಜನೆಯಲ್ಲಿ ಹೈಡ್ರೋಜಿನೇಷನ್ ಮೊದಲಾದ ಸಾವಯವ ಕ್ರಿಯೆಗಳಲ್ಲಿ ವೇಗವರ್ಧಕಗಳಾಗಿ ಅಥವಾ ಅವುಗಳ ವಾಹಕವಾಗಿ ಅನಿಲ ಅಥವಾ ವರ್ಣಗ್ರಾಹಿ ಇಂಗಾಲದ ವಿನಿಯೋಗವಾಗುತ್ತಿದೆ.
ವರ್ಣಗ್ರಾಹಿ ಇಂಗಾಲದ ಮುಖ್ಯ ಉಪಯೋಗ ಕಚ್ಚಾ ಸಕ್ಕರೆಯ ಸಂಸ್ಕರಣದಲ್ಲಿ. ೧೯ನೆಯ ಶತಮಾನದಿಂದಲೂ ಇದಕ್ಕಾಗಿ ಮೂಳೆ ಇದ್ದಲು ಉಪಯೋಗವಾಗುತ್ತಿದೆ. ಸಕ್ಕರೆಯ ಪಾಕವನ್ನು ಇದ್ದಲಿನ ಪದರಗಳ ಮೂಲಕ ಜಿನುಗಲು ಬಿಡಲಾಗುವುದು. ಆಗ ಸಕ್ಕರೆಯಲ್ಲಿರುವ ಬಣ್ಣ ಮತ್ತು ನಿರವಯವ ವಸ್ತುಗಳು ಹೀರಲ್ಪಡುವುವು. ಸಕ್ಕರೆ ಶುಭ್ರವಾಗುವುದು. ಇದ್ದಲನ್ನು ನೀರಿನಿಂದ ತೊಳೆದು ಅದಕ್ಕೆ ಅಂಟಿರುವ ಸಕ್ಕರೆಯನ್ನೂ ಪಡೆಯಬಹುದು. ಅನಂತರ ಇದ್ದಲನ್ನು ಗೂಡುಗಳಲ್ಲಿ ಕಾಸಿ ಪುನಶ್ಚೇತನ ಗೊಳಿಸಲಾಗುವುದು. ಈಗ ಇಂಗಾಲದ ಒಂದಂಶ ಉರಿದುಹೋಗುವುದು ನಿಜ. ಆದರೆ ನಿರ್ವರ್ಣೀಕರಣ ಕೋಶಗಳಲ್ಲಿ ಅದು ಹೀರಿಕೊಂಡಿರುವ ಶರ್ಕರೇತರ ಸಾವಯವ ಇಂಗಾಲ ಈ ನಷ್ಟವನ್ನು ತುಂಬುತ್ತದೆ. ಪೌರಸ್ತ್ಯ ದೇಶಗಳಲ್ಲೂ ಇತ್ತೀಚೆಗೆ ಅಮೆರಿಕ ಸಂಯುಕ್ತ ಸಂಸ್ಥಾನಗಳಲ್ಲೂ ಸಕ್ಕರೆಯ ಸಂಸ್ಕರಣಕ್ಕೆ ಸಸ್ಯಜನ್ಯ ಇಂಗಾಲವನ್ನು ವಿಶೇಷವಾಗಿ ಬಳಸುತ್ತಿದ್ದಾರೆ. ಸಹಸ್ರಾರು ಟನ್ ಪಟುಗೊಳಿಸಿದ ಇಂಗಾಲ ಸಕ್ಕರೆ ಉದ್ಯಮದಲ್ಲಿ ಖರ್ಚಾಗುತ್ತಿದೆ.
ಸಾರ್ವಜನಿಕ ನೀರು ಸರಬರಾಜಿನ ವ್ಯವಸ್ಥೆಯಲ್ಲಿ ಸಸ್ಯಜನ್ಯ ಇಂಗಾಲದ ಬಳಕೆ ಸರ್ವಸಾಮಾನ್ಯವಾಗಿದೆ. ಜಲಮೂಲದಲ್ಲಿರುವ ಪಾಚಿಗಳು ಕೊಳೆಯುವುದರಿಂದ ಅಥವಾ ಕೈಗಾರಿಕೆಗಳು ವಿಸರ್ಜಿಸುವ ಮಲಿನ ವಸ್ತುಗಳು ಬೆರೆಯುವುದರಿಂದ ನೀರಿಗೆ ಅಹಿತ ರುಚಿ, ವಾಸನೆಗಳು ಪ್ರಾಪ್ತವಾಗುತ್ತವೆ. ಇವನ್ನು ನಿರ್ನಾಮ ಮಾಡದ ಹೊರತು ನೀರು ಪಾನಯೋಗ್ಯವಾಗಲಾರದು. ಅದಕ್ಕಾಗಿ ಪಟುಗೊಳಿಸಿದ ಇಂಗಾಲ ಬಳಸಲ್ಪಡುತ್ತದೆ. ನೀರಿನಲ್ಲಿರುವ ವಿಲಂಬಿತ ಕಶ್ಮಲಗಳು ತಳವೂರುವಂತೆ ಮಾಡಲು ಪಟಿಕವನ್ನು ಕೊಡಿಸುತ್ತೇವಷ್ಟೆ. ಆಗ ಒಂದು ಮಿಲಿಯನ್ ಭಾಗ ನೀರಿಗೆ ೨-೫ ಭಾಗದಷ್ಟು ಇಂಗಾಲ ಸೇರಿಸಿದರೆ ಸಾಕು.
ಕೈಗಾರಿಕೆಗೆ ಅಗತ್ಯವಾದ ಶುದ್ಧನೀರನ್ನು ಪಡೆಯಲೂ ಇದೇ ವಿಧಾನವನ್ನು ಅನುಸರಿಸಲಾಗುತ್ತದೆ. ದ್ರಾಕ್ಷಾರಸ ಮತ್ತು ಇತರ ಆಲ್ಕೊಹಾಲಿನ ಪಾನೀಯಗಳ ತಯಾರಿಕೆಗೆ ಅಗಾಧ ಪ್ರಮಾಣದ ನೀರಿನ ಅಗತ್ಯವುಂಟು. ಅಂಥ ನೀರು ರೋಗಾಣುರಹಿತವಾಗಿರಬೇಕು. ಆದ್ದರಿಂದ ಅದನ್ನು ಶುದ್ಧಿಮಾಡಲು ಅಧಿಕ ಪ್ರಮಾಣದಲ್ಲಿ ಕ್ಲೋರಿನ್ ಪ್ರಯೋಗಿಸಬೇಕಾಗುತ್ತದೆ. ನೀರಿನಲ್ಲಿ ಹೆಚ್ಚುವರಿ ಕ್ಲೋರಿನ್ ಉಳಿಯಬಾರದು. ಇದನ್ನು ಅವಶೋಷಿಸಲೂ ಇತರ ವಾಸನೆ ರುಚಿ ಮೂಲಗಳನ್ನು ತೊಡೆದು ಹಾಕಲೂ ಇಂಗಾಲ ನೆರವಾಗುತ್ತದೆ. ಕೊಬ್ಬು, ತೈಲ ಮೇಣ ಇತ್ಯಾದಿ ಎಸ್ಟರುಗಳು. ಗ್ಲಿಸರಾಲ್, ಗ್ಲೈಕಾಲ್ ಇತ್ಯಾದಿ ಆಲ್ಕೊಹಾಲುಗಳು, ಸಲ್ಫಾ ಸಂಯುಕ್ತಗಳು, ಜೀವಾತುಗಳು, ಜೀವನಿರೋಧಕಗಳು (ಆಂಟಿಬಯೊಟಿಕ್ಸ್) ಮುಂತಾದ ಔಷಧ ಸಾಮಗ್ರಿಗಳು, ಅಸಿಟಿಕ್, ಬೆಂಜ಼ೋಯಿಕ್, ಸಿಟ್ರಿಕ್, ಫ಼್ರ್ಯೂಮ್ಯಾರಿಕ್, ಮೆಲೇಯಿಕ್ ಮತ್ತು ಇತರ ಆಮ್ಲಗಳು, ನೈಸರ್ಗಿಕ ಮತ್ತು ಕೃತಕ ಕೆಫೀನ್ ಛಾಯಾಗ್ರಹಣದಲ್ಲಿ ಬಳಸುವ ರಾಸಾಯನಿಕಗಳು ಜೆಲಾಟಿನ್ ಪೆಕ್ಟಿನ್ ಮುಂತಾದ ಆಹಾರ ಸಾಮಗ್ರಿಗಳು, ಬಣ್ಣ ಮಧ್ಯವರ್ತಿಗಳು ಮತ್ತು ಇನ್ನೂ ಅನೇಕ ಉತ್ಪನ್ನಗಳ ಸಂಸ್ಕರಣ ಪಟುಗೊಳಿಸಿದ ಇಂಗಾಲವಿಲ್ಲದೆ ನಡೆಯುವಂತಿಲ್ಲ.
ಇತ್ತೀಚೆಗೆ ಪಟುಗೊಳಿಸಿದ ಇಂಗಾಲಕ್ಕೆ ಎರಡು ಪ್ರಮುಖ ಉಪಯೋಗಗಳು ಒದಗಿವೆ. ಹಳೆಯ ರಬ್ಬರನ್ನು ಸಂಸ್ಕರಿಸಿ ಅದರಿಂದ ತೆಳುಬಣ್ಣದ ಅಥವಾ ಬಿಳಿಯ ರಬ್ಬರಿನ ವಸ್ತುಗಳನ್ನು ಮಾಡುತ್ತಾರೆ. ಸಂಸ್ಕರಣ ಕಾಲದಲ್ಲಿ ಉಪಯೋಗಿಸಿದ ಎಣ್ಣೆಗಳು ರಬ್ಬರಿನ ಒಳಪದರಗಳಿಂದ ಹೊರಕ್ಕೆ ಹರಡಿ ಹಳದಿ ಕಲೆಗಳನ್ನುಂಟುಮಾಡಿ ವಿರೂಪಗೊಳಿಸುವುವು. ಪಟುಗೊಳಿಸಿದ ಇಂಗಾಲವನ್ನು ರಬ್ಬರಿನೊಂದಿಗೆ ಅರೆದು ಅನಂತರ ಉಪಯೋಗಿಸಿದರೆ ಈ ತೊಂದರೆ ತಪ್ಪುವುದು.
ದ್ರವವಸ್ತುಗಳನ್ನು ಬಹುಕಾಲ ದಾಸ್ತಾನುಮಾಡಿದಾಗ ಅಥವಾ ಶೈತ್ಯಗೊಳಿಸಿದಾಗ ಮಬ್ಬಾಗುವುದುಂಟು. ಆಲ್ಕೊಹಾಲ್ ಪಾನೀಯಗಳ ತಯಾರಿಕೆಯಲ್ಲಿ ಉಪಯೋಗಿಸುವ ಕೆಲವು ಸಕ್ಕರೆಗಳಿಂದಲೂ ಮತ್ತು ಪ್ರೋಟೀನುಗಳು ಒತ್ತರಿಸುವುದರಿಂದಲೂ ಹೀಗಾಗುತ್ತದೆ. ಪಟುಗೊಳಿಸಿದ ಇಂಗಾಲ ಇಂಥ ಅದ್ರಾವ್ಯ ವಸ್ತುಗಳನ್ನು ಧರಿಸಿ ದ್ರವವಸ್ತುವನ್ನು ಸ್ವಚ್ಛವಾಗಿರಿಸುತ್ತದೆ.
ಅನೇಕ ಆಕರ್ಷಕ ವ್ಯವಹಾರನಾಮಗಳಿಂದ (ಉದಾಹರಣೆ, ನ್ಯೂಚಾರ್ ಮಿಂಚಾರಾ ಫಿಲ್ಟ್ಚಾರ್ ಕಾರ್ಬೆಕ್ಸ್, ಕ್ಲಿಫ್ಚಾರ್, ಬೋನ್ಚಾರ್, H.V.W.M -ಪಟುಗೊಳಿಸಿದ ಇಂಗಾಲ, ಸೂಚಾರ್, ಇತ್ಯಾದಿ) ಮಾರುಕಟ್ಟೆಯಲ್ಲಿರುವ ಪಟುಗೊಳಿಸಿದ ಇಂಗಾಲದ ವ್ಯಾಪಕ ಬಳಕೆಯನ್ನು ಕೆಳಕಂಡ ಪಟ್ಟಿಯಲ್ಲಿ ಕ್ರೋಡೀಕರಿಸಲಾಗಿದೆ.
I ಅನಿಲ ವಸ್ತುಗಳ ಅವಶೋಷಣೆ. (i) ನೈಸರ್ಗಿಕ ಅನಿಲದಿಂದ ಪೆಟ್ರೋಲ್ ಸಂಪಾದನೆ. (ii) ಕೃತಕ ರೇಷ್ಮೆ ಮತ್ತು ಚರ್ಮ, ಶುಷ್ಕಮಾರ್ಜಕ ಲೋಹಗಳಿಂದ ಜಿಡ್ಡು ನಿವಾರಣೆ, ಪಾರಕ ಹೊದಿಕೆಗಳು ಮತ್ತು ಫಿಲ್ಮುಗಳು, ರಬ್ಬರ್ ಉತ್ಪನ್ನಗಳು, ಪ್ಲಾಸ್ಟಿಕ್ಕುಗಳು ಮುಂತಾದ ಕೈಗಾರಿಕೆಗಳಲ್ಲಿ ಆವಿಯಾಗಿ ಬಿಡುವ ಲೀನಕಾರಿಕಗಳ ಸಂಪಾದನೆ. (iii) ಹೈಡ್ರೊಜನ್, ನೈಟ್ರೊಜನ್ ಹೀಲಿಯಂ, ಅಸಿಟಲಿನ್, ಅಮೋನಿಯ, ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡ್ ಮತ್ತು ಡೈಆಕ್ಸೈಡ್ಗಳಲ್ಲಿರುವ ಕಶ್ಮಲಗಳ ನಿರ್ಮೂಲನ. (iv) ಗಾಳಿನಿಯಂತ್ರಣ ವ್ಯವಸ್ಥೆಯಲ್ಲಿ ಹುಟ್ಟುವ ಅಹಿತ ವಾಸನೆಯನ್ನು ಹೋಗಲಾಡಿಸಲು. (v) ಬೆಂಜಾಲ್ ಸಂಪಾದನೆ.
II ದ್ರವವಸ್ತುಗಳ ಶುದ್ಧೀಕರಣ. (i) ಕಬ್ಬು ಅಥವಾ ಬೀಟ್ ಸಕ್ಕರೆ, ಗ್ಲೂಕೋಸ್ ಇತ್ಯಾದಿಗಳ ಸಂಸ್ಕರಣ. (ii) ಹತ್ತಿಬೀಜದ ಎಣ್ಣೆ, ಕೊಬ್ಬರಿ ಎಣ್ಣೆ, ಹಂದಿಯ ಕೊಬ್ಬು ಮತ್ತು ಖನಿಜ ತೈಲಗಳ ಶುದ್ಧೀಕರಣ. (iii) ಜೆಲಾಟಿನ್, ವಿನಿಗಾರ್, ಪೆಕ್ಟಿನ್, ಕೊಕೊ ಎಣ್ಣೆ, ಹಣ್ಣಿನ ರಸಗಳು ಮತ್ತು ಆಲ್ಕೊಹಾಲ್ ಪಾನೀಯಗಳಿಂದ ಕಶ್ಮಲ ನಿವಾರಣೆ. (iv) ಔಷಧ ಮತ್ತು ಆಮ್ಲಗಳಾದಿಯಾಗಿ ಇತರ ರಾಸಾಯನಿಕಗಳ ಶುದ್ಧೀಕರಣ. (v) ಕುಡಿಯುವ ನೀರಿನಿಂದ ಬಣ್ಣ, ವಾಸನೆ ಮತ್ತು ರುಚಿಗಳನ್ನು ತೆಗೆಯುವುದು. (vi) ವಿದ್ಯುತ್ ಲೇಪನಕ್ಕೆ ಉಪಯೋಗಿಸಿದ ದ್ರಾವಣಗಳು ಮತ್ತು ಬಳಸಿದ ಎಣ್ಣೆಗಳಿಂದ ಕಶ್ಮಲ ನಿವಾರಣೆ. (vii) ಚಿನ್ನ, ಬೆಳ್ಳಿ, ಮುಂತಾದ ಲೋಹಗಳನ್ನು ದ್ರಾವಣದಿಂದ ಬೇರ್ಪಡಿಸುವುದು.
III ವೈದ್ಯಕೀಯದಲ್ಲಿ. (i) ದೇಹಗತವಾದ ಅನಿಲಗಳು. ನಂಜುಗಳು ಮತ್ತು ಇತರ ವಿಷಗಳನ್ನು ಹೀರಿ ಉಪಶಮನಗೊಳಿಸುವ ಇಂಗಾಲದ ಮಾತ್ರೆಗಳ ತಯಾರಿಕೆ (ಮಕ್ಕಳ ಸಲುವಾಗಿ ಪಟುಗೊಳಿಸಿದ ಇಂಗಾಲವನ್ನು ಅಳವಡಿಸಿರುವ ಬಿಸ್ಕತ್ತುಗಳು ದೊರೆಯುತ್ತವೆ). (ii) ಅವಶೋಷಿತ ಸ್ಥಿತಿಯಲ್ಲಿ ಮದ್ದನ್ನು ಪ್ರಯೋಗಿಸಬೇಕಾದ ಸಂದರ್ಭದಲ್ಲಿ. (iii) ನಾರುತ್ತಿರುವ ವ್ರಣಗಳಿಂದ ಹುಟ್ಟುವ ದುರ್ವಾಸನೆಯನ್ನು ನೀಗಲು.
(IV) ವೇಗವರ್ಧಕ ಮತ್ತು ಅದರ ವಾಹಕವಾಗಿ. (i) ಫಾಸ್ಜೀನ್ ಇತ್ಯಾದಿಗಳನ್ನು ತಯಾರಿಸುವ ಕ್ಲೋರಿನೇಷನ್ ಕ್ರಿಯೆಗಳಲ್ಲಿ. (ii) ಹೈಡ್ರೋಜಿನೇಷನ್ ಮಾಡುವಾಗ.
Remove ads
ಇಂಗಾಲದ ಸಂಯುಕ್ತಗಳು
ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡ್
ಇಂಗಾಲದ ಒಂದು ಸಂಯುಕ್ತ (CO). ಇದು ಬಣ್ಣವಿಲ್ಲದ ವಿಷಾನಿಲ.[೬] ಇದರ ವಾಸನೆಯಿಂದಲೂ ದಹಿಸಿದಾಗ ಇದು ಉರಿಯುವ ಜ್ವಾಲೆಯಿಂದಲೂ ಈ ಅನಿಲವನ್ನು ಗುರುತಿಸಬಹುದು. ೧೭೭೬ರಲ್ಲಿ ಲಾಸ್ಸೋನ್ ಸತುವಿನ ಆಕ್ಸೈಡನ್ನು ಇದ್ದಲಿನ ಜೊತೆಯಲ್ಲಿ ಕಾಸಿ ಈ ಅನಿಲವನ್ನು ಪಡೆದ. ಇದಾದ ೨೪ ವರ್ಷಗಳ ಅನಂತರ ಕ್ರೊಯಕ್ಷಾಂಕ್ ಇದರ ರಚನೆಯನ್ನು ಕಂಡುಹಿಡಿದ. ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡ್ ಕಲ್ಲಿದ್ದಲಿನ ಅನಿಲದಲ್ಲಿಯೂ ವಾಟರ್ಗ್ಯಾಸ್ ಎಂಬ ಹೈಡ್ರೊಜನ್ ಮತ್ತು ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡ್ ಮಿಶ್ರಣದಲ್ಲಿಯೂ ಪ್ರೊಡ್ಯೂಸರ್ ಗ್ಯಾಸ್ ಮತ್ತು ಊದುಕುಲುಮೆಯ (ಬ್ಲಾಸ್ಟ್ ಫರ್ನೇಸ್) ಅನಿಲ ಮುಂತಾದ ಅನಿಲ ರೂಪದಲ್ಲಿರುವ ಉರುವಲಗಳಲ್ಲಿಯೂ ವಿಶೇಷವಾಗಿರುತ್ತದೆ. ಈ ಅನಿಲ ಒಂದು ದಹ್ಯವಸ್ತು. ಇದು ಹಸಿರು ನೀಲಿ ಬಣ್ಣದ ಜ್ವಾಲೆಯಿಂದ ಉರಿದು ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡನ್ನು ಕೊಡುತ್ತದೆ. ಆಕ್ಸಿಜನ್ ಕಡಿಮೆ ಇರುವ ಪ್ರದೇಶಗಳಲ್ಲಿ ದಹನವಾಗುವ ಉರುವಲಿನಿಂದ ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡ್ ಉಂಟಾಗುವುದು.
2C+O2 → 2CO
ಕೆಲವು ಕುಲುಮೆಗಳಿಂದ ಉತ್ಪತ್ತಿಯಾಗುವ ಅನಿಲಗಳ ಜೊತೆಯಲ್ಲಿ ಮಿಶ್ರವಾಗಿಯೂ ಪೆಟ್ರೋಲು ಎಣ್ಣೆ ಬಳಸುವ ವಾಹನಗಳ ಯಂತ್ರಗಳಿಂದಲೂ ಕೆಲವು ಜ್ವಾಲಾಮುಖಿಗಳಿಂದ ಹೊರಡುವ ಅನಿಲಗಳ ಜೊತೆಯಲ್ಲಿಯೂ ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡ್ ಸೇರಿರುತ್ತದೆ.
ಸತು, ಕಬ್ಬಿಣ, ಮ್ಯಾಂಗನೀಸ್, ಆಕ್ಸೈಡುಗಳನ್ನು ಇದ್ದಲು ಅಥವಾ ಕೋಕ್ ಜೊತೆಯಲ್ಲಿ ಸೇರಿಸಿ ಕಾಸಿದಾಗ ಅಪಕರ್ಷಣದಿಂದ (ರಿಡಕ್ಷನ್) ಈ ಅನಿಲ ಉತ್ಪತ್ತಿಯಾಗುತ್ತದೆ.
ZnO + C → Zn + CO
ಇದಲ್ಲದೆ ಸುಣ್ಣಕಲ್ಲನ್ನು (CaCO3) ಇದ್ದಲು ಅಥವಾ ಸತುವಿನ ಜೊತೆಯಲ್ಲಿ ಕಾಸಿಯೂ ಇದನ್ನು ಪಡೆಯಬಹುದು.
CaCO3 + C → CaO + 2CO
ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡನ್ನು ಕಾದ ಇಂಗಾಲದ ಚೂರುಗಳ ಮೇಲೆ ಹಾಯಿಸಿದರೂ ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡ್ ಉತ್ಪತ್ತಿಯಾಗುತ್ತದೆ.
CO2 + C → 2CO
ಪ್ರಯೋಗಶಾಲೆಯಲ್ಲಿ ಈ ಅನಿಲವನ್ನು ಆಕ್ಸಾಲಿಕ್ ಆಮ್ಲದ ಹರಳುಗಳನ್ನು ಪ್ರಬಲ ಗಂಧಕಾಮ್ಲದ ಜೊತೆಯಲ್ಲಿ ಸೇರಿಸಿ ಕಾಸುವುದರಿಂದ ಉತ್ಪತ್ತಿ ಮಾಡುತ್ತಾರೆ. ಈ ಪ್ರಯೋಗದಲ್ಲಿ ಆಕ್ಸಾಲಿಕ್ ಆಮ್ಲದಲ್ಲಿರುವ ನೀರನ್ನು ಗಂಧಕಾಮ್ಲ ಹೀರಿ ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡ್ ಮತ್ತು ಡೈ ಆಕ್ಸೈಡುಗಳ ಮಿಶ್ರಣ ದೊರೆಯುತ್ತದೆ. ಇದರಲ್ಲಿರುವ ಇಂಗಾಲಾಮ್ಲವನ್ನು ಕ್ಷಾರಕದ ಸಹಾಯದಿಂದ ತೆಗೆದರೆ ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡ್ ಉಳಿಯುತ್ತದೆ. ಅನಿಲವನ್ನು ನೀರಿನ ಪಲ್ಲಟದಿಂದ ಶೇಖರಿಸಬಹುದು.
H2C2O4H2O → 2H2O + CO + CO2
ಫಾರ್ಮಿಕ್ ಆಮ್ಲವನ್ನು ಪ್ರಬಲ ಗಂಧಕಾಮ್ಲದ ಜೊತೆಯಲ್ಲಿ ಕಾಸುವಾಗ ಆ ಆಮ್ಲದ ಅಣು ನೀರಿನ ಅಣುವನ್ನು ಕಳೆದುಕೊಂಡು ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡನ್ನು ನೀಡುತ್ತದೆ.
HCOOH → H2O + CO
ಪೊಟ್ಯಾಸಿಯಂ ಫೆರೋಸಯನೈಡ್ [K4Fe(CN)6] ಹರಳುಗಳನ್ನು ಪ್ರಬಲ ಗಂಧಕಾಮ್ಲದ ಜೊತೆಯಲ್ಲಿ ಕಾಸಿದಾಗಲೂ ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡ್ ಉತ್ಪತ್ತಿಯಾಗುತ್ತದೆ.
K4Fe(CN)6 + 6H2SO4 + 6H2O → 2K2SO4 + FeSO4 + 3(NH4)2SO4 + 6CO
ಸಿಟ್ರಿಕ್ ಆಮ್ಲ, ಮ್ಯಾಲಿಕ್ ಆಮ್ಲ, ಲ್ಯಾಕ್ಟಿಕ್ ಆಮ್ಲ ಮತ್ತು ಅವುಗಳ ಲವಣಗಳನ್ನು ಪ್ರಬಲ ಗಂಧಕಾಮ್ಲದ ಜೊತೆಯಲ್ಲಿ ಕಾಸಿದಾಗಲೂ ಮೀಥೈಲ್ ಆಲ್ಕೊಹಾಲ್ (CH3OH) ಆವಿಯನ್ನು ಕಾದ ಕ್ಯುಪ್ರಿಕ್ ಆಕ್ಸೈಡು (CuO) ಮತ್ತು ಕ್ರೋಮಿಯಂ ಆಕ್ಸೈಡ್ (Cr2O3) ಅಥವಾ ಸತುವಿನ ಆಕ್ಸೈಡ್ (ZnO) ಮತ್ತು ಕ್ರೋಮಿಯಮ್ ಆಕ್ಸೈಡಿನ ಮಿಶ್ರಣದ ಮೂಲಕ ಹಾಯಿಸಿದಾಗ ಅದು ವಿಭಜನೆ ಹೊಂದಿ ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡ್ ಮತ್ತು ಹೈಡ್ರೊಜನ್ ಮಿಶ್ರಣವನ್ನು ಕೊಡುತ್ತದೆ. ಈ ಮಿಶ್ರಣದಿಂದ ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡನ್ನು ಬೇರ್ಪಡಿಸಬಹುದು. ಮೀಥೈಲ್ ಫರ್ಮೇಟ್ ಎಂಬ ಎಸ್ಟರನ್ನು ಸೋಡಿಯಮ್ ಮೀಥಾಕ್ಸೈಡು ಜೊತೆಯಲ್ಲಿ ಕಾಸಿದರೆ, ಶುದ್ಧವಾದ ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡ್ ಉತ್ಪತ್ತಿಯಾಗುತ್ತದೆ. ಕಾರ್ಬನ್ ಮಾನಾಕ್ಸೈಡ್ ಅನೇಕ ಅನಿಲಗಳ ಮಿಶ್ರಣದಲ್ಲಿ ಶೇಕಡಾವಾರು ಯಾವ ಪ್ರಮಾಣದಲ್ಲಿದೆ ಎಂಬುದನ್ನು ಕೆಳಗಿನ ಕೋಷ್ಟಕದಲ್ಲಿ ಕೊಟ್ಟಿದೆ.
ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡ್ ಇರುವ ವಾಟರ್ ಗ್ಯಾಸ್ ಮಿಶ್ರಣವನ್ನು ಮದ್ಯಸಾರಗಳ ತಯಾರಿಕೆಯಲ್ಲಿ ಬಳಸಲಾಗುತ್ತದೆ. ಈ ಮದ್ಯಸಾರಗಳಲ್ಲಿ ಮುಖ್ಯವಾದ ಈಥೈಲ್ ಆಲ್ಕೊಹಾಲ್ ಎಂಬುದು ಪೆಟ್ರೋಲ್ ಜೊತೆಯಲ್ಲಿ ಮಿಶ್ರ ಮಾಡಿ ಬಳಸುವುದಕ್ಕೆ ಯೋಗ್ಯವಾದ ಉರುವಲು.
ಪರೀಕ್ಷೆಗಳು: ಈ ಅನಿಲಕ್ಕೆ ಆಕ್ಸಿಜನ್ನನ್ನು ಹೀರುವ ಸ್ವಭಾವ ಇದೆ. ಇದರಿಂದ ಕೆಲವು ಪದಾರ್ಥಗಳೊಡನೆ ವರ್ತಿಸಿದಾಗ ಇದು ಉತ್ಪತ್ತಿಮಾಡುವ ಕಠಿಣ ರಚನೆಯುಳ್ಳ ಲವಣಗಳ ಮೂಲಕ ಅನಿಲವನ್ನು ಗುರುತಿಸಬಹುದು. ಅಮೋನಿಯ ದ್ರಾವಣದಲ್ಲಿ ಕರಗಿರುವ ಕ್ಯುಪ್ರಸ್ ಕ್ಲೋರೈಡ್ ಲವಣ ಇದನ್ನು ಬೇಗನೆ ಹೀರುವುದರಿಂದ ಬೇರೆ ಅನಿಲಗಳಿಂದ ಬೇರ್ಪಡಿಸಬಹುದು. ನೀರಿನಲ್ಲಿ ಇದು ಅತ್ಯಲ್ಪ ಪ್ರಮಾಣದಲ್ಲಿ ವಿಲೀನವಾಗುತ್ತದೆ.
ರಾಸಾಯನಿಕ ಲಕ್ಷಣಗಳು: ಸುಮಾರು ೩೦೦೦-೧೫೦೦೦ ಸೆ. ಗೆ ಕಾದ ಅನೇಕ ಲೋಹಗಳ ಆಕ್ಸೈಡುಗಳ ಮೇಲೆ ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡನ್ನು ಹಾಯಿಸಿದಾಗ ಇದು ಆಯಾ ಲೋಹಗಳನ್ನೂ ಇಂಗಾಲಾಮ್ಲವನ್ನೂ ಕೊಡುತ್ತದೆ. ಇಂಥ ಲೋಹಗಳಲ್ಲಿ ಮುಖ್ಯವಾದುವು ಕೋಬಾಲ್ಟ್, ತಾಮ್ರ, ಕಬ್ಬಿಣ, ಸೀಸ. ೫೦೦-೧೦೦೦ ಸೆ. ಗೆ ಕಾಸಿದ ನಿಕ್ಕಲ್ ಮೇಲೆ ಈ ಅನಿಲವನ್ನು ಹಾಯಿಸಿದಾಗ ಆವಿ ರೂಪದಲ್ಲಿ ನಿಕ್ಕಲ್ ಕಾರ್ಬೊನೈಲ್ [Ni(CO)4] ಉತ್ಪತ್ತಿಯಾಗುತ್ತದೆ. ಇದನ್ನು ೧೮೦೦-೨೦೦೦ ಸೆ. ಗೆ ಕಾಸಿದರೆ ನಿಕ್ಕಲ್ ಮತ್ತು ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡುಗಳು ಪುನಃ ಉತ್ಪತ್ತಿಯಾಗುತ್ತವೆ. ಇದರಿಂದ ನಿಕ್ಕಲ್ ಲೋಹವನ್ನು ಶುದ್ಧೀಕರಿಸಬಹುದು. ಕೋಬಾಲ್ಟ್, ತವರ ಮುಂತಾದ ಇತರ ಲೋಹಗಳೂ ಈ ರೀತಿಯ ಕಾರ್ಬೊನೈಲುಗಳನ್ನು ಕೊಡುತ್ತದೆ. ಕ್ಲೋರಿನ್ ಮತ್ತು ಬ್ರೋಮಿನ್ನುಗಳು ಸೂರ್ಯನ ಬೆಳಕಿನಲ್ಲಿ ಪ್ರಾಣಿಗಳ ಎಲುಬುಗಳಿಂದ ತಯಾರಿಸಬಹುದಾದ ಇದ್ದಲಿನ ವೇಗವರ್ಧಕದ ಸಂಪರ್ಕದಲ್ಲಿ ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡಿನ ಜೊತೆಯಲ್ಲಿ ವರ್ತಿಸಿ ಕಾರ್ಬೊನೈಲ್ ಕ್ಲೋರೈಡು (COCl2) ಮತ್ತು ಕಾರ್ಬೊನೈಲ್ ಬ್ರೋಮೈಡುಗಳನ್ನು (COBr2) ಉತ್ಪತ್ತಿಮಾಡುತ್ತವೆ. ಅಯೊಡೀನ್ ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡಿನ ಜೊತೆಯಲ್ಲಿ ವರ್ತಿಸುವುದಿಲ್ಲ. ಹೆಚ್ಚು ಒತ್ತಡದಲ್ಲಿ ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡನ್ನು ಸೋಡಿಯಮ್ ಹೈಡ್ರಾಕ್ಸೈಡಿನ ಮೂಲಕ ಹಾಯಿಸಿದರೆ ಸೋಡಿಯಮ್ ಫರ್ಮೇಟು ಉತ್ಪತ್ತಿಯಾಗುತ್ತದೆ. ಇದರಿಂದ ಆಕ್ಸಾಲಿಕ್ ಮತ್ತು ಫರ್ಮಿಕ್ ಆಮ್ಲಗಳನ್ನು ಪಡೆಯಬಹುದು.
ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ - (CO2)
ಬಲು ಹಿಂದಿನಿಂದ ಮಾನವನಿಗೆ ಇದರ ಪರಿಚಯವಿದೆ. ಸಾಮಾನ್ಯ ಗಾಳಿಗಿಂತ ಭಿನ್ನವಾದುದೆಂದು ಸೂಚಿಸಲು ಫಾನ್ ಹೆಲ್ಮಾಂಟ್ ಇದನ್ನು ಸಿಲ್ವೆಸ್ಟರ್ ಅನಿಲ ಎಂದು ಕರೆದ. ಖನಿಜೋದಕಗಳಲ್ಲಿದೆಯೆಂದೂ ಸಾವಯವ ವಸ್ತುಗಳು ಕೊಳೆತು ಹುಳಿಹಿಡಿದಾಗ ಮತ್ತು ಇದ್ದಲನ್ನು ಉರಿಸಿದಾಗ ಈ ಅನಿಲ ಉತ್ಪತ್ತಿಯಾಗುವುದೆಂದೂ ಆತ ಮನಗಂಡಿದ್ದ. ಅದು ದಹನಾನುಕೂಲಿಯಲ್ಲ, ಪ್ರಾಣಿಗಳಿಗೆ ಉಸಿರು ಕಟ್ಟುವಂತೆ ಮಾಡುವುದು ಎಂಬುದೂ ಅವನಿಗೆ ಗೊತ್ತಿತ್ತು. ಕಾರ್ಬೊನೇಟೆಡ್ ಕ್ಷಾರಗಳಲ್ಲಿ ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡ್ ಘನರೂಪದಲ್ಲಿ ಬಂಧಿತವಾಗಿರುವುದರಿಂದ ಅದಕ್ಕೆ ಬಂಧಿತಗಾಳಿ ಎಂದು ಹೆಸರಿಟ್ಟವ ಜೋಸೆಫ್ ಬ್ಲ್ಯಾಕ್. ಅದೊಂದು ಇಂಗಾಲದ ಆಕ್ಸೈಡೆಂದು ನಿಸ್ಸಂದೇಹವಾಗಿ ಸಾಧಿಸಿದ ಕೀರ್ತಿ ಲೆವಾಸಿಯೆಗೆ ಸಲ್ಲಬೇಕು.
ಪ್ರಸರಣ: ವಾಯುಮಂಡಲದ ಗಾತ್ರದ ೦.೦೩% ಭಾಗ ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡ್ ಆಗಿದೆ.[೭] ಇದು ಮಹತ್ತ್ವದ ವಿಷಯ; ಏಕೆಂದರೆ ಭೂಮಿಯ ಮೇಲೆ ಜೀವಧಾರಣೆ ಮತ್ತು ಪೋಷಣೆ ಇದನ್ನು ಅವಲಂಬಿಸಿಕೊಂಡು ಅವ್ಯಾಹತವಾಗಿ ನಡೆದು ಬಂದಿದೆ. ಇಂಗಾಲ ಸಂಯುಕ್ತಗಳಿಂದ ಪ್ರಾಣಿಗಳ ಮತ್ತು ಸಸ್ಯಗಳ ರಚನೆಯಾಗಿದೆ. ಇವುಗಳಿಗೆ ವಾಯುಮಂಡಲದಲ್ಲಿರುವ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡೇ ಮೂಲಾಧಾರ. ಸೂರ್ಯರಶ್ಮಿಯ ಸಂಪರ್ಕದಲ್ಲಿ ಪತ್ರಹರಿತ್ತಿನ ಸಹಾಯದಿಂದ ಸಸ್ಯಗಳು ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡ್ ಮತ್ತು ನೀರನ್ನು ಬಳಸಿಕೊಂಡು ತಮ್ಮ ಪೋಷಣೆಗೆ ಅಗತ್ಯವಾದ ಶರ್ಕರ ಪಿಷ್ಟಾದಿಗಳನ್ನು ತಯಾರಿಸಿಕೊಳ್ಳುತ್ತವೆ. ಈ ದ್ಯುತಿಸಂಶ್ಲೇಷಣಕಾರ್ಯ ನಡೆದಾಗ ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡಿನಲ್ಲಿರುವ ಆಕ್ಸಿಜನ್ ಬಿಡುಗಡೆ ಹೊಂದಿ ವಾತಾವರಣದಲ್ಲಿ ಸೇರಿಹೋಗುತ್ತದೆ. ಇಲ್ಲದಿದ್ದರೆ ವಾಯುಮಂಡಲದಲ್ಲಿರುವ ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡಿನ ಅಂಶ ಹೆಚ್ಚುತ್ತ ಹೋಗಿ ಕಾಲಕ್ರಮದಲ್ಲಿ ನಾವು ಬದುಕಿರಲು ಸಾಧ್ಯವಾಗುತ್ತಿರಲಿಲ್ಲ. ಪ್ರಾಣಿಗಳಲ್ಲಿರುವ ಇಂಗಾಲದ ಸಂಯುಕ್ತಗಳು ಸಸ್ಯಸೇವನೆಯಿಂದಲೋ ಅಥವಾ ಇತರ ಪ್ರಾಣಿಗಳನ್ನು ಭಕ್ಷಿಸಿಯೋ ಪಡೆದದ್ದು, ಉಸಿರಾಡಿದಾಗ ಅವುಗಳ ಶ್ವಾಸಕೋಶಗಳು ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡನ್ನು ಹೊರಕ್ಕೆ ಬಿಡುವುವು. ಅಲ್ಲದೆ ಗತಿಸಿದ ಪ್ರಾಣಿ ಮತ್ತು ಸಸ್ಯಗಳು ಕೊಳೆಯುವುದರಿಂದಲೂ ಈ ಅನಿಲ ಉತ್ಪತ್ತಿಯಾಗುತ್ತದೆ. ಹೀಗೆ ಪ್ರಾಣಿ ಮತ್ತು ಸಸ್ಯಗಳ ಜೀವನಕ್ರಿಯೆಗಳು ಪರಸ್ಪರ ಪೂರಕವಾಗಿರುವುದರಿಂದ ವಾಯುಮಂಡಲದಲ್ಲಿರುವ ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡಿನ ಅಂಶ ಕನಿಷ್ಟಮಟ್ಟಕ್ಕೆ ಸೀಮಿತವಾಗಿ ಭೂಮಿಯ ಮೇಲೆ ಜೀವಪೋಷಣೆ ಮುಂದುವರಿಯುತ್ತಿದೆ.
ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡ್ ನೀರಿನಲ್ಲಿ ಅಲ್ಪದ್ರಾವ್ಯ. ಕೆಲವು ಜಲಚರಗಳ ಮೈಮೇಲಿನ ಚಿಪ್ಪು ಇಂಥ ವಿಲೀನ ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡಿನಿಂದ ಆದುದು. ಅದು ರಾಸಾಯನಿಕವಾಗಿ ಕ್ಯಾಲ್ಸಿಯಂ ಕಾರ್ಬೊನೇಟ್. ಇದೇ ರೀತಿ ವಾಯುಮಂಡಲದ ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡ್ನ ಒಂದು ಭಾಗ ಜಗತ್ತಿನಲ್ಲಿ ಅಲ್ಲಲ್ಲಿ ದೊರೆಯುವ ಸುಣ್ಣಕಲ್ಲು, ಚಾಕ್, ಅಮೃತಶಿಲೆ, ಡಾಲೊಮೈಟ್, ಮ್ಯಾಗ್ನಸೈಟ್ ಇತ್ಯಾದಿ ಕಾರ್ಬೊನೇಟ್ ನಿಕ್ಷೇಪಗಳಲ್ಲಿ ಶಾಶ್ವತವಾಗಿ ಹಂಚಿಹೋಗಿದೆ. ಈ ಪರಿವರ್ತನೆ ಇಂದಿಗೂ ನಡೆಯುತ್ತಿದೆ. ಏತನ್ಮಧ್ಯೆ ಕಲ್ಲಿದ್ದಲು ಮತ್ತು ಪೆಟ್ರೋಲಿಯಂ ಉತ್ಪನ್ನಗಳ ದಹನದಿಂದ ಹೊರಬಿದ್ದ ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡ್ ಈ ಕೊರತೆಯನ್ನು ತುಂಬುತ್ತಿದ್ದು ವಾತಾವರಣದಲ್ಲಿ CO2 ಪ್ರಮಾಣ ನಿಯತಗೊಂಡಿದೆ. ಕೆಲವು ವೇಳೆ ಭೂಮಿಯಲ್ಲಿ ಬಿರುಕುಗಳು ಉಂಟಾಗಿ ಅದರಿಂದ CO2 ಹೊರಸೂಸುವ ನಿದರ್ಶನಗಳಿವೆ. ಗಾಳಿಗಿಂತ ಸುಮಾರು ಒಂದೂವರೆಯಷ್ಟು ಭಾರವಾದ್ದರಿಂದ ಅದು ಪಾಳು ಬಾವಿಗಳಲ್ಲಿ, ಜ್ವಾಲಾಮುಖಿ ಮತ್ತು ಸುಣ್ಣದ ಗೂಡುಗಳ ಬಳಿ ಇರುವ ತಗ್ಗು ಪ್ರದೇಶಗಳಲ್ಲಿ ಬೇಗ ಶೇಖರಿಸುತ್ತದೆ. ಜಾವಾ ದ್ವೀಪದಲ್ಲಿ ಸಾವಿನ ಕಣಿವೆ ಎಂದು ಸುಪ್ರಸಿದ್ಧವಾದ ಪ್ರದೇಶವಿದೆ. ಇಲ್ಲಿ ಸಂಗ್ರಹವಾದ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡಿನಿಂದ ಉಸಿರುಕಟ್ಟಿ ಪ್ರಾಣಬಿಟ್ಟ ಅಸಂಖ್ಯಾತ ಮನುಷ್ಯರ ಮತ್ತು ಪಶುಪಕ್ಷಿಗಳ ಅಸ್ಥಿಪಂಜರಗಳನ್ನು ಎಲ್ಲೆಲ್ಲೂ ಕಾಣಬಹುದೆಂದು ಪ್ರವಾಸಿಗಳ ವರದಿಗಳಿಂದ ಗೊತ್ತಾಗಿದೆ. ನೇಪಲ್ಸ್ ನಗರದ ಬಳಿ ಒಂದು ಗುಹೆಯಿದೆ. ಅದರಲ್ಲಿ ನೆಲದಿಂದ ೧೮” ಎತ್ತರದಷ್ಟು ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡಿನ ಪದರವಿದೆ. ಆ ಗುಹೆಯನ್ನು ಹೊಕ್ಕ ನಾಯಿಗಳಿಗೆ ಮಾತ್ರ ಇದು ಮಾರಕವಾಗಿ ಅವನ್ನು ಒಯ್ದ ಮನುಷ್ಯರು ಸುರಕ್ಷಿತವಾಗಿ ಈಚೆಗೆ ಬಂದ ಉಲ್ಲೇಖವಿದೆ.
ತಯಾರಿಕೆ: ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡಿನ ದ್ರವವನ್ನು ಉಕ್ಕಿನ ಉರುಳೆಗಳಲ್ಲಿ (ಸಿಲಿಂಡರು) ಕೂಡಿಟ್ಟಿರುತ್ತಾರೆ. ತುರ್ತು ಸಂದರ್ಭದಲ್ಲಿ ಇದನ್ನು ಉಪಯೋಗಿಸುವರು. ಸಾಮಾನ್ಯವಾಗಿ ಪ್ರಯೋಗಶಾಲೆಯಲ್ಲಿ ಕಿಪ್ಪನ ಉಪಕರಣದಲ್ಲಿ ಅಮೃತಶಿಲೆಯ ಚೂರುಗಳು ದುರ್ಬಲ ಹೈಡ್ರೊಕ್ಲೋರಿಕ್ ಆಮ್ಲದೊಡನೆ ವರ್ತಿಸುವಂತೆ ಮಾಡಿ ಅನಿಲವನ್ನು ಪಡೆಯುವುದು ರೂಢಿ. ಈ ರಾಸಾಯನಿಕ ಕ್ರಿಯೆಯನ್ನು ಕೆಳಕಂಡ ಸಮೀಕರಣದಿಂದ ಸೂಚಿಸಬಹುದು.
CaCO3 + 2HCl → CaCl2 + H2O + CO2 ↑
ಅನಿಲವನ್ನು ಶುಷ್ಕಗೊಳಿಸಲು ಪ್ರಬಲ ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲ ರಂಜಕದ ಪೆಂಟಾಕ್ಸೈಡ್ ಅಥವಾ ನಿರ್ಜಲ ಕ್ಯಾಲ್ಸಿಯಂ ಕ್ಲೋರೈಡನ್ನು ಉಪಯೋಗಿಸಬಹುದು. ಗಾಳಿಗಿಂತ ಭಾರವಾದ್ದರಿಂದ ಇದನ್ನು ಕೆಳಮುಖಸ್ಥಾನಪಲ್ಲಟದಿಂದ ಶೇಖರಿಸಬೇಕು. ಇದರ ತಯಾರಿಕೆಯಲ್ಲಿ ದುರ್ಬಲ ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲದ ಬಳಕೆ ನಿಷಿದ್ಧ; ಏಕೆಂದರೆ ಉತ್ಪನ್ನ ವಸ್ತುಗಳಲ್ಲಿ ಒಂದಾದ ಕ್ಯಾಲ್ಸಿಯಂ ಸಲ್ಫೇಟ್ ಅಲ್ಪದ್ರಾವ್ಯ. ಅದು ಉಳಿದ ಅಮೃತ ಶಿಲೆಯ ಚೂರುಗಳನ್ನು ಆವರಿಸುತ್ತದೆ. ಈ ರಕ್ಷಾಕವಚದಿಂದ ಆಮ್ಲದ ಸಂಪರ್ಕ ತಪ್ಪಿ ಕ್ರಿಯೆ ಸ್ಥಗಿತಗೊಳ್ಳುತ್ತದೆ. ಸೋಡಿಯಂ ಬೈಕಾರ್ಬೊನೇಟನ್ನು ಕಾಸಿಯೂ ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡನ್ನು ಪಡೆಯಬಹುದು.
2NaHCO3 → Na2CO3 + H2O + CO2↑
ಕೈಗಾರಿಕಾ ಮಹತ್ತ್ವವುಳ್ಳ ಅನಿಲಗಳ ಪೈಕಿ CO2 ಸಹ ಒಂದು. ಆದ್ದರಿಂದ ದೊಡ್ಡ ಪ್ರಮಾಣದಲ್ಲಿ ಇದನ್ನು ತಯಾರಿಸುವ ಅಗತ್ಯವಿದೆ. ಅದಕ್ಕಾಗಿ ಅನುಸರಿಸುವ ವಿಧಾನಗಳು ಹಲವು. ಸುಣ್ಣಕಲ್ಲನ್ನು ಸುಟ್ಟಾಗ ಅಗಾಧ ಪ್ರಮಾಣದಲ್ಲಿ CO2 ದೊರೆಯುತ್ತದೆ.
CaCO3 → CaO + CO2
ಕೋಕ್ ದಹನದಿಂದ ಉಂಟಾದ ಅನಿಲಮಿಶ್ರಣದಲ್ಲಿ CO2 ಅಂಶವೇ ಹೆಚ್ಚು. ಅದನ್ನು ಪೊಟ್ಯಾಸಿಯಂ ಕಾರ್ಬೊನೇಟ್ ದ್ರಾವಣ ಸಿಂಪಡಿಸುವ ಕೋಶದ ಮೂಲಕ ಹಾಯಿಸಿದಾಗ ಪೊಟ್ಯಾಸಿಯಂ ಬೈಕಾರ್ಬೊನೇಟ್ ಆಗಿ ಪರಿವರ್ತಿತವಾಗುವುದು. ಈ ದ್ರಾವಣದ ಮೂಲಕ ಮತ್ತೊಮ್ಮೆ ಬಿಸಿಯಾದ ಅನಿಲಮಿಶ್ರಣವನ್ನು ಹಾಯಿಸಿದರೆ ಅದರ ಉಷ್ಣದಿಂದ ಬೈಕಾರ್ಬೊನೇಟು ವಿಭಜಿಸಿ ಪುನಃ ಕಾರ್ಬೊನೇಟಾಗುತ್ತದೆ. ಇದು ಹಿಂದಿನಂತೆ ಮತ್ತೆ ವಿನಿಯೋಗವಾಗುತ್ತದೆ. ಬಿಡುಗಡೆಯಾದ CO2 ನ್ನು ನಿರ್ಜಲ ಕ್ಯಾಲ್ಸಿಯಂ ಕ್ಲೋರೈಡಿನಿಂದ ಶುಷ್ಕಗೊಳಿಸಿ ಸಾಮಾನ್ಯ ಉಷ್ಣದಲ್ಲಿ ೧೦೦ ವಾಯುಭಾರ (ಅಟ್ಮಾಸ್ಫಿಯರ್) ಒತ್ತಡಕ್ಕೆ ಒಳಪಡಿಸಿದರೆ ದ್ರವರೂಪ ತಳೆಯುವುದು. ದ್ರವಿತ ಅನಿಲವನ್ನು ಉಕ್ಕಿನ ಉರುಳೆಗಳಲ್ಲಿ ತುಂಬಿ ಮಾರುಕಟ್ಟೆಗೆ ಕಳುಹಿಸಲಾಗುವುದು.
ಸಕ್ಕರೆಯ ಅಂಶವಿರುವ ವಸ್ತುಗಳು ಯೀಸ್ಟ್ ಸಸ್ಯದ ಸಂಪರ್ಕದಲ್ಲಿ ಹುಳಿತು ಆಲ್ಕೊಹಾಲನ್ನು ಕೊಡುತ್ತವೆ. ಆಗ ಗಣನೀಯ ಪ್ರಮಾಣದಲ್ಲಿ CO2 ಲಭಿಸುತ್ತದೆ. ಸಾಮಾನ್ಯವಾಗಿ ಕಬ್ಬಿನ ರಸದಲ್ಲಿರುವ ಸಕ್ಕರೆಯಲ್ಲಿ ಸ್ಫಟಿಕೀಕರಿಸುವುದಿಲ್ಲ. ಹೀಗೆ ಹರಳುರೂಪಕ್ಕೆ ಬಾರದಿರುವ ಸಕ್ಕರೆಯನ್ನು ಕಾಕಂಬಿ ಎನ್ನುವರು. ಯೀಸ್ಟಿನಲ್ಲಿರುವ ಕಿಣ್ವಗಳು ಇದನ್ನು ಆಲ್ಕೊಹಾಲ್ ಮತ್ತು CO2ಕ್ಕೆ ಪರಿವರ್ತಿಸುವುವು. ಇಲ್ಲಿ ನಡೆಯುವ ಮೂಲಕ್ರಿಯೆಗಳನ್ನು ಕೆಳಕಂಡ ಸಮೀಕರಣಗಳು ಸೂಚಿಸುತ್ತವೆ.
C12H22O11 + H2O → 2C6H12O6
C6H12O6 → 2C2H5OH + 2CO2
ಲಭ್ಯವಾದ CO2ನ್ನು ರೈಕ್ ವಿಧಾನದಿಂದ ಶುದ್ಧಿಗೊಳಿಸಲಾಗುವುದು. ಇದಕ್ಕಾಗಿ ಅನೇಕ ಮಾರ್ಜಕಗಳನ್ನುಳ್ಳ ವ್ಯವಸ್ಥೆ ಇರುತ್ತದೆ. ಮೊದಲನೆಯ ಮಾರ್ಜಕದಲ್ಲಿ ದುರ್ಬಲ ಆಲ್ಕೊಹಾಲನ್ನು ಸಿಂಪಡಿಸಲಾಗುತ್ತದೆ. ಅನಿಲ ಹೊತ್ತು ತಂದಿರುವ ಆಲ್ಕೊಹಾಲಿನ ಅಂಶ ಇಲ್ಲಿ ಉಳಿಯುತ್ತದೆ. ನೀರನ್ನು ಚಿಮುಕಿಸುತ್ತಿರುವ ಎರಡು ಮತ್ತು ಮೂರನೆಯ ಕೋಶಗಳಲ್ಲಿ ದ್ರಾವ್ಯವಸ್ತುಗಳು ನಿವಾರಿಸಲ್ಪಡುತ್ತದೆ. ಪೊಟ್ಯಾಸಿಯಂ ಡೈಕ್ರೊಮೇಟ್ ಮಾರ್ಜಕ ಅನಿಲದೊಡನೆ ತೂರಿಬಂದಿರುವ ಆಲ್ಡಿಹೈಡುಗಳನ್ನು ಉತ್ಕರ್ಷಿಸುವುದು, ಪ್ರಬಲ ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲದ ಮಾರ್ಜಕ ಉತ್ಕರ್ಷಣವನ್ನು ಪೂರ್ಣಗೊಳಿಸಿ ಅನಿಲವನ್ನು ಶುಷ್ಕಗೊಳಿಸುವುದು. ಸೋಡಿಯಂ ಕಾರ್ಬೊನೇಟ್ ಮಾರ್ಜಕ ಆಮ್ಲದ ತುಂತುರುಗಳನ್ನು ತೊಡೆದು ಹಾಕುವುದು. ಗ್ಲಿಸರಾಲ್ ಮಾರ್ಜಕ ಉತ್ಕರ್ಷಿತ ಉತ್ಪನ್ನಗಳನ್ನು ಹೀರಿಕೊಳ್ಳುವುದು. ಅನಂತರ ಶುದ್ಧವಾದ ಅನಿಲವನ್ನು ಒತ್ತಡದಲ್ಲಿ ಉಕ್ಕಿನ ಉರುಳೆಗಳಿಗೆ ತುಂಬಲಾಗುವುದು.
ಅಮೆರಿಕ ಸಂಯುಕ್ತ ಸಂಸ್ಥಾನಗಳ ಕೆಲವೆಡೆಗಳಲ್ಲಿ ಭೂಮಿಯಲ್ಲಿರುವ ಬಿರುಕುಗಳಿಂದ ನೈಸರ್ಗಿಕ ಅನಿಲ ಹೊರಹೊಮ್ಮುತ್ತದೆ. ಅದರಲ್ಲಿರುವ ಮುಖ್ಯಾಂಶ ಮೀಥೇನ್. ಅದನ್ನು ಹಬೆಯೊಡನೆ ಬೆರೆಸಿ ಮಿಶ್ರಣವನ್ನು ೧೦೦೦೦ ಸೆ. ಉಷ್ಣತೆಯಲ್ಲಿ ನಿಕ್ಕಲ್ ವೇಗವರ್ಧಕದ ಮೇಲೆ ಹಾಯಿಸಿದರೆ ಕೆಳಕಂಡ ರಾಸಾಯನಿಕ ಕ್ರಿಯೆಗಳು ನಡೆಯುವುವು.
CH4 + H2O → CO + 3H2
CH4 + 2H2O → CO2 + 4H2
ದೊರೆತ ಅನಿಲಮಿಶ್ರಣಕ್ಕೆ ಮತ್ತಷ್ಟು ಹಬೆಯನ್ನು ಸೇರಿಸಿ ಕಬ್ಬಿಣದ ಆಕ್ಸೈಡಿನ ಮೇಲೆ ಹಾಯಿಸಿದರೆ ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡ್ ಡೈ ಆಕ್ಸೈಡ್ ಆಗುವುದು. ಒತ್ತಡ ಹೇರಿ ನೀರಿನ ಮೂಲಕ ಹಾಯಿಸಿದರೆ ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡ್ ಮಾತ್ರ ವಿಲೀನವಾಗುವುದು. ಸಾಕಷ್ಟು ಅನಿಲ ಈ ರೀತಿ ದೊರೆಯುವುದು.
ಗುಣಗಳು: ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ ಅಸ್ಪಷ್ಟವಾಸನೆ, ರುಚಿ ಇರುವ ಮತ್ತು ಬಣ್ಣವಿಲ್ಲದ ಅನಿಲ. ವಿಷವಾಯುವಲ್ಲ. ಅದರ ಸೇವನೆಯಿಂದ ರಕ್ತದಲ್ಲಿ ಆಕ್ಸಿಜನ್ನಿನ ಕೊರತೆಯಾಗುತ್ತದೆ. ಕಾಲಕ್ರಮದಲ್ಲಿ ಗಂಭೀರ ಪರಿಣಾಮವಾಗಿ ಸಾವು ಸಂಭವಿಸಬಹುದು. ಆದ್ದರಿಂದ ಎಚ್ಚರಿಕೆಯಿಂದ ಇರುವುದು ಒಳಿತು. ಗಾಳಿಯಲ್ಲಿ ೨%-೩% ಅನಿಲವಿದ್ದರೆ ಬಾಧಕವಿಲ್ಲ. ೫%-೬% ಇದ್ದರೆ ನಾಡಿಯ ಬಡಿತ ತೀವ್ರವಾಗಿ ಏದುಸಿರು ಬರುವುದು. ೧೦% ರಷ್ಟಿದ್ದರೆ ಈ ಸ್ಥಿತಿ ಉಲ್ಬಣಗೊಳ್ಳುವುದು. ಈ ಮಿತಿ ಮೀರಿದರೆ ಪ್ರಜ್ಞೆ ತಪ್ಪುವುದು. ೨೫% ಅನಿಲವಿರುವ ಗಾಳಿಯಲ್ಲಿ ಕೆಲವು ಗಂಟೆಗಳ ಕಾಲ ಇದ್ದರೆ ಮರಣ ಅನಿವಾರ್ಯ.
ಸಾಮಾನ್ಯ ಪರಿಸ್ಥಿತಿಯಲ್ಲಿ ನೀರು ತನ್ನ ಸಮಾನಗಾತ್ರ ಅನಿಲವನ್ನು ವಿಲೀನ ಮಾಡಿಕೊಳ್ಳಬಲ್ಲುದು. ಆದರೆ ಒತ್ತಡಕ್ಕೆ ಗುರಿಪಡಿಸಿದರೆ ಹೆಚ್ಚು ಅನಿಲ ದ್ರಾವ್ಯವಾಗುತ್ತದೆ. ಸೋಡಾ ಮತ್ತು ಇತರ ಪಾನೀಯಗಳ ತಯಾರಿಕೆಯಲ್ಲಿ ಈ ತತ್ತ್ವವನ್ನು ಅವಲಂಬಿಸಿದೆ. ಚದರ ಅಂಗುಲವೊಂದಕ್ಕೆ ೬೦-೧೫೦ ಪೌಂಡುಗಳ ಒತ್ತಡ ಹೇರಿ ಇಂಥ ಅನಿಲಯುಕ್ತ ಪಾನೀಯಗಳನ್ನು ತಯಾರಿಸುತ್ತಾರೆ. ಸೋಡಾ ಸೀಸೆಯನ್ನು ತೆರೆದಾಗ ಒತ್ತಡ ಕಡಿಮೆಯಾಗಿ ಹುದುಗಿದ್ದ ಅನಿಲ ಹೊರಚೆಲ್ಲುವುದು, ತತ್ಫಲವಾಗಿ ದ್ರಾವಣ ನೊರೆನೊರೆಯಾಗಿ ಆಕರ್ಷಕವಾಗಿ ತೋರುವುದು.
ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡನ್ನು ದ್ರವೀಕರಿಸುವುದು ಸುಲಭ. ಅದನ್ನು ದ್ರವರೂಪದಲ್ಲಿ ಪಡೆದವರ ಪೈಕಿ ಫ್ಯಾರಡೆ ಮೊದಲಿಗ (೧೮೨೩). ಕೈಗಾರಿಕಾ ಪ್ರಮಾಣದಲ್ಲಿ ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡನ್ನು ದ್ರವೀಕರಿಸಲು ಬೇಕಾದ ಒತ್ತಡ ಅನಿಲದ ಉಷ್ಣತೆಗೆ ಅನುಗುಣವಾಗಿರುತ್ತದೆ. ಉದಾಹರಣೆಗೆ-೫೦ ಸೆ.ನಲ್ಲಿ ೩೦.೮ ವಾಯುಭಾರ (ಅಟ್ಮಾಸ್ಫಿಯರ್), ೫೦ ಸೆ.ನಲ್ಲಿ ೪೦.೪ ವಾಯುಭಾರ ಮತ್ತು ೧೫೦ ಸೆ. ನಲ್ಲಿ ೫೨.೧ ವಾಯುಭಾರ ಒತ್ತಡ ಅಗತ್ಯ. ೩೧.೧೦ ಸೆ. ನಲ್ಲಿ ೭೨.೮ ವಾಯುಭಾರ ಒತ್ತಡ ಹೇರಿದರೆ ಮಾತ್ರ ದ್ರವೀಕರಣ ಸಾಧ್ಯ. ಆದರೆ ಈ ಉಷ್ಣತಾಮಿತಿ ಮೀರಿದರೆ ಎಷ್ಟು ಉನ್ನತ ಒತ್ತಡಕ್ಕೂ ಅದು ಮಣಿಯುವುದಿಲ್ಲ. ಈ ಉಷ್ಣತೆಗೆ ಅದರ ಸಂಧಿಗ್ಧ ಅಥವಾ ಅವಧಿಕ (ಕ್ರಿಟಿಕಲ್) ಉಷ್ಣತೆ ಎಂದು ಹೆಸರು.
ದ್ರವಿತ ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡ್ ನಿರ್ವರ್ಣ ವಸ್ತು. ನೀರಿನೊಡನೆ ಬೆರೆಯದೆ ತೇಲುವುದು. ಒಂದು ವಾಯುಭಾರ ಒತ್ತಡದಲ್ಲಿ -೭೮.೫೦ ಸೆಂ.ಗ್ರೇಡಿನಲ್ಲಿ ಕುದಿಯುವುದು. ಅದನ್ನು ಇಟ್ಟಿರುವ ಉಕ್ಕಿನ ಉರುಳೆಯಿಂದ ಒಂದು ಕ್ಯಾನ್ವಾಸ್ ಚೀಲಕ್ಕೆ ಹರಿಯುವಂತೆ ಮಾಡಿದರೆ ದ್ರವದ ಒಂದು ಭಾಗ ಆವಿಯಾಗುವುದು. ಆಗ ಅದು ಉಳಿದ ದ್ರವದಿಂದ ಉಷ್ಣವನ್ನು ಹೀರುವುದರಿಂದ ಉಷ್ಣ ಇಳಿದು ಘನ ರೂಪಕ್ಕೆ ತಿರುಗುವುದು. ಉರುಳೆಯ ಬಾಯಿಯನ್ನು ಕೆಲವು ಮಿನಿಟ್ ಕಾಲ ತೆರೆದಿಟ್ಟರೆ ಚೀಲದಲ್ಲಿ ಸಾಕಷ್ಟು ಬಿಳಿಯ ಘನ ಕೂಡುವುದು.
ಘನರೂಪದ ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡ್ ಮಂಜುಗೆಡ್ಡೆಯಂತೆ ಇರುತ್ತದೆ. ಇದು ದ್ರವಿಸದೆ ನೇರವಾಗಿ ಆವಿಯಾಗುವುದರಿಂದ ಅದರಲ್ಲಿಟ್ಟ ಪದಾರ್ಥಗಳು ಒದ್ದೆಯಾಗುವುದಿಲ್ಲ. ಆದರೆ ೫ ವಾಯುಭಾರ ಒತ್ತಡದಲ್ಲಿ ಅದು ಕರಗುವುದು. ಸಾಮಾನ್ಯ ಒತ್ತಡದಲ್ಲಿ ಅದರೊಡನೆ ವ್ಯವಹರಿಸುವುದರಲ್ಲಿ ಅಪಾಯವಿಲ್ಲ. ಆದರೆ ಒತ್ತಡಕ್ಕೆ ಗುರಿಪಡಿಸಿದ ಘನವನ್ನು ಕೈಯಲ್ಲಿ ಹಿಡಿದರೆ ಸುಟ್ಟಾಗ ಆಗುವಂತೆ ಬೊಕ್ಕೆ ಏಳುವುದು. ಶಾಖವಾದ ಮುಂಗೈ ಮತ್ತು ಘನದ ನಡುವೆ ಇರುವ ಅನಿಲ ಪೊರೆ ಹರಿದುಹೋಗುವುದೇ ಹೀಗಾಗಲು ಕಾರಣ. ಘನೀಭವಿಸದ ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡ್ ಈಥರ್ ದ್ರವದಲ್ಲಿ ವಿಲೀನವಾಗುವುದು. ಈಥರ್ ಆವಿಯಾದಂತೆಲ್ಲ ಮಿಶ್ರಣದ ಉಷ್ಣ ಇಳಿಯುವುದು. ಸಾಮಾನ್ಯ ಒತ್ತಡದಲ್ಲಿ -೧೧೦೦ ಸೆ. ಶೈತ್ಯವೂ ಒತ್ತಡ ಇಳಿಸಿದಾಗ -೧೪೦೦ ಸೆ. ಶೈತ್ಯವೂ ಏರ್ಪಡುವುದು. ಈ ಮಿಶ್ರಣ ಉಷ್ಣವಾಹಕವಾದ್ದರಿಂದ ಶೈತ್ಯ ಮಿಶ್ರಣವಾಗಿ ಉಪಯೋಗಿಸಬಹುದು. ಇದರಲ್ಲಿ ತಣಿಸಿದ ನಾಳಗಳ ಮೂಲಕ ಹಾಯಿಸಿದಾಗ ಅನೇಕ ಅನಿಲಗಳು ದ್ರವರೂಪ ಹೊಂದುವುವು. ಈ ಮಿಶ್ರಣದಲ್ಲಿ ಪಾದರಸ ಘನೀಭವಿಸುವುದು. ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡಿನ ಘನ ಈಗ ಮಾರುಕಟ್ಟೆಯಲ್ಲೂ ದೊರೆಯುತ್ತದೆ. ಡ್ರೈಕೋಲ್ಡ್ ಎಂಬ ಹೆಸರಿನಿಂದ ಶೈತ್ಯಕಾರಕ ಯಂತ್ರಗಳಲ್ಲಿ ಬಳಕೆಯಾಗುತ್ತಿದೆ. ಬೀದಿಯಲ್ಲಿ ಐಸ್ಕ್ರೀಂ ಮಾರುವ ಚಿಲ್ಲರೆ ವ್ಯಾಪಾರಿಗಳನ್ನೂ ಬೇಗ ನಾಶವಾಗುವ ಆಹಾರ ಪದಾರ್ಥಗಳನ್ನು ಊರಿಂದೂರಿಗೆ ರೈಲಿನಲ್ಲಿ ರವಾನಿಸುವುದಕ್ಕೂ ಇದು ಸಹಕಾರಿ. ಚರ್ಮದ ಮೇಲಿರುವ ನರಹುಲಿಗಳನ್ನು ಇದರ ಸಹಾಯದಿಂದ ತೊಡೆದು ಹಾಕಬಹುದು.
ರಾಸಾಯನಿಕವಾಗಿ ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡ್ ಸ್ಥಿರವಸ್ತು, ಎಂದರೆ ಇದು ಸುಲಭವಾಗಿ ವಿಭಜಿಸುವುದಿಲ್ಲ. ಸಾಮಾನ್ಯ ಒತ್ತಡದಲ್ಲಿ ಕಾಸಿದರೆ, ೧೪೭೮೦ ಸೆ.ನಲ್ಲಿ ಕೇವಲ ೦.೩೨% ರಷ್ಟು ಅನಿಲ ವಿಭಜಿಸುವುದು; ದಹನಾನುಕೂಲಿಯಲ್ಲ. ದಹ್ಯಗುಣವೂ ಇಲ್ಲ. ಆದರೆ ಸೋಡಿಯಂ, ಪೊಟ್ಯಾಸಿಯಂ ಮತ್ತು ಮ್ಯಾಗ್ನಿಸಿಯಂನಂಥ ಕೆಲವು ಪಟುವಾದ ಲೋಹಗಳು ಅದರಲ್ಲಿ ಉರಿಯುವುವು. ಆಗ ನಡೆಯುವ ರಾಸಾಯನಿಕ ಕ್ರಿಯೆಗಳನ್ನು ಸಮೀಕರಣಗಳ ರೂಪದಲ್ಲಿ ಕೆಳಗೆ ಕೊಡಲಾಗಿದೆ.
CO2 + 2Mg → C + 2MgO
2CO2 + 2Na → CO + Na2CO3
2350 ಸೆ.
2CO2 + 2K → K2C2O4
ಪೊಟ್ಯಾಸಿಯಂ ಆಕ್ಸಲೇಟ್
ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡ್ ನೀರಿನಲ್ಲಿ ವಿಲೀನವಾದಾಗ ಅದರ ಒಂದು ಭಾಗ ನೀರಿನೊಡನೆ ಸಂಯೋಜಿಸಿ ಕಾರ್ಬಾನಿಕ್ ಆಮ್ಲವಾಗುವುದು.[೮]
H2O + CO2 → H2CO3
ಆದ್ದರಿಂದಲೇ ಶುಷ್ಕವಾದ ಅನಿಲ ಒಣಗಿದ ನೀಲಿ ಲಿಟ್ಮಸ್ ಕಾಗದದ ಬಣ್ಣವನ್ನು ಬದಲಾಯಿಸುವುದಿಲ್ಲ. ಆದರೆ ಲಿಟ್ಮಸ್ ಕಾಗದ ಒದ್ದೆಯಾಗಿದ್ದರೆ ಮಾತ್ರ ಕೆಂಪಾಗುವುದು. ಕಾರ್ಬಾನಿಕಾಮ್ಲದಿಂದ ಹೀಗಾಗುತ್ತದೆ. ಸುಣ್ಣದ ತಿಳಿನೀರಿನ ಮೂಲಕ ಅನಿಲವನ್ನು ಹಾಯಿಸಿದರೆ ಕ್ಯಾಲ್ಸಿಯಂ ಕಾರ್ಬೊನೇಟಿನ ಬಿಳಿಯ ಒತ್ತರ ಉಂಟಾಗಿ ಹಾಲಿನಂತಾಗುವುದು.
Ca(OH)2 + CO2 → CaCO3 + H2O
ಇದರ ಮೂಲಕ ಹೆಚ್ಚು ಅನಿಲ ಹಾಯಿಸಿದರೆ ಅದ್ರಾವ್ಯವಾದ ಕ್ಯಾಲ್ಷಿಯಂ ಬೈಕಾರ್ಬೊನೇಟ್ ಆಗುವುದು. ಇದು ನೀರಿನಲ್ಲಿ ದ್ರಾವ್ಯ, ಆದ್ದರಿಂದ ದ್ರಾವಣ ತಿಳಿಯಾಗುತ್ತದೆ.
CaCO3 + H2O + CO2 → Ca(HCO3)2
ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡನ್ನು ಗುರುತಿಸಲು ಇದೊಂದು ಪರಿಚಿತ ಪರೀಕ್ಷಾ ಪ್ರಯೋಗ. ಕೆಲವು ನದಿಗಳ ಪಾತ್ರದಲ್ಲಿ ಕ್ಯಾಲ್ಸಿಯಂ ಅಥವಾ ಮ್ಯಾಗ್ನಿಸಿಯಂ ಕಾರ್ಬೊನೇಟುಗಳ ನಿಕ್ಷೇಪ ಇರುವುದುಂಟು. ಆ ಸಂಯುಕ್ತಗಳು ಕ್ರಮೇಣ ಶಿಥಿಲವಾಗಿ ಸೂಕ್ಷ್ಮಕಣಗಳ ರೂಪದಲ್ಲಿ ನೀರಿನೊಡನೆ ಬೆರೆತಿರುತ್ತವೆ. ವಾಯುಮಂಡಲದ ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡಿನ ಸಂಪರ್ಕದಲ್ಲಿ ಮೇಲ್ಕಂಡ ಕ್ರಿಯೆ ನಡೆದು ಆಯಾ ಲೋಹಗಳ ಬೈಕಾರ್ಬೊನೇಟುಗಳಾಗಿ ನೀರಿನಲ್ಲಿ ಕರಗಿ ಹೋಗುತ್ತವೆ. ಪರಿಣಾಮವಾಗಿ ನೀರು ತಾತ್ಕಾಲಿಕವಾಗಿ ಗಡಸಾಗುತ್ತದೆ.
ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡನ್ನು ಅವಶೋಷಿಸಲು ಸೋಡಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡಿಗಿಂತ ಪೊಟ್ಯಾಸಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡು ಮೇಲು. ಏಕೆಂದರೆ ಪೊಟ್ಯಾಸಿಯಂ ಕಾರ್ಬೊನೇಟಿಗಿಂತ ಸೋಡಿಯಂ ಕಾರ್ಬೊನೇಟಿನ ದ್ರಾವಣತೆ ಕಡಿಮೆ. ಅದು ಬಲುಬೇಗ ಸ್ಫಟಿಕೀಕರಿಸಿ ಮಾರ್ಜಕ ಉಪಕರಣದ ನಾಳಗಳನ್ನು ಮುಚ್ಚಿಬಿಡುವುದು. ಆದ್ದರಿಂದಲೇ ಈ ಕ್ಷಾರಗಳ ದ್ರಾವಣಗಳನ್ನು ಇಟ್ಟಿರುವ ಗಾಜಿನ ಸೀಸೆಗಳಿಗೆ ರಬ್ಬರಿನ ಬಿರಡೆಗಳನ್ನು ಹಾಕಿರುವುದು. ಇಲ್ಲದಿದ್ದರೆ ವಾಯುಮಂಡಲದಿಂದ ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡು ಹೀರಲ್ಪಟ್ಟು ಒತ್ತರಿಸಿದ ಕಾರ್ಬೊನೇಟು ಸಿಮೆಂಟಿನಂತೆ ವರ್ತಿಸಿ ಗಾಜಿನ ಬಿರಡೆ ಸೀಸೆಗೆ ಭದ್ರವಾಗಿ ಅಂಟಿಕೊಂಡುಬಿಡುತ್ತದೆ.
ಗಾಳಿಯಲ್ಲಿರುವ ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡಿನ ಪ್ರಮಾಣವನ್ನು ನಿರ್ಧರಿಸಲೂ ಸಹ ಈ ಪ್ರಯೋಗವೇ ಆಧಾರ. ನಿರ್ದಿಷ್ಟಗಾತ್ರ ಗಾಳಿ ಗೊತ್ತಾದ ಗಾತ್ರ N/50 ಬೇರಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್ ದ್ರಾವಣದೊಡನೆ ನಿಕಟಸಂಪರ್ಕ ಹೊಂದುವಂತೆ ಚೆನ್ನಾಗಿ ಕುಲುಕಲಾಗುವುದು. ಶೋಧಿತ ದ್ರಾವಣದಲ್ಲಿ ಉಳಿದ ಬೇರಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್ ಇರುವುದು. ಅದನ್ನು ಗೊತ್ತಾದ ಪ್ರಬಲತೆಯುಳ್ಳ ಆಕ್ಸಾಲಿಕ್ ಅಮ್ಲದೊಡನೆ ಫೀನಾಲ್ಡ್ಥ್ಯಾಲೈನ್ ಸೂಚಕದ ನೆರವಿನಿಂದ ಅನುಮಾಪನಮಾಡಿ ನಿರ್ಣಯಿಸಲಾಗುವುದು. ಇದಕ್ಕೆ ಪೆಟ್ಟಿನ್ ಕಾಫರ್ ವಿಧಾನವೆಂದು ಹೆಸರು.
ಉಪಯೋಗಗಳು: ಸೋಡಾ ಮತ್ತು ಇತರ ಪಾನೀಯಗಳ ತಯಾರಿಕೆಯಲ್ಲಿ ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡಿನ ಬಳಕೆ ನಮಗೆ ಪರಿಚಿತವಾದುದು. ಉರಿಯನ್ನು ನಂದಿಸುವುದರಿಂದ ಇದನ್ನು ಅಗ್ನಿಶಾಮಕವಾಗಿ ಉಪಯೋಗಿಸುವರು. ಅಗ್ನಿಶಾಮಕ ಉಪಕರಣಗಳಲ್ಲಿ ನಾನಾ ವಿಧಗಳಿವೆ. ಅವುಗಳ ಪೈಕಿ ಕೆಲವನ್ನು ಮಾತ್ರ ಇಲ್ಲಿ ಸೂಚಿಸಲಾಗಿದೆ.
೧. ಒಂದು ಡಬ್ಬದ ತಳದಲ್ಲಿ ಸೋಡಿಯಂ ಬೈಕಾರ್ಬೊನೇಟಿನ ಪ್ರಬಲ ದ್ರಾವಣವಿರುತ್ತದೆ. ಅದರ ಮೇಲ್ಭಾಗದಲ್ಲಿ ದುರ್ಬಲ ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲವಿರುವ ಸೀಸೆ ಇದೆ. ಅಗತ್ಯ ಬಿದ್ದಾಗ ಸೀಸೆಯ ಬಿರಡೆಯನ್ನು ಸಡಿಲಿಸಿ ಡಬ್ಬವನ್ನು ಬೋರಲು ಹಾಕಬೇಕು. ಆಗ ಆಮ್ಲ ಬೈಕಾರ್ಬೊನೇಟಿನೊಂದಿಗೆ ವರ್ತಿಸುವುದು. ಉತ್ಪತ್ತಿಯಾದ ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡ್ ದ್ರಾವಣದೊಡನೆ ಮಿಳಿತವಾಗಿ ಡಬ್ಬದ ಪಕ್ಕದಲ್ಲಿರುವ ನಳಿಕೆಯೊಂದರ ಮೂಲಕ ಚಿಮ್ಮುವುದು. ಇದು ಬೆಂಕಿಯನ್ನು ಆವರಿಸಿ ನಂದಿಸುತ್ತದೆ.
೨. ಬುರುಗು ಅಗ್ನಿಶಾಮಕಗಳಲ್ಲಿ ಸೋಡಿಯಂ ಬೈಕಾರ್ಬೊನೇಟಿನ ದ್ರಾವಣದ ಜೊತೆಯಲ್ಲಿ ಅತಿಮಧುರದ ಬೇರಿನ ಕಷಾಯವಿರುತ್ತದೆ. ಸೀಸೆಯಲ್ಲಿ, ಆಮ್ಲದ ಬದಲು ಅಲ್ಯೂಮಿನಿಯಂ ಸಲ್ಫೇಟಿನ ದ್ರಾವಣವಿಟ್ಟಿರುತ್ತಾರೆ. ಇವೆರಡು ದ್ರಾವಣಗಳು ಬೆರೆತಾಗ ಕೆಳಕಂಡ ರಾಸಾಯನಿಕ ಕ್ರಿಯೆ ನಡೆಯತ್ತದೆ.
Al2(SO4)3 + 6NaHCO3 → 2Al(OH)3 + 3Na2SO4 + 6CO2
ಅತಿಮಧುರದ ಕಷಾಯ ಅಲ್ಯೂಮಿನಿಯಂ ಹೈಡ್ರಾಕ್ಸಿನೊಡನೆ ಬೆರೆತು ಮಂದವಾದ ದ್ರವಮಿಶ್ರಣವಾಗುತ್ತದೆ. ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡ್ ಇದನ್ನು ನೊರೆಗಟ್ಟಿಸುವುದು. ದಟ್ಟವಾದ ಬುರುಗು ಉರಿಯುತ್ತಿರುವ ವಸ್ತುವಿಗೆ ಭದ್ರವಾಗಿ ಅಂಟಿಕೊಳ್ಳುವುದು. ಆಕ್ಸಿಜನ್ನಿನ ಸಂಪರ್ಕ ಕಡಿದುಹೋಗಿ ಬೆಂಕಿ ಬಲುಬೇಗ ಹತೋಟಿಗೆ ಬರುವುದು. ಎಣ್ಣೆಗಳಿಂದ ಉದ್ಭವಿಸಿದ ಬೆಂಕಿಯನ್ನು ಆರಿಸಲು ಇದು ಬಲು ಅನುಕೂಲ.
೩. ವಿದ್ಯುತ್ಸ್ವಿಚ್ ಬೋರ್ಡಿನಲ್ಲಿ ಹುಟ್ಟಿದ ಬೆಂಕಿಯನ್ನು ಆರಿಸಲು ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡಿನ ದ್ರವ ಉಪಯೋಗಿಸುವುದು ಉತ್ತಮ. ಅದನ್ನು ಕೂಡಿಟ್ಟಿರುವ ಉರುಳೆಯ ಬಾಯಿಯನ್ನು ತೆರೆದರೆ ಉದ್ಭವಿಸುವ ಘನವಸ್ತು ತತ್ಕ್ಷಣ ಬೆಂಕಿಯನ್ನು ಶಮನಗೊಳಿಸುತ್ತದೆ.
ಶ್ವಾಸಕ್ರಿಯೆಯನ್ನು ಪ್ರಚೋದಿಸಲು ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡನ್ನು ಬಳಸುವುದುಂಟು. ೫% ಅನಿಲ ಬೆರೆತಿರುವ ಆಕ್ಸಿಜನ್ನನ್ನು ನ್ಯೂಮೋನಿಯಾ ರೋಗಿಗಳಿಗೂ ಮತ್ತು ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡನ್ನು ಸೇವಿಸಿ ತೊಂದರೆಗೀಡಾದವರಿಗೂ ಕೊಡುವುದು ಪದ್ಧತಿ. ಸಕ್ಕರೆಯ ತಯಾರಿಕೆಯಲ್ಲಿ ಬಳಸುವ ಸುಣ್ಣದ ಅಧಿಕಾಂಶವನ್ನು ತೆಗೆಯಲು ಸಾಲ್ವೆ ವಿಧಾನದಿಂದ ಸೋಡಿಯಂ ಕಾರ್ಬೊನೇಟನ್ನು ಮಾಡಲು ಬಿಳಿಯ ಲೆಡ್ ಪೆಯಿಂಟಿನ ತಯಾರಿಕೆಯಲ್ಲಿ ಪರೋಕ್ಷವಾಗಿ, ನೀರಿನ ಕೊಳಾಯಿಗಳ ಒಳಭಾಗವನ್ನು ಆವರಿಸುವ ಕಿಟ್ಟವನ್ನು ನಿರ್ಮೂಲ ಮಾಡಲು, ವಿಷವಾಯುಗಳ ವಿರುದ್ಧ ಬಳಸುವ ಮೊಗವಾಡಗಳನ್ನು ಪರೀಕ್ಷಿಸಲು, ಪ್ರಾಣಿಗಳ ಕೃಪಾವಧೆಯಲ್ಲಿ, ರಾಸಾಯನಿಕ ಕ್ರಿಯೆಗಳಲ್ಲಿ ಉತ್ಕರ್ಷಣ ನಡೆಯದಂತೆ ಜಡವಾತಾವರಣವನ್ನು ನಿರ್ಮಿಸಲು, ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡ್ ಉಪಯೋಗವಾಗುತ್ತಿದೆ. ಇದರ ರಕ್ಷಣೆಯಲ್ಲಿ ಸೇಬಿನ ಹಣ್ಣುಗಳು ಕೆಡುವುದಿಲ್ಲ. ಅದರಲ್ಲಿ ಸಂಗ್ರಹಿಸಿಟ್ಟ ಮಾಂಸ ಮತ್ತು ಇತರ ಆಹಾರ ಪದಾರ್ಥಗಳು ಸಾಗಾಣಿಕೆಯಲ್ಲಿ ಕೆಡುವುದಿಲ್ಲ, ಧಾನ್ಯದ ಹಗೇವುಗಳಲ್ಲಿ ಉಪಯೋಗಿಸಿದಾಗ ಕೀಟನಾಶಕವಾಗಿ ವರ್ತಿಸುವುದು.
ಲೋಹ ಭಾಗಗಳು ಸಂಕುಚಿತವಾಗಿ ದೃಢವಾಗಿ ಬೆಸೆದುಕೊಳ್ಳಲು ವಿಮಾನ ರಚನೆಯಲ್ಲಿ ಬಳಸುವ ಅಲ್ಯೊಮಿನಿಯಂ ಮಿಶ್ರಲೋಹಗಳ ಬಾಳಿಕೆಯನ್ನು ಹೆಚ್ಚಿಸಲು ದುರಸ್ತಿ ಅಗತ್ಯವಾದಾಗ ಕೊಳಾಯಿ ಮಾರ್ಗದಲ್ಲಿ ಹರಿಯುತ್ತಿರುವ ಅನಿಲ ಅಥವಾ ದ್ರವವಸ್ತುವನ್ನು ಸ್ಥಳೀಯವಾಗಿ ಹೆಪ್ಪುಗಟ್ಟಿಸಲು, ರಕ್ತಸಾರವನ್ನು ಹೆಪ್ಪುಗೊಳಿಸಿ ರಕ್ತವನ್ನು ಸಂರಕ್ಷಿಸಿ ಕೂಡಿಡಲು, ಘನರೂಪದ ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡ್ ವಿನಿಯೋಗವಾಗುತ್ತಿದೆ.
ಇಂಗಾಲದ ಡೈಸಲ್ಫೈಡ್
ಇದು ಇಂಗಾಲದ ಒಂದು ಸಂಯುಕ್ತ (CS2). ಇದು ಬೇಗನೆ ಆವಿ ರೂಪಕ್ಕೆ ಬರುವ ಒಂದು ದ್ರವ. ಇದರ ಸಾಂದ್ರತೆ ೦೦ ಸೆಂ. ಗ್ರೇಡಿನಲ್ಲಿ ೧.೩%. ಇದು ದಹ್ಯವಸ್ತು ಮತ್ತು ವಿಷ ಪದಾರ್ಥ. -೧೧೦೦ ಸೆಂ.ಗ್ರೇಡಿನಲ್ಲಿ ಘನೀಕರಿಸುತ್ತದೆ. ಗಂಧಕದ (ಸಲ್ಫರ್) ಪುಡಿಯನ್ನೂ ಇಂಗಾಲದ ಚೂರುಗಳನ್ನೂ (ಕೋಕ್) ವಿದ್ಯುತ್ಕುಲುಮೆಯಲ್ಲಿ ಕಾಸುವುದರಿಂದ (ಟೈಲರ್ಸ್ ಪ್ರೊಸೆಸ್) ಪಡೆಯಬಹುದು.
C + 2S → CS2
ಈ ವಿಧಾನದಲ್ಲಿ ದೊರೆಯುವ ಆವಿಯನ್ನು ತಣ್ಣಗೆ ಮಾಡಿದರೆ ಇಂಗಾಲದ ಡೈ ಸಲ್ಫೈಡು ದ್ರವರೂಪಕ್ಕೆ ಬರುತ್ತದೆ. ಇದನ್ನು ಲೆಡ್ ಅಸಿಟೇಟ್ ಲವಣದ ಸಹಾಯದಿಂದಲೂ ಪಾದರಸದ ಜೊತೆಯಲ್ಲಿ ಮಿಶ್ರ ಮಾಡುವುದರಿಂದಲೂ ಶುದ್ಧ ಮಾಡಬಹುದು. ಲಾಂಪಾಡಿಯಸ್ ೧೭೯೬ರಲ್ಲಿ ಪೆರೈಟಿಸ್ (FeS2) ಮತ್ತು ಇದ್ದಲನ್ನು ಕಾಸಿಯೂ ಇಂಗಾಲದ ಡೈ ಸಲ್ಫೈಡನ್ನು ತಯಾರಿಸಿದ. ಇದಾದ ಅನಂತರ ಫಾಸ್ಫರಸ್ ಪೆಂಟಾಕ್ಸೈಡ್ (P2O5) ಜೊತೆಯಲ್ಲೂ ಬಿಳಿಯ ಮೇಣದ ಜೊತೆಯಲ್ಲೂ ಬಟ್ಟಿ ಇಳಿಸುವುದರಿಂದ ಅತಿ ಶುದ್ಧವಾದ ಇಂಗಾಲದ ಡೈಸಲ್ಫೈಡ್ ಉತ್ಪತ್ತಿಯಾಗುತ್ತದೆ.
ಲಕ್ಷಣಗಳು: ಈ ದ್ರವ ೪೬.೨೫೦ ಸೆ. ಉಷ್ಣತೆಯಲ್ಲಿ ಆವಿರೂಪ ತಾಳುತ್ತದೆ. ಇದು ನೀರಿನ ಜೊತೆಯಲ್ಲಿ ವಿಲೀನವಾಗದು. ಮದ್ಯಸಾರ, ಈಥರ್ ಮತ್ತು ಎಣ್ಣೆಗಳ ಜೊತೆಯಲ್ಲಿ ವಿಲೀನವಾಗುತ್ತದೆ. ಇದು ಗಂಧಕ, ಬಿಳಿಯ ರಂಜಕ, ರಬ್ಬರ್, ಕರ್ಪೂರ, ಕೆಲವು ಅಂಟುಗಳು ಮುಂತಾದ ವಸ್ತುಗಳಿಗೆ ಒಳ್ಳೆಯ ದ್ರಾವಕ. ವಿಸ್ಕೊಸ್ ವಿಧಾನದಲ್ಲಿ ಕ್ಯಾಂಥೇಟ್ ಮೂಲಕ ಕೃತಕ ರೇಷ್ಮೆಯನ್ನು ತಯಾರಿಸುವಾಗ ಇದನ್ನು ಸೆಲ್ಯುಲೋಸ್ ಜೊತೆಯಲ್ಲಿ ಬಳಸುತ್ತಾರೆ. ಇದರ ಆವಿ ದುರ್ವಾಸನೆಯಿಂದ ಕೂಡಿದೆ. ಉಸಿರಾಡಿದಾಗ ಇದು ನಮಗೆ ಹಾನಿಕರ. ಇಲಿ ಮತ್ತು ಜಿರಳೆಗಳಿಗೆ ಇದು ವಿಷ ಪದಾರ್ಥ. ಇಂಗಾಲದ ಡೈ ಸಲ್ಫೈಡಿನ ಆವಿಯನ್ನೂ ಗಾಳಿಯನ್ನೂ ೨:೫ ಪ್ರಮಾಣದಲ್ಲಿ ಸೇರಿಸಿ ಬೆಂಕಿ ತಗುಲಿಸಿದರೆ, ಆ ಮಿಶ್ರಣ ಸಿಡಿದು ಗಂಧಕದ ಡೈ ಆಕ್ಸೈಡ್ (SO2), ಗಂಧಕದ ಟ್ರೈ ಆಕ್ಸೈಡ್ (SO3), ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡ್ (CO), ಇಂಗಾಲದ ಡೈ ಆಕ್ಸೈಡ್ (CO2) ಮುಂತಾದ ಅನಿಲಗಳನ್ನು ಉತ್ಪತ್ತಿ ಮಾಡುತ್ತದೆ. ಇಂಗಾಲದ ಡೈ ಸಲ್ಫೈಡಿನಿಂದ ಕಾರ್ಬನ್ ಟೆಟ್ರಕ್ಲೋರೈಡನ್ನು ತಯಾರಿಸಬಹುದು.
CS2 + 3Cl2 S2Cl2 + CCl4
(ಕು.ಬಿಂ. ೧೩೮೦ ಸೆ.) (ಕು.ಬಿಂ. ೭೭೦ ಸೆ.)
ಇಂಗಾಲದ ಡೈಸಲ್ಫೈಡಿನಿಂದ ಹೈಡ್ರೊಜನ್ ಸಲ್ಫೈಡ್ ಉತ್ಪತ್ತಿ ಮಾಡಬಹುದು. ಈ ವಿಧಾನದಲ್ಲಿ ಇಂಗಾಲದ ಡೈ ಸಲ್ಫೈಡನ್ನೂ ಹೈಡ್ರೊಜನ್ನನ್ನೂ ೪೫೦೦ ಸೆ. ಗೆ ಕಾದ ನಿಕ್ಕಲ್ ವೇಗವರ್ಧಕದ ಮೂಲಕ ಹಾಯಿಸಿದಾಗ ಹೈಡ್ರೊಜನ್ ಸಲ್ಫೈಡ್ ಉತ್ಪತ್ತಿಯಾಗುತ್ತದೆ.
CS2 + 2H2 → C + 2H2S
ನೈಟ್ರಿಕ್ ಆಕ್ಸೈಡಿನ ಪರೀಕ್ಷೆಯಲ್ಲಿ ಇಂಗಾಲದ ಡೈಸಲ್ಫೈಡನ್ನು ಬಳಸುತ್ತಾರೆ. ನೈಟ್ರಿಕ್ ಆಕ್ಸೈಡ್ ಮತ್ತು ಇಂಗಾಲದ ಡೈ ಸಲ್ಫೈಡಿನ ಮಿಶ್ರಣ ದಹಿಸಿದಾಗ ಒಂದು ನೇರಿಳೆ ಬಣ್ಣದ ಜ್ವಾಲೆಯಿಂದ ಉರಿಯುತ್ತದೆ. ಈ ರಾಸಾಯನಿಕ ಪರಿವರ್ತನೆಯಲ್ಲಿ ಇಂಗಾಲಾಮ್ಲ, ಗಂಧಕಾಮ್ಲ, ನೈಟ್ರೊಜನ್ ಅನಿಲಗಳು ಉತ್ಪತ್ತಿಯಾಗುತ್ತವೆ.
ಇಂಗಾಲದ ಟೆಟ್ರಕ್ಲೋರೈಡ್
ಇದು ಇಂಗಾಲದ ಒಂದು ಸಂಯುಕ್ತ (CCl4). ದ್ರವವಸ್ತು. ೭೬.೫ ಸೆ. ಉಷ್ಣತೆಯಲ್ಲಿ ಆವಿಯಾಗುತ್ತದೆ. ಇದು ನೀರಿಗಿಂತಲೂ ಭಾರ. ಸಾಂದ್ರತೆ ೧.೫೮ (೨೧೦ ಸೆ. ಉಷ್ಣತೆಯಲ್ಲಿ), ಕುದಿಯುವ ಇಂಗಾಲದ ಡೈ ಸಲ್ಫೈಡಿನ (CS2) ಮೂಲಕ ಅಯೊಡೀನ್ ವೇಗವಧರ್ಕದ ಜೊತೆಯಲ್ಲಿ ಕ್ಲೋರಿನನ್ನು ಹಾಯಿಸಿದರೆ ರಾಸಾಯನಿಕ ಪರಿವರ್ತನೆಯುಂಟಾಗಿ ಸಲ್ಫರ್ಕ್ಲೋರೈಡ್ (S2Cl2) ಮತ್ತು ಇಂಗಾಲದ ಟೆಟ್ರಕ್ಲೋರೈಡ್ ದ್ರವಗಳ ಮಿಶ್ರಣ ಉತ್ಪತ್ತಿಯಾಗುತ್ತದೆ.
3Cl2 + CS2 → CCl4 + S2Cl2
ಈ ರಾಸಾಯನಿಕ ಬದಲಾವಣೆಯಲ್ಲಿ ಆಂಟಿಮೊನಿ ಪೆಂಟಕ್ಲೋರೈಡನ್ನೂ (SbCl5) ಕಬ್ಬಿಣದ ಚೂರುಗಳನ್ನೂ ವೇಗವರ್ಧಕಗಳಾಗಿ ಬಳಸಬಹುದು. ಮೇಲಿನ ಬದಲಾವಣೆಯಲ್ಲಿ ಉಂಟಾಗುವ ಮಿಶ್ರಣವನ್ನು ಭಿನ್ನಬಟ್ಟಿ ಇಳಿಸಿ ಇಂಗಾಲದ ಟೆಟ್ರಕ್ಲೋರೈಡನ್ನು ಬೇರ್ಪಡಿಸಬಹುದು. ಇದರ ಜೊತೆಯಲ್ಲಿ ಬೆರೆತಿರುವ ಕ್ಲೋರಿನನ್ನು ಕ್ಷಾರಕದ ಜೊತೆಯಲ್ಲಿ ಕುದಿಸಿ ತೆಗೆಯಬಹುದು. ಈ ವಿಧಾನದಲ್ಲಿ ಇಂಗಾಲದ ಟೆಟ್ರಕ್ಲೋರೈಡ್ ಶುದ್ಧವಾಗುತ್ತದೆ. ಮೀಥೇನ್ ಅನಿಲದ (ನ್ಯಾಚುರಲ್ ಗ್ಯಾಸ್) ಮೂಲಕ ಕ್ಲೋರಿನನ್ನು ಹಾಯಿಸುವುದರಿಂದಲೂ ಇಂಗಾಲದ ಟೆಟ್ರಕ್ಲೋರೈಡನ್ನು ಪಡೆಯಬಹುದು. ಈ ರಾಸಾಯನಿಕ ಕ್ರಿಯೆಯಲ್ಲಿ ಮೀಥೇನಿನಲ್ಲಿರುವ ಎಲ್ಲ ಹೈಡ್ರೊಜನ್ ಪರಮಾಣುಗಳನ್ನು ಕ್ಲೋರಿನ್ ಪರಮಾಣುಗಳು ಪಲ್ಲಟಿಸಿ ಇಂಗಾಲದ ಟೆಟ್ರಕ್ಲೋರೈಡ್ ಉತ್ಪತ್ತಿಗೆ ಕಾರಣವಾಗುತ್ತದೆ.
CH4 + 4Cl2 → CCl4 + 4HCl
ಲಕ್ಷಣಗಳು: ಇದು ನೀರಿನೊಡನೆ ಸೇರಿದಾಗ ಜಲವಿಶ್ಲೇಷಣ ಹೊಂದುವುದಿಲ್ಲ. ಇದು ಅದಹ್ಯವಸ್ತು. ಬೆಂಕಿಯನ್ನು ಆರಿಸುವ ಶಕ್ತಿ ಇದೆ. ಈ ಕಾರಣದಿಂದ ಬೆಂಕಿಯನ್ನು ಆರಿಸುವ ಸಲಕರಣೆಗಳಲ್ಲಿ ಇದನ್ನು ಉಪಯೋಗಿಸುತ್ತಾರೆ. ಅಯೊಡೀನ್, ಬ್ರೋಮಿನ್, ಅಂಟುಗಳು, ಎಣ್ಣೆ ಮತ್ತು ಮೇದಸ್ಸುಗಳು, ಕೆಲವು ಬಣ್ಣಗಳು ಮತ್ತು ಇತರ ಕೆಲವು ವಸ್ತುಗಳಿಗೆ ಇದು ಒಳ್ಳೆಯ ದ್ರಾವಕ. ಇದನ್ನು ಕಾರ್ಬಾಲಿಕ್ ಆಮ್ಲ ಮತ್ತು ಕ್ಷಾರಕಗಳ ಜೊತೆಯಲ್ಲಿ ಕುದಿಸಿದಾಗ ಔಷಧದಲ್ಲಿ ಬಳಸುವ ಸ್ಯಾಲಿಸಿಲಿಕ್ ಆಮ್ಲ ಉತ್ಪತ್ತಿಯಾಗುತ್ತದೆ. ಕಾರ್ಬನ್ ಟೆಟ್ರಕ್ಲೋರೈಡ್ ಅಧಿಕ ಉಷ್ಣತೆಗೆ ಕಾದನೀರಿನ ಹಬೆಯ ಸಹಾಯದಿಂದ ಜಲವಿಶ್ಲೇಷಣಹೊಂದಿ ಕಾರ್ಬೊನೈಲ್ ಕ್ಲೋರೈಡನ್ನು ಉತ್ಪತ್ತಿಮಾಡುತ್ತದೆ.
CCl4 + H2O → COCl2 + 2HCl
ಇದನ್ನು ಸಾಮಾನ್ಯವಾಗಿ ಗ್ರೀಸ್ ತೆಗೆದು ರಂಜಕ ಮುಂತಾದ ಪದಾರ್ಥಗಳನ್ನು ಶುದ್ಧ ಮಾಡುವುದಕ್ಕೂ ಕ್ಲೋರೋಫಾರಂ ತಯಾರಿಕೆಗೂ ಕೊಕ್ಕೆ ಹುಳುಗಳನ್ನು ನಾಶಮಾಡುವುದಕ್ಕೆ ಔಷಧದಲ್ಲೂ ಬಳಸುವುದುಂಟು.
ಕರುಳು ಹುಳುಬೇನೆಯಲ್ಲಿ (ಹೆಲ್ಮಿಂತಿಯಾಸಿಸ್), ಲಾಡಿಹುಳು (ಟೇಪ್ವರ್ಮ್), ಕೊಕ್ಕೆಹುಳು (ಹುಕ್ವರ್ಮ್) ಕರುಳಲ್ಲಿ ವಿಪರೀತ ಸೇರಿದ್ದಾಗ ಕೊಡುವ ಮದ್ದಾಗಿತ್ತು. ಇಷ್ಟು ಅಪಾಯಕರವಲ್ಲದ ಮದ್ದುಗಳು ಬಂದಾಗಿನಿಂದ ಇದರ ಬಳಕೆ ನಿಂತಿದೆ. ಸರಕ್ಕನೆ ಆರಿಹೋಗುವುದರಿಂದ, ಉಸಿರಲ್ಲಿ ಎಳೆದುಕೊಂಡರೆ ವಿಷಕರ, ಮೊದಲೆರಡು ದಿನಗಳು ಏನೂ ಗೊತ್ತಾಗದು. ಆಮೇಲೆ ಮೂಗು, ಗಂಟಲು, ಕಣ್ಣುಗಳು ಕೆರಳಿ ಉರಿಯುತ್ತವೆ. ತಲೆನೋವು, ತಲೆತಿರುಗು, ಓಕರಿಕೆ, ಹೊಟ್ಟಶೂಲೆ, ಹಸಿವುನಾಶ, ನಿತ್ರಾಣಗಳು ಕಾಣುತ್ತವೆ. ಹೆಚ್ಚು ದಿನಗಳು ವಿಷವೇರುತ್ತಿದ್ದರೆ ಮೂತ್ರಪಿಂಡವೋ ಈಲಿಯೋ ಕೆಡುವುದುಂಟು.
Remove ads
ಉಲ್ಲೇಖಗಳು
ಗ್ರಂಥಸೂಚಿ
ಹೊರಗಿನ ಕೊಂಡಿಗಳು
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads


