ძლიერკოროზიული მინერალური მჟავა From Wikipedia, the free encyclopedia
აზოტმჟავა,აზოტის სპირტი (HNO3) — ძლიერ კოროზიული მინერალური მჟავა.
| აზოტმჟავა | |
 | |
 | |
 | |
| ზოგადი | |
|---|---|
| სისტემური სახელწოდება | აზოტმჟავა |
| ტრადიციული სახელწოდება | სამეფო წყალი, აზოტის სპირტი,Eau forte, წყალბადის ნიტრატი, Acidum nitricum |
| ფიზიკური თვისებები | |
| მდგომარეობა (სტ. პირ.) | უფერო, წითელი ან მუქი წითელი სითხე |
| სიმკვრივე | 1.5129 g cm−3 გ/სმ³ |
| თერმული თვისებები | |
| დნობის ტემპერატურა | -42 °C |
| დუღილის ტემპერატურა | 83 °C |
| თვითაალების ტემპერატურა | არააალებადი °C |
| ორთქლის წნევა | 48 mmHg (20 °C) |
| ქიმიური თვისებები | |
| ხსნადობა წყალში | განუსაზღვრელი გ/100 მლ |
| უსაფრთხოება | |
| NFPA 704 | |
| LD50 | 138 |
| კლასიფიკაცია | |
| CAS | 7697-37-2 |
| PubChem | 944 |
სუფთა სახით ნივთიერება უფეროა, მაგრამ ძველი ნიმუშები, როგორც წესი, ყვითელ შეფერილობას იღებენ, რაც ძირითადად მისი აზოტის ოქსიდებად და წყლად დაშლის გამო ხდება. კომერციულად ხელმისაწვდომი აზოტმჟავა მის 68% წყალხსნარს წარმოადგებს. როცა ხსნარი შეიცავს 86%ზე მეტ HNO3-ს, მას მბოლავი აზოტმჟავა ჰქვია. იმის მიხედვით, თუ რამდენი აზოტის დიოქსიდია მასში გახსნილი, მბოლავ აზოტმჟავას ეძახიან თეთრად მბოლავ აზოტმჟავას (WFNA) ან წითლად მბოლავ აზოტმჟავას (RFNA) (კონცენტრაცია 95%).
აზოტმჟავის ძირითადი გამოყენების სფეროა ნიტრირება — ნივთიერებისთვის (შეეხება ძირითადად ორგანული ნივთიერებებს) ნიტრო ჯგუფის დასამატებლად. ზოგიერთი მიღებული ნიტრო ნაერთები დარტყმა და თერმულად არასტაბილურია (ფეთქებადია), რამდენიმე მათგანი კი საკმაოდ მდგრადია სამხედრო და სამოქალაქო ამფეთქი ნივთიერებებისა და საღებავების საწარმოებლად. აზოტმჟავა ასევე გამოიყენება როგორც ძლიერი მჟანგავი.
კომერციული აზოტმჟავა წარმოადგენს აზეოტროპს წყალთან 68% კონცენტრაციისას. ხსნარის დუღილის ტემპერატურა 1 ატმ წნევის დროს 120 °C -ა. ასევე ცნობილია ორი მყარი ჰიდრატი; მონოჰიდრატი (HNO3·H2O) და ტრიჰიდრატი (HNO3·3H2O).

კომერციული აზოტმჟავა როგორც წესი წარმოადგენს აზოტმჟავისა და წყლის მაქსიმალური დუღილის ტემპერატურის მქონე აზეოტროპს, რომლის კონცენტრაცია დაახლ. 68%-ს შეადგენს (დაახლ. 15მოლ). ის მიიჩნევა კონცენტრირებულად ან ტექნიკურად. რეაქციებისათვის ჩვეულებრივ გამოიყენება 70% HNO3. კონცენტრირებული აზოტმჟავის სიმკვრივე 1.42 გ/მლ-ს შეადგენს.

აზოტმჟავა ექვემდებარება თერმულ და სინათლის გავლენით დაშლას:
4 HNO3 → 2 H2O + 4 NO2 + O2.
მოცემულ რეაქციას შეუძლია გაზარდოს ხსნარის ზემოთ არსებული ჰაერის ორთქლის წნევა, იმიტომ, რომ წარმოქმნილი აზოტის ოქსიდები მთლიანად ან ნაწილობრივ იხსნება მჟავაში.
აზოტის დიოქსიდი (NO2) მჟავაში გახსნილი რჩება და ხსნარს ყვითელ ან (მაღალ ტემპერატურებზე) წითელ შეფერილობას აძლევს. მაშინ, როდესაც წესით სუფთა მჟავამ ჰაერთან შეხებისას თეთრი კვამლი უნდა აუშვას, ის მასში გახსნილი დიოქსიდის გამო წითელ-ყავისფრად ბოლავს, ამის გამო მას „წითლად მბოლავი მჟავა“ ან „მბოლავი აზოტმჟავა“ დაარქვეს. ეს ფორმა აზოტმჟავის ყველაზე კონცენტრირებული ვარიანტია სტანდარტულ პირობებში.
აზოტმჟავა, რომელსაც სამრეწველოდ გამოიყენებენ, შეიცავს 90% HNO3-ს და აქვს 1.50 გ/მლ სიმკვრივე. ამ კონცენტრაციის მქონე მჟავა ძირითადად ასაფეთქებელი ნივთიერებების ინდუსტრიაში გამოიყენება. ის არც ისეთი აგრესიულია და არც ისეთი კოროზიული, როგორც უწყლო. მისი დაახლოებითი კონცენტრაცია 21.4 მოლს შეადგენს.
წითლად მბოლავი აზოტმჟავა, ან RFNA, საკმაოდ დიდი რაოდენობით გახსნილ აზოტის დიოქსიდს (NO2) შეიცავს, რაც ხსნარს მოწითალო-ყავისფერ ფერს აძლევს. მასში გახსნილი ოქსიდის გამო წითლად მბოლავი მჟავის სიმკვრივე 1.490 გ/მლ -ს შეადგენს.
ინჰიბირებული მბოლავი აზოტმჟავა (ან IWFNA, ან IRFNA). შეიძლება მომზადდეს მჟავაში 0.6-0.7% ფთორწყალბადი-ს (HF) დამატებით. ფთორწყალბადი ემატება კოროზიაგამძლეობისათვის. ფთორიდები, რომლებიც მეტალის ზედაპირზე იქმნება, ხელს უშლის კოროზიის გავრცელებას.
თეთრად მბოლავი აზოტმჟავა, სუფთა აზოტმჟავა ან WFNA წარმოადგენს თითქმის უწყლო აზოტმჟავას. დოკუმენტურად ის არსებობს 99.99% ფორმით. თეთრად მბოლავი აზოტმჟავის ერთ-ერთი განმარტება ხსნის, რომ ის შეიცავს მაქსიმუმ 2% წყალს და მაქსიმუმ 0.5% გახსნილ NO2-ს. უწყლო აზოტმჟავის სიმკვრივე შეადგენს 1.513 მ/მლ და მისი კონცენტრაცია 24 მოლია. უწყლო აზოტმჟავა უფერო მოძრავი სითხეა სიმკრივით pure 1.512 გ/სმ3, რომელიც იყინება −42 °C თეთრი კრისტალების წარმოქმნით. იმის გამო, რომ ის იშლება NO2-დ და წყლად, ის ყვითელ ფერს იძენს. დუღილის ტემპერატურაა 83 °C. ჩვეულებრივ მას მუქ დარტყმაგამძლე ბოთლში ინახავენ მასში სითხის მოცულობაზე ორჯერ მეტი თავისუფალი ადგილით, რომ წნევას გაუძლოს. წნევის გამოშვება საჭიროა რამდენიმე ხანში ერთხელ.

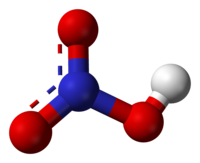
მოლეკულა გაშლილია. ორი N-O ბმული ერთნაირია და ასე თუ ისე მოკლეა (ამას რეზონანსის თეორიები ხსნიან. კანონიკური ბმები გვაჩვენებენ ორმაგი ბმების ხასიათს ამ ორ ბმაში. ისინი უფრო მცირეები არიან, ვიდრე ჩვეულებრივი N-O ბმები.). მესამე N-O ბმა უფრო წაგრძელებულია, რადგან ჟანგბადის მესამე ატომი პროტონთანაცაა მიბმული.[1][2]
ოთხის თემპერატურაზე აზოტმჟავა მიჩნეულია ძლიერ მჟავად. ჯერ კიდევ მიუღწეველია შეთანხმება მისი დისოციაციის რიცხვთან, თუმცა pKa რიცხვი ჩვეულებრივ -1-ზე ნაკლებია. ეს ნიშნავს, რომ აზოტმჟავა მის განზავებულ ხსნარებში სრულად დისოცირებულია, გარდა ექსტრემალურად მჟავა გარემოებისა. 250 °C -ზე pKa იზრდება 1მდე.[3]
სხვა ძლიერ მჟავასთან (მაგ გოგირდმჟავასთან) ერთად აზოტმჟავას შეუძლია ასევე გამოავლინოს ტუტე თვისებები:
ნიტრონიუმის იონი, NO2+, აქტიური რეაგენტია არომატულ ნიტრირებაში. იმის გამო, რომ აზოტმჟავას გააჩნია ორივე, როგორც მჟავა, ისე ფუძე თვისებები, მას შეუძლია ავტოპროტოლიზის რეაქციაში შევიდეს, ისევე, როგორც წყლის თვითიონიზაციის რეაქცია:
აზოტმჟავა რეაქციაში შედის მეტალების უმრავლესობასთან. მაგრამ რეაქციის დეტალები და გამოსავალი ძალიანაა დამოკიდებული მის კონცენტრაციაზე და მეტალის ბუნებაზე. განზავებული აზოტმჟავა ისე იქცევა, როგორც ტიპური მჟავა მეტალების უმრავლესობასთან.H2-ს მისგან მხოლოდ მაგნიუმი, მანგანუმი და თუთია გამოაძევებენ. სხვა მეტალები აზოტმჟავისგან აზოტის ოქსიდებსა და ამიაკს გამოათავისუფლებენ, ისევე როგორც თავისუფალ აზოტს.[4]
აზოტმჟავას შეუძლია ისეთი არააქტიური მეტალების დაჟანგვა, როგორიცაა სპილენძი და ვერცხლი. არამეტალებთან ან ნაკლებად ელექტროდადებით მეტალებთან რეაქციის პროდუქტები დამოკიდებულია ტემპერატურაზე და მჟავის კონცენტრაციაზე. მაგალითად სპილენძი ურთიერთქმედებს განზავებულ აზოტმჟავასთან ოთახის ტემპერატურაზე 3:8 სტოიქიომეტრიიით:
გამოყოფილი აზოტის მონოქსიდს შეუძლია რეაქციაში შევიდეს ატმოსფერულ ჟანგბადთან და გამოყოს აზოტის დიოქსიდი. უფრო მეტად კონცენტრირებული აზოტმჟავასთან სპილენძის ურთიერთქმედებისას პირდაპირ აზოტის დიოქსიდი გამოიყოფა, 1:4 სოიქიომეტრიით:
აზოტმჟავასთან ურთიერთქმედებისას მეტალების უმრავლესობა ნიტრატებად გარდაიქმება. მაგრამ ზოგიერთი მეტალოიდი და მეტალი მხოლოდ ოქსიდებამდე იჟანგება. მაგალითად კალა,დარიშხანი, სტიბიუმი და ტიტანი შესაბამისად SnO2, As2O5, Sb2O5 და TiO2-მდე იჟანგებიან. [4]
ზოგიერთი ძვირფასი მეტალი, როგორებიცაა სუფთა ოქრო და პლატინის ჯგუფის მეტალები, არ რეაგირებენ აზოტმჟავასთან. თუმცა სუფთა ძვირფასი მეტალები რეაგირებენ ე.წ. სამეფო წყალთან, რომელიც წარმოადგენს კონცენტრირებული აზოტმჟავისა და მარილმჟავის წყალხსნარს. მაგრამ ნაკლებად ძვირფასი მეტალები, მაგალითად ვერცხლი და სპილენძი, რომლებიც ღარიბ ოქროს შენადნობებში შედიან, ადვილად იჟანგებიან და იხსნებიან აზოტმჟავაში, რასაც ოქროს შენადნობის ზედაპირის ფერის ცვლილებამდე მივყავართ. ამ თვისებას ფართოდ იყენებენ სამკაულების მაღაზიებში ოქროს შემცველობის დასადგენად.
იმის გამო, რომ აზოტმჟავა ძალიან ძლიერი მჟანგავია, ის აგრესიულად ურთიერთქმედებს ბევრ არამეტალურ ნაერთთან და ეს რეაქციები შეიძლება ფეთქებად ხასიათს ატარებდეს. მჟავის კონცენტრაციაზე, ტემპერატურაზე და რეაქციაში შემავალ აღმდგენზე დამოკიდებულებით რეაქციის პროდუქტები ძალიან შეიძლება განსხვავდებოდეს. რეაქცია იწყება და მიმდინარეობს ყველა მეტალთან გარდა ძვირფას მეტალებისა და ზოგიერთი შენადნობისა, რეაქციის პროდუქტების დიდი ცვალებადობით. საზოგადოდ მიღებულია, რომ რეაქცია მიმდინარეობს კონცენტრირებულ აზოტმჟავასთან და გამოიყოფა აზოტის დიოქსიდი (NO2). მაგრამ აზოტმჟავის ძლიერი მჟანგავი თვისებები თერმოდინამიკურ ხასიათს ატარებენ, მაგრამ ხანდახან მისი მჟანგავი რეაქციები ქიმიური კინეტიკით უპირატესად არ მიიჩნევა. თუნდაც მცირე რაოდენობით აზოტოვანი მჟავის (HNO2) ჩართვა რეაქციაში მის სიჩქარეს ძალიან ზრდის.[4]
მიუხედავად იმისა, რომ ქრომი, რკინა და ალუმინი ძალიან ადვილად იხსნებიან განზავებულ აზოტმჟავაში, კონცენტრირებულ მჟავასთან შეხებისას ისინი ზედაპირზე ქმნიან ოქსიდის დამცავ ფენას, რომელიც ხელს უშლის ჟანგვის გაგრძელებას. ამ დამცავ ფენას პასივაცია ეწოდება. პასივაციის ტიპური კონცენტრაცია იცვლება 20-25% შუალედში(იხილეთ ASTM A967-05). მეტალები, რომლებიც პასიურდებიან კონცენტრირებული აზოტმჟავით, არიან: რკინა, კობალტი, ქრომი, ნიკელი და ალუმინი.[4]
იმის გამო, რომ აზოტმჟავა წარმოადგენს ძალიან ძლიერ მჟანგავ მჟავას, ის ძალიან ადვილად შედის რეაქციაში ბევრ ორგანულ ნაერთთან და ეს რეაქციები შეიძლება აფეთქებით დასრულდეს. ჩვეულებრივ, აზოტმჟავის ჰიდროქსილის ჯგუფი ნაერთებს ართმევს წყალბადს, რომლის ადგილს ნიტროჯგუფი იკავებს. ორგანული ნაერთების აზოტმჟავით ნიტრირება ბევრი ასაფეთქებელი ნივთიერების დასამზადებელი ჩვეულებრივი მეთოდია. მაგალითად ნიტროგლიცერინი და ტრინიტროტოლუოლი(TNT)ამ მეთოდით მზადდება. იმის გამო, რომ რეაქციის მსვლელობისას ბევრი სხვა არასტაბილური პროდუქტი წარმოიქმნება, ნიტრირების რეაქციები ძალიან დიდი სიფრთხილით უნდა ჩატარდეს. საჭიროა ტემპერატურის კონტროლი და რეაქციის თანაპროდუქტები სწრაფად უნდა მოშორდეს რეაქციის არეს.
არამეტალებთან რეაქცია აზოტის, ჟანგბადის, კეთილშობილი აირების, სილიციუმის და ჰალოგენებისა (იოდის გარდა) ჟანგავს მათ შესაბამისი უმაღლესი ჟანგვის რიცხვამდე, ისევე როგორც რეაქცია მჟავებთან აზოტის დიოქსიდისა(კონცენტრირებულ) და აზოტის(განზავებულ) მჟავასთან, შესაბამისად.
ან
კონცენტრირებული აზოტმჟავა ჟანგავს I2-ს, P4-ს და S8-ს შესაბამისად HIO3მდე, H3PO4მდე და H2SO4მდე.[4]
აზოტმჟავა რეაგირებს პროტეინთან და წარმოქმნის ყვითელ ნიტრირებულ პროდუქტებს. ეს რეაქცია ცნობილია ქსანპროტეინული რეაქციის სახელით. ტესტი მიმდინარეობს კონცენტრირებული აზოტმჟავის დამატებით სატესტო გარემოში და ნარევის გათბობით. თუ ხსნარში იმყოფება პროტეინები, რომლებიც შეიცავენ ამინომჟავებს, რომლებსაც გააჩნიათ არომატული ბმები, ხსნარი გაყვითლდება. ისეთი ძლიერი ფუძის დამატებისას, როგორიც მაგალითად ამიაკია, ხსნარი ფორთოხლისფერის იღებს. ფერების ეს ცვლილებები განპირობებულია პროტეინში არომატული ბმების ცვლილებებით.[5][6] ქსანპროტეინის მჟავა წარმოიქმნება მაშინ, როცა აზოტმჟავა რეაქციაში შედის ეპითელურ უჯრედებთან. შესაბამისად კანის ფორმა იცვლება იმის მაჩვენებლად, რომ აზოტმჟავასთან ურთიერთობისას არ იქნა დაცული საკმარისი სიფრთხილე.
აზოტმჟავა იწარმოება აზოტის დიოქსიდის წყალთან ურთიერთქმედებით.
ჩვეულებრივ აზოტის მონოქსიდი, რომელიც რეაქციის დროს გამოიყოფა, ჰაერში არსებული ჟანგბადთან რეაქციითაზოტის დიოქსიდამდე იჟანგება.
მჟავის დამატებითი გამოსავლიანობის მისაღწევად აზოტის დიოქსიდს ატარებენ წყალბადის პეროქსიდიში.
კომერციული აზოტმჟავა ჩვეულებრივ წარმოადგენს მის წყალხსნარს კონცენტრაციით 52% დან 68%-მდე. ის იწარმოება ოსტვალდის პროცესის საშუალებით, რომელიც გერმანელი ქიმიკოსის ვილჰელმ ოსტვალდის სახელს ატარებს. ამ პროცესში უწყლო ამიაკი იჟანგება აზოტის ოქსიდამდე პლატინის ან როდიუმის კატალიზატორისა და მაღალი ტემპერატურის (დაახლ. 500 K) და მაღალი წნევის (დაახლ. 9 ბარი) თანხლებით.
აზოტის მონოქსიდი ამის შემდეგ რეაგირებს ჰაერში არსებულ ჟანგბადთან და წარმოქმნის აზოტის დიოქსიდს.
რომელიც შემდეგ შთაინთქმება წყლის მიერ აზოტმჟავისა და აზოტის მონოქსიდის წარმოქმნით.
აზოტის მონოქსიდი ხელახლა დაჟანგვისათვის უკან ბრუნდება. უკანასკნელი პროცესი ასევე შეიძლება მოხდეს ჰაერშიც:
მიღებული წყლიანი HNO3 შეიძლება კონცენტრირებულ იქნეს დისტილირებით მასით 68%-მდე. კონცენტრაციის შემდეგი გაზრდა ხდება დეჰიდრატაციით კონცენტრირებული გოგირდმჟავის საშუალებით. ჰაბერის პროცესით მიღებული ამიაკის გამოყენებით საბოლოო პროდუქტი შეიძლება მიღებულ იქნეს მხოლოდ ჰაერიდან და ბუნებრივი აირი.[7]
ჰაბერის პროცესის დანერგვამდე (1913 წ) აზოტმჟავა იწარმოებოდა ბირკლანდ-აინდის პროცესის მეშვეობით, რომელიც ასევე ცნობილია, როგორც რკალის პროცესი. ეს პროცესი ემყარება ატმოსფერული აზოტის დაჟანგვას ატმოსფერული ჟანგბადით ძალიან მაღალი ტემპერატურის თანხლებისას. ამ ტემპერატურის შესაქმნელად გამოიყენებოდა ელექტრული რკალი, რომელის საშუალებას იძლეოდა ელექტროენერგიის ხარჯვის მიხედვით მიგვეღო აზოტის მონოქსიდის 4% გამოსავლიანობა. აზოტის ოქსიდი შემდეგ გრილდებოდა და ურთიერთქმედებდა დარჩენილ ატმოსფერულ ჟანგბადთან დიოქსიდის წარმოქმნით და შთაინთქმებოდა წყლის მიერ განზავებული აზოტმჟავის წარმოსაქმნელად. ეს პროცესი საჭიროებდა ძალიან დიდი ენერგიის ხარჯვას და ძალიან სწრაფად შეიცვალა ჰაბერის პროცესით მაშინვე, როგორც კი ამიაკი გაიაფდა.
ლაბორატორიაში აზოტმჟავა მიიღება სპილენძი(II) ნიტრატი-ს დაშლით და მიღებული აზოტის დიოქსიდისა და ჟანგბადის წყალში გატარებით:
ალტერნატიული გზა შეიცავს თითქმის ერთი და იმავე მასის ნიტრატისა (მაგალითად ნატრიუმის ნიტრატისა და 96% გოგირდმჟავის ურთიერთქმედება და შემდგომი დისტილაცია აზოტმჟავის დუღილის ტემპერატურაზე(83 °C)). რექციის ადგილას რჩება მეტალის არააგრესიული სულფატი. მიღებული წითლად მბოლავი აზოტმჟავა შეიძლება გადაკეთდეს თეთრად მბოლავ აზოტმჟავად.[2]
ხნარში არსებული აზოტის ოქსიდები შემცირებული წნევის მეშვეობით ადვილად მოშორდება ოთახის ტემპერატურაზეც კი (10–30 წუთი 200 mmHg or 27 კპა) მბოლავი აზოტმჟავის წარმოქმნით. ეს პროცედურა ასევე შეიძლება ჩატარდეს შემცირებული წნევისა და ტემპერატურით ერთ საფეხურად ნაკლები რაოდენობის აზოტის დიოქსიდის წარმოქმნით.
განზავებული აზოტმჟავა შეიძლება კონცენტრირებულ იქნეს 68%მდე მჟავის შემცველობით, რომელიც 32% წყლის შემცველობით აზეოტროპს შეადგენს. ლაბორატორიებში კონცენტრაციის შემდგომი გაზრდისათვის იყენებენ დისტილაციას ან გოგირდმჟავით, ან მაგნიუმის ნიტრატს, რომლებიც იქცევიან, როგორც დეჰიდრატაციის აგენტები. ასეთი დისტილაცია მჟავის დაშლის თავიდან ასაცილებლად უნდა მოხდეს მთლიანად მინის აპარატში შემცირებული წნევისას. ინდუსტრიულად მაღალი კონცენტრაციის აზოტმჟავა მიიღება 68% აზოტმჟავაში დამატებითი აზოტის დიოქსიდის გახსნით აბსორბციულ კოშკში.[8] გახსნილი აზოტის ოქდიდები ან აორთქლდება თეთრად მბოლავი მჟავის შემთხვევაში ან რჩებიან წითლად მბოლავის შემთხვევაში. უწყლო აზოტმჟავის მიღების უახლესი მეთოდი თავის თავში მოიცავს წყალხსნარიდან მის გამოყოფას ელექტროქიმიური პროცესით.(აშშ პატენტი: US6200456 (B1))

აზოტმჟავა თავის მთავარ ინდუსტრიულ გამოყენებას ჰპოვებს სასუქების წარმოებაში. აზოტმჟავის ამიაკით განეტრალებისას წარმოიქმნება ამონიუმის ნიტრატი. ამ რეაქციისათვის იხარჯება 75-80% მსოფლიოში წელიწადში ნაწარმოები 26 მილიონი ტონა აზოტმჟავა. მისი სხვა გამოყენებების სია შეიცავს ასაფეთქებელი ნივთიერებების წარმოებას, ნეილონის პრეკურსორებს და სპეციალურ ორგანული ნაერთებს.[9]
ორგანულ სინთეზში, ინდუსტრიულსა თუ სხვა, ნიტროგჯუფს მრავალმხრივი გამოყენება გააჩნია. ანილინის ძირითადი ნაწარმები მზადდება არომატული ნაერთების ნიტრირებით და მათი შემდგომი აღდგენით. ნიტრაცია თავის თავში შეიცავს აზოტისა და გოგირდის მჟავებს შერევას ნიტრონიუმის იონის წარმოსაქმნელად, რომელიც ელექტროფილურად რეაგირებს ისეთ არომატულ ნაერთებთან, როგორიცაა ბენზოლი. ბევრი ფეთქებადი ნივთიერება, მაგ.ტრინიტროტოლუოლი ამ გზით მიიღება.
ნეილონის პრეკურსორი, ადიპიკის მჟავა სამრეწველო მასშტაბით მიიღება აზოტმჟავით ციკლოჰექსანონისა და ციკლოჰექსანოლის დაჟანგვით.[9]
აზოტმჟავა სხვადასხვა ფორმით გამოიყენებოდა როგორც მჟანგავი თხევადსაწვავიან რაკეტებში. ეს ფორმები შეიცავდა წითლად მბოლავ აზოტმჟავას, თეთრად მბოლავ აზოტმჟავას და ხსნარებს გოგირდმჟავასთან.კოროზიის ინჰიბიტორად HF იხმარებოდა .[10] IRFNA (ინჰიბირებული წითლად მბოლავი აზოტმჟავა) ერთ-ერთი იყო სამი სითხიდან BOMARC რაკეტისათვის.[11]
ელემენტარულ ანალიზში ICP-MSდან, ICP-AESდან, GFAAდან და Flame AAდან, 0.5-5% აზოტმჟავა გამოიყნება როგორც მატრიცული ნაერთი ხსნარებში მეტალების კვალის დასადგენად.[12] ამ კვლევებისათვის საჭიროა ზემაღალი სისუფთავის მჟავა იმიტომ, რომ მასში მეტალის ნაერთების არსებობას კვალის სახითაც კი სერიოზული შედეგი შეიძლება ჰქონდეს.
ის ჩვეულებრივ ასევე გამოიყენება მღვრიე წყლის , ნარჩენებისა და მყარი ნიმუშების, ისევე როგორც სხვა ტიპის უნიკალური მასალების ანალიზებისათვის, რომლებზეც ელემენტარულ ანალიზს ატარებენ ICP-MS, ICP-OES, ICP-AES, GFAA და ალის ატომურ-აბსორბციული სპექტროსკოპია მეთოდებით. ჩვეულებრივ ამ ხაზით გამოყენებისათვის იხმარება 50% ხსნარი შეძენილი მჟავისა, რომელსაც ურევენ პირველი ტიპის DI წყალს.[13]
ელექტროქიმიაში აზოტმჟავა გამოიყენება ორგანული ნახევარგამტარების ლეგირებისათვის და ნახშირბადის ნანომილებით წმენდისათვის.
დაბალი კონცენტრაციის (დაახლოებით 10%) აზოტმჟავა ხშირად გამოიყენება ფიჭვისა და ნეკერჩხლის ხელოვნურად დასაბერებლად. მიღებული მოყავისფრო-ოქროსფერი ფერი ძალიან ჰგავს ცვილით ან ზეთით დამუშავებულ ხეს (ხის დამუშავება).[14]
აზოტმჟავის კოროზიული ეფექტები გამოიყენება ისეთი მიზნებით, როგორიცაა უჟანგავ ფოლადზე ამოწვა ან სილიკონის დაფების გაწმენდა (ელექტრონიკაში).[15]
აზოტმჟავის, სპირტისა და წყლის ხსნარი (ნიტალი) გამოიყენება მეტალების ამოსაჭმელად მათი მიკროსტრუქტურის გამოკევლევისათვის. სტანდარტი ISO 14104 აღწერს ამ კარგად ცნობილ პროცედურას.
გასაყიდად ხელმისაწვდომი 5-30% აზოტმჟავისა და 15-40% ფოსფორმჟავის ხსნარები გამოიყენება საჭმლისა და მისი შესანახი ჭურჭლის გასაწმენდად მათგან მაგნიუმისა და კალციუმის ნაერთების მოშორების მიზნით(ნალექები ან ორთქლით დამუშავების შედეგად, ან წარმოებისას მაგარი წყლის გამოყენების გამო). ფოსფორმჟავა ეხმარება რკინის შენადნობებს განზავებული აზოტმჟავის მიმართ პასივაციაში.
აზოტმჟავა ასევე შეიძლება გამოყენებული იქნა ალკალოიდების ტესტში, მაგალითად LSD. ალკალოიდის ტიპის მიხედვით ხსნარი სხვადასხვა შეფერილობას იძენს.[16]

აზოტმჟავა კოროზიული მჟავაა და ძლიერი მჟანგავია. ყველაზე საშიშია ქიმიური დამწვრობა, რომელსაც იწვევს პროტეინების, ამიდების და ცხიმების (ესტერების) მჟავური ჰიდროლიზი, რომელიც თანდათან იწვევს ქსოვილის დაშლას (მაგ. კანის და ხორცის). კონცენტრირებული აზოტმჟავა ღებავს ადამიანის კანს ყვითელ ფრად, რაც გამოწვეულია მის კერატინთან ურთიერთქმედებით. ყვითელი ფერი ნეიტრალიზაციისას ფორთოხლისფრდება.[17] სისტემატური ეფექტები არ გააჩნია და ნივთიერება არაა მიჩნეული არც კარცინოგენად და არც მუტაგენად.[18]
ისევე როგორც სხვა კოროზიული ნივთიერებების შემთხვევაში, პირველად დახმარებას კანთან კონტაქტის დროს წარმოადგენს მისი ჩამობანა დიდი რაოდენობის წყლით. რეცხვა გრძელდება 10-15 წუთის განმავლობაში დამწვრობის გარშემო მის გასაგრილებლად და ასევე მეორადი დამწვრობის თავიდან ასაცილებლად. ასევე საჭიროა სასწრაფოდ მოვიშოროთ დაბინძურებული ტანსაცმელი და მის ქვეშ მდებარე კანის გულითადად გარეცხვა.
იქიდან გამომდინარე, რომ აზოტმჟავა ძლიერ მჟანგავს წარმოადგენს, მისი რეაქცია ისეთ ნივთიერებებთან, როგორებიცაა ციანიდები, კარბიდები და მეტალების ფხვნილები შეიძლება აფეთქებით დასრულდეს და რეაქციები ზოგიერთ ორგანულ ნივთიერებასთან (მაგ. ტურპენტინთან) ძალიან ძლიერი და ხანდახან ჰიპერგოლურია (ანუ თვითაალებადი). ამიტომ ის ყოველგვარი შესაძლო ორგანიკისა და ფუძეებისაგან შორს ინახება.
აზოტმჟავა პირველად Pseudo-Geber's De Inventione Veritatis-შია, სადაც მან ის მიიღო ნიტერის, ალუმისა და ლურჯი ვიტრიოლის კალცინირებით. მეორედ ის აღწერა ალბერტ დიდის მიერ მეცამეტე საუკუნეში და რამონ ლულის მიერ, რომლებმაც ის მოამზადეს ნიტრისა და თიხის გახურებით და დაარქვეს "სამეფო წყალი".[19]
გლაუბერმა აღმოაჩინა მჟავის მიღების ახალი პროცესი კალიუმის ნიტრატისა და გოგირდმჟავის მოქმედების შედეგად მიღებული ნაზავის დისტილაციით. 1776 წელში ანტუან ლავუაზიემ დაამტკიცა, რომ ის შეცავს ჟანგბადს და 1785 წელს ჰენრი კავენდიშმა აღმოაჩინა მისი ზუსტი შემადგენლობა და აჩვენა, რომ მისი მიღება შეიძლება ელექტრულ რკალში ტენიანი ჰაერის გატარებით.[19]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.