ブルー・ホワイトセレクション
ウィキペディアから
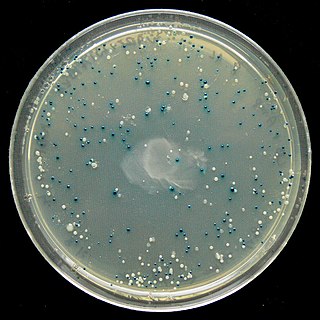
ブルー・ホワイトセレクション(英語: Blue–white screen、青白選択、青白スクリーニング)は、ベクターを用いた分子クローニング実験で組換え細菌を迅速かつ便利に検出できるスクリーニング技術。まず、目的のDNAをベクターに連結する。次に、ベクターを形質転換に適したコンピテントセルに挿入し、X-galの存在下で増殖させる。組換えDNAを含むベクターで形質転換された細胞は、白いコロニーを生成する。非組換えプラスミド(すなわちベクターのみ)で形質転換された細胞は青いコロニーに成長する。このスクリーニング方法は通常、適切な細菌株を使用して実行されるが、酵母などの他の生物も使用できる。

背景
分子クローニングは、分子生物学で最も一般的に使用される手順の1つである。目的の遺伝子はライゲーションを介してプラスミドベクターに挿入され、このプラスミドによって大腸菌細胞は形質転換される。ただし、細胞を形質転換したすべてのプラスミドに目的の遺伝子挿入物(インサート)が含まれているわけではなく、インサートの存在について個々のコロニーをチェックするのは時間がかかる作業である。したがって、インサートの有無を検出する簡便な方法は、この手順の時間と労力を削減するのに役立つ。インサートの検出のために開発された初期の方法の1つは、細菌コロニーの色でクローニング反応の成功した産物の同定を可能にする、このブルー・ホワイトセレクション(青白スクリーニング)である。
この方法は、β-ガラクトシダーゼ遺伝子のα相補性の原理に基づいている。このα相補性の現象は、フランソワ・ヤコブとジャック・モノの研究室でアグネス・ウルマンが行った研究で初めて実証された。配列の一部が欠失した不活性な変異型β-ガラクトシダーゼの機能は、欠失した部分と同じ配列がそのまま残されているβ-ガラクトシダーゼの断片(α-ドナーペプチド)によって回復した[1]。Langleyらは、変異体の非機能性β-ガラクトシダーゼは、そのN末端の一部11–41番残基が欠失しているが、β-ガラクトシダーゼの3–90番残基からなるペプチドによって補完される可能性があることを示した[2]。 最初の145アミノ酸をコードする配列を含むM13バクテリオファージは、後にMessing らによって構築された。ベクターの使用によるα相補性は、不活性タンパク質を含む細胞がファージに感染し、X-galを含むプレートで増殖したときに青いプラークが形成されることで実証された[3]。
VieiraとMessingによるプラスミドクローニングベクターのpUCシリーズはM13システムをもとに開発され、このスクリーニング法を利用するために構築された最初のプラスミドだった[4]。この方法では、プラスミドに連結されたDNAがαペプチドを破壊するため、相補プロセスが破壊され、機能的なβ-ガラクトシダーゼは形成されない。したがって、インサートを含むプラスミドで形質転換された細胞は白いコロニーを形成し、インサートのないプラスミドで形質転換された細胞は青いコロニーを形成する。このように、ライゲーションの成功は白いコロニー形成となり、失敗は青いコロニー形成によって容易に識別できる[5]。
分子機構
要約
視点

β-ガラクトシダーゼは、lacオペロンのlacZ遺伝子によってコードされるタンパク質であり、その活性状態ではホモ四量体として存在する。しかし、 大腸菌 M15株に由来する変異体β-ガラクトシダーゼは、そのN末端の11–41番残基が欠失しており、この変異体、ω-ペプチドは、四量体を形成することができず不活性である。しかし、タンパク質のこの変異型は、タンパク質のN末端断片であるαペプチドの存在下で、その活性四量体状態に完全に戻る可能性がある。 αペプチドによる変異βガラクトシダーゼの機能の回復は、α相補性と呼ばれる。
このスクリーニング方法では、宿主大腸菌株は、ω-ペプチドを含むlacZ欠失変異体(lacZΔM15)を保持し、使用されるプラスミドは、β-ガラクトシダーゼの最初の59残基、α-ペプチドをコードするlacZα配列を保持する。どちらも単独では機能しない。しかし、lacZα配列を含むプラスミドがlacZΔM15細胞に形質転換される場合のように、2つのペプチドが一緒に発現される場合、それらは機能的なβ-ガラクトシダーゼ酵素を形成する。
ブルー・ホワイトセレクションは、このα相補性プロセスを妨害することにより機能する。このプラスミドは、lacZα配列内に内部マルチクローニングサイト(MCS)を保持している。このlacZα内部のMCSは外来DNAの挿入を目的として制限酵素で切断することができ、それによってα-ペプチドを産生する遺伝子は破壊される。その結果、インサートを含むプラスミドを含む細胞では、機能的なβ-ガラクトシダーゼは形成されなくなる。
活性β-ガラクトシダーゼの存在は、ラクトースのアナログであるX-galによって検出される。X-galは無色であるが、β-ガラクトシダーゼによって切断されて5-ブロモ-4-クロロ-インドキシルを形成し、その後自発的に二量体化および酸化して明るい青色の不溶性色素である5,5'-ジブロモ-4,4'-ジクロロインジゴとなる。これにより、機能的なβ-ガラクトシダーゼを含む細胞に特徴的な青色が生じる。したがって、青いコロニーは、lacZαが破壊されていないベクターを含む可能性があることを示している(つまり、インサートは無い)。一方、X-galが加水分解されていない白いコロニーは、活性なβガラクトシダーゼの形成を妨げるような、lacZαへの挿入が存在している可能性があることを示している。
組換えクローンは、形質転換コロニーから少量のプラスミドDNAを分離および精製することによりさらに分析でき、制限酵素を使用してクローンを切断し、目的のフラグメントがあるかどうかを判断できる[6]。DNAの配列を決定する必要がある場合、制限酵素を使用して切断するか、他のアッセイを実行するかに関わらず、コロニーのプラスミドをある時点で分離する必要がある。
実施上の配慮点
要約
視点
正しいタイプのベクターとコンピテントセルを使用することは、ブルー・ホワイトセレクションを計画する際の重要な実施上の配慮点である。プラスミドにはlacZαが含まれている必要があり、そのようなプラスミドの例としてはpUC19およびpBluescriptがある。大腸菌細胞は、配列が削除された変異lacZ遺伝子(すなわちlacZΔM15)を含む必要があり、そのような遺伝子型を持つ一般的に使用される細胞にはJM109、DH5α、およびXL1-Blueがある。
lacオペロンはグルコースの存在によって影響を受けることも理解されるべきだ。グルコースのとりこみに関与するタンパク質EIIAGlcは、グルコースが細胞内に輸送されるとラクトース透過酵素をシャットダウンする。したがって、寒天プレートではグルコースを含まない培地を用いるべきである。
X-galは光に弱いため、X-galを含む溶液とプレートは暗所で保管する必要がある。 lacオペロンのインデューサーとして機能するイソプロピル-β-D-1-チオガラクトピラノシド (IPTG)は、LacZの発現を高めるために培地で使用できる。
X-galは高価な試薬であるため、細菌をスクリーニングするために他の方法が開発されている。細菌のスクリーニングを支援する代替手段として、GFPを利用する技術が開発されている。この技術のコンセプトは、インサートがベクター内のコーディング配列を破壊し、GFP産生を破壊して非蛍光細菌をもたらす、という点でα相補性と似ている[7]。組換えベクター(ベクター+インサート)を持つ細菌は白色でGFPタンパク質を発現しないが、非組換え(ベクターのみ)はUVランプの下で蛍光を発する。
GFPは一般にレポーター遺伝子として使用されており、研究者が分析している遺伝子がクローンに含まれているかどうかを、研究者自身が明確に判断できる。コロニーが成長する培地が選別に影響を与え、偽陽性の結果をもたらす可能性がある[8]。培地上のX-galが時折分解して青色を発したり、GFPが培地のために蛍光を失ったりすることがあり、研究者が希望する組換え体とそれを持たないコロニーを決定する能力に影響を与える可能性がある[8]。
欠点
白いコロニーには、いくつかの理由で目的の組換えプラスミドが含まれていない場合がある。ライゲーションされたDNAが正しいものではないか、適切に連結されていない可能性がある。また、直鎖状のベクターによって形質転換が行われ、LacZαが生成されず青いコロニーが形成されないような形で直鎖状ベクターの両端が「修復」および連結されている可能性もある。また、突然変異によって発現されないα断片がもたらされる可能性がある。ベクターをまったく持たないコロニーも白く見え、使用する抗生物質が枯渇した後にサテライトコロニーとして現れることがある。
青いコロニーにインサートが含まれている可能性もある。これは、インサートがLacZα遺伝子と「インフレーム」にあり、終止コドンが挿入されていない場合に起こる。LacZαの構造が破壊されていない場合、機能的なLacZαを有する融合タンパク質が発現することがある。正しい組換えコンストラクトが明るい青色のコロニーを生成することもあり、同定が複雑になる場合がある。
脚注
関連項目
Wikiwand - on
Seamless Wikipedia browsing. On steroids.