トップQs
タイムライン
チャット
視点
UCHL1
ウィキペディアから
Remove ads
UCHL1(ubiquitin C-terminal hydrolase L1、EC 3.1.2.15)は脱ユビキチン化酵素であり、ヒトではUCHL1遺伝子にコードされる。

Remove ads
機能
UCHL1はC末端を介して付加されたユビキチンを加水分解し、ユビキチン単量体を生成する。UCHL1は全ての神経細胞に豊富に存在し(脳内の総タンパク質の1–2%を占める)、その発現は神経細胞、精巣/卵巣、びまん性神経内分泌系(diffuse neuroendocrine system)の細胞およびその腫瘍に特異的である[5][6]。
神経変性疾患における重要性
UCHL1のI93M変異はドイツ人1家系のパーキンソン病の病因として示唆されているが、他のパーキンソン病患者ではこの変異は見つかっておらず、この知見には議論がある[8][9]。
さらに、S18Y多型はパーキンソン病リスクの低下と関連していることが知られている[10]。この多型は神経細胞に対して抗酸化機能を発揮することが示されている[11]。
また、UCHL1はユビキチン単量体を安定化することで保護機能を発揮している可能性が報告されている。UCHL1はユビキチン単量体を安定化して分解を防ぐことで、プロテアソーム分解の標的となったタンパク質へのタグ付けのためのユビキチンプールを大きくしていると考えられている[12]。
UCHL1遺伝子はアルツハイマー病とも関連しており、UCHL1は正常なシナプス機能や認知機能に必要とされる[13]。また、UCHL1の喪失によって膵β細胞のプログラム細胞死感受性が高まることから、このタンパク質が内分泌細胞保護機能を果たしていること、そして糖尿病と神経変性疾患との関連が浮き彫りとなっている[14]。
UCHL1の変異(具体的にはユビキチン結合ドメインのE7A変異)を原因とする早発性の神経変性疾患患者では、視力の喪失、小脳失調、眼振、脊柱機能障害、上位運動ニューロン障害がみられる[15]。
Remove ads
異所性発現
UCHL1の発現は神経細胞や精巣/卵巣組織に特異的であるが、特定の肺腫瘍細胞株でも発現していることが知られている[16]。こうしたUCHL1の異常な発現はがんとの関係が示唆されており、UCHL1はがん遺伝子であるとみなされている[17]。さらに、ヒトの膜性腎症のラットモデルであるpassive Heymann nephritisではポドサイトでのUCHL1の新規発現が観察されることから、UCHL1が膜性腎症の病因に関与している可能性が示唆されている[18]。このUCHL1の発現は、ポドサイトの肥大の誘導に少なくとも部分的には関与していると考えられている[19]。
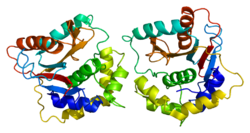
タンパク質構造
ヒトUCHL1タンパク質と、それに密接に関連したタンパク質であるUCHL3は、これまでに発見された中で最も複雑なノット構造を有するタンパク質の1つであり、5つの交差を有する。こうしたノット構造はプロテアソーム分解に対するタンパク質の抵抗性を高めている可能性がある[20][21]。
UCHL1タンパク質のコンフォメーションは、神経の保護や病理に重要な意味を持っている可能性がある。一例として、UCHL1の二量体化依存的なユビキチンリガーゼ活性は病因となっている可能性があり、α-シヌクレイン凝集の増大をもたらしている可能性がある[22]。UCHL1のS18Y多型は、二量体化を引き起こしにくいことが示されている[12]。
相互作用
UCHL1はCOP9S5と相互作用することが示されている[23]。
また、UCHL1はパーキンソン病の病理への関与が示唆されているα-シヌクレインと相互作用することも示されている。この相互作用はそのユビキチンリガーゼ活性によるものであり、I93M変異もこの活性と関連している可能性がある[22]。
近年、UCHL1はユビキチンリガーゼParkinと相互作用することが示された。ParkinはUCHL1に結合してユビキチン化を行い、UCHL1のリソソーム分解を促進する[24]。
出典
関連文献
関連項目
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads