GLUT4
ウィキペディアから
GLUT4 (glucose transporter type 4) は、ヒトではSLC2A4遺伝子にコードされているタンパク質である。Solute carrier family 2, facilitated glucose transporter member 4という別名でも知られる。GLUT4は、インスリンによって調節されるグルコーストランスポーターで、主に脂肪組織と横紋筋(骨格筋と心筋)に見つかる。これまで知られていたグルコーストランスポーターとは別物であると確定できたという最初の報告は、1988年にDavid Jamesによってもたらされた[1]。GLUT4をコードする遺伝子は1989年にクローニングされ[2][3]、マッピングされた[4]。
筋細胞や脂肪細胞において、GLUT4は細胞表面で血中から細胞内へ、グルコースの濃度勾配に従った促進拡散を行う。細胞内に入ったグルコースは、肝臓ではグルコキナーゼによって、他の組織ではヘキソキナーゼによって迅速にリン酸化され、グルコース-6-リン酸が形成される。その後、グルコース-6-リン酸は解糖系に入るか、あるいはグリコーゲンへと多量体化される。グルコース-6-リン酸への変換によって、細胞外へ拡散で戻ることはなくなり、GLUT4によってグルコースが細胞内に受動的に移動するために必要な濃度勾配も維持される[5]。
構造

他の全てのタンパク質が、それぞれに独特の機能を持てる理由は、それぞれの一次配列、つまり、どのような順番でアミノ酸がアミド結合してゆくことによって、そのタンパク質ができているかということに大きく関係している。それと同様に、GLUT4もまた独特の一次配列を持つことによって、細胞膜を越えたグルコースの輸送を行うという機能を持つことができている。ところで、GLUT4の場合は、例えばインスリンのシグナルが入ると細胞内にあったものが細胞膜上に移動するといった、ダイナミックな動態を示す。N末端のフェニルアラニン残基に加え、C末端の2つのロイシン残基と酸性を示す官能基が、エンドサイトーシスやエキソサイトーシスといったGLUT4の動態に重要な役割を果たすと考えられている[7]。
他のGLUTタンパク質
14種類のGLUTタンパク質が存在し、配列の類似性に基づいて3つのクラスに分類されている。GLUT1から4と14がクラス1に属し、GLUT5、7、9、11がクラス2に、GLUT6、8、10、12、13がクラス3に属する。
それぞれのGLUTタンパク質の配列には差異が存在するものの、基本的な構造的要素は共通である。例えば、GLUTタンパク質のN末端とC末端は細胞質側に露出しており、全てが12箇所の膜貫通領域を持つ[8]。
組織分布
骨格筋
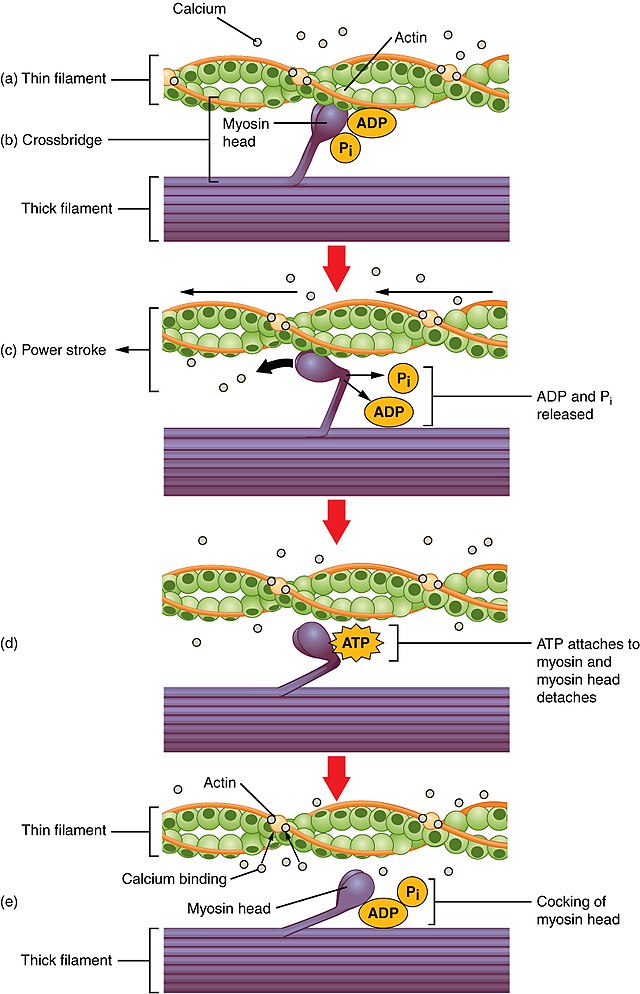
骨格筋の筋細胞では運動や筋収縮の結果、GLUT4は細胞膜に移行し、細胞膜上に存在するGLUT4の数が増加する。
運動中、身体はエネルギーとして利用するためにグルコースをATPへ変換する必要がある。グルコース-6-リン酸の濃度が低下するとヘキソキナーゼの阻害が解消され、ATPの合成を行う解糖系や他の酸化的経路の進行が可能になる。また、筋細胞内のグルコース濃度が低下するにつれ、より多くのグルコースを取り込めるようになる。この時に細胞内のグルコース濃度を高めるために利用される主要なトランスポーターがGLUT4である[10]。
運動と同様、筋収縮もGLUT4の細胞膜への移行を誘導するが、この2つの過程では、細胞内で異なる形態で存在するGLUT4が細胞膜へと移行される。GLUT4を含む小胞にはトランスフェリン陽性のものと陰性のものがあり、それらは異なる刺激によって呼び寄せられる。トランスフェリン陽性GLUT4小胞が筋収縮の際に利用されるのに対して、インスリン刺激や運動によって活性化されるのはトランスフェリン陰性小胞である[11] [12]。
心筋
心筋は骨格筋とはわずかに異なる。安静時は、心筋では主要なエネルギー源として脂肪酸が好んで利用される。活動が増加し心拍数が増加するにつれ、心筋はより高率でグルコースの酸化を開始する[13]。
心筋でのGLUT1とGLUT4のmRNAレベルの分析によって、心筋ではGLUT1がより大きな役割を果たしていることが示された。しかし、グルコース輸送の主要なトランスポーターは、心筋においてもやはりGLUT4であると考えられている[14]。
他の組織と同様、GLUT4はインスリンシグナルにも応答し、細胞膜へ輸送されてグルコースの細胞内への促進拡散を行う[15]。
脂肪組織
脂肪組織は、代謝の恒常性を維持するためのエネルギーの貯蔵庫である。グルコースの形で取り込まれたエネルギーは、一部が消費され、残りはグリコーゲンとして主に肝臓、筋細胞、脂肪に貯蔵される[16]。
グルコースの摂取が多く、エネルギー消費が少ないという不均衡は、脂肪細胞の肥大と過形成を引き起こし、肥満につながることが示されている[17][注釈 1]。それに加えて、脂肪細胞でのGLUT4の変異によって発現が増加し、グルコースの取り込みが増加してより多くの脂肪が貯蔵されることがある。GUT4が過剰発現すると、栄養分の分配が変化し、より多くのグルコースが脂肪組織へ送られ、脂肪組織の重量が増加する[17]。
調節
要約
視点
インスリン
我々が食事を行うと血中のグルコース濃度が上昇し、それを感知した膵臓からインスリンが血流へ放出される[18]。インスリンは膵臓のβ細胞に貯蔵されている。β細胞の細胞膜には常にGLUT2が存在しており、血中のグルコースを取り込んでいる。血中のグルコース濃度が上昇すると、β細胞に取り込まれるグルコースの量が増加するので、これによってβ細胞内ではエネルギーを多く獲得できたことで、β細胞内でシグナル伝達が開始され、β細胞内の小胞に貯蔵されていたインスリンが血流へと放出される[19]。血中のインスリン濃度の上昇は、全身の細胞でグルコースの取り込みの促進を引き起こす。血中のインスリン濃度が低い時には、筋細胞や脂肪細胞のGLUT4のほとんどは細胞内の小胞へ隔離されているが、細胞膜上の受容体にインスリンが結合すると、小胞は細胞膜と融合し、GLUT4は細胞膜へ挿入されてグルコースを輸送できるようになり、細胞内へのグルコースの取り込み量が増加する[16][20]。

GLUT4が関与する機構はカスケード反応の1例であり、リガンドの膜受容体への結合によりシグナルが増幅され、細胞の反応が引き起こされる。この場合、インスリンがインスリン受容体に結合し、インスリン受容体が2量体になると、受容体のチロシンキナーゼの部分が活性化される。インスリン受容体はインスリン受容体基質 (IRS1) を活性化し、IRS1はPI3キナーゼに結合する。PI3キナーゼは膜脂質PIP2をPIP3に変換する。PIP3はプロテインキナーゼB (PKB) とPDK1によって特異的に認識され、PKBをリン酸化して活性化する。リン酸化が起こるとPKBは活性型となり、TBC1D4をリン酸化して、そのGTPアーゼ活性化ドメインを阻害する。GTPアーゼ活性化ドメインはGタンパク質RabをGTP結合型からGDP結合型へ変化させるため、このドメインの阻害によってRabの活性型が維持されることとなり、GLUT4の細胞膜上での発現が促進される[21]。
RAC1もインスリンによって活性化されるGTPアーゼである。Rac1は表層アクチン繊維の再構成を促進し[22]、GLUT4小胞の細胞膜への挿入を可能にする[23][24]。RAC1のノックアウトマウスでは、筋組織でのグルコースの取り込みが減少する[24]。
筋収縮
筋収縮は筋細胞を刺激し、GLUT4受容体を細胞表面へ移行させる。これは特に心筋に当てはまり、連続的な収縮によってGLUT4の移行率が増加する。一方、骨格筋の収縮による増加は比較的少ない[26]。骨格筋では筋収縮によってGLUT4の移行は数倍に増加するが[27]、これはRAC1[28][29]やAMP活性化プロテインキナーゼ[30]によって調節されていると考えられる。
筋伸張
筋伸長もGLUT4の移行を促進し、RAC1を介してグルコースの取り込みを促進することがマウスの筋肉で示されている[31]。
相互作用
GLUT4はDaxxと相互作用することが示されている。Daxxはアポトーシスの調節に利用され、細胞質でGLUT4と結合する。GLUT4などに見つかるUBXドメインがアポトーシスシグナルの伝達に関係していることが示されている[6]。この相互作用はDaxxの細胞内の移行に利用されている[32]。
加えて近年の報告では、海馬などの中枢神経系においてGLUT4遺伝子が発現していることが示された。さらに、海馬においてインスリン刺激によるGLUT4の輸送の阻害を行うと、代謝活性と海馬の神経細胞の可塑性が低下し、うつ様行動と認知機能障害が引き起こされた[33][34][35]。
注釈
出典
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.