Loading AI tools
ウィキペディアから
Dishevelled(Dsh、哺乳類ではDvl)は、古典的・非古典的Wntシグナル伝達経路に関与するタンパク質ファミリーである。Dshは細胞質に位置するリン酸化タンパク質であり、Frizzled受容体の直接下流で機能する[1]。Dishevelled(髪が乱れた、もじゃもじゃした)という名称はハエでの発見時に由来するものであり、dishevelled遺伝子の変異によって体や翅の毛が不適切な方向に生えることが観察される[2]。ゼブラフィッシュ、ツメガエル(Xdsh)、マウス(Dvl1、-2、-3)、ヒト(DVL1、-2、-3)など脊椎動物にもホモログが存在する。Dshは正常条件下でも異常な条件下においても、組織や細胞内で複雑なWntシグナルを伝達する[2][3]。Wntシグナル伝達経路の調節時には、SPATS1と相互作用すると考えられている[4]。
Dishevelledは胚と成体の双方において、細胞分化や細胞極性から社会的行動までさまざまな重要な役割を果たす[2]。
Dishevelledタンパク質をコードするヒト遺伝子は3つ存在する[5]。
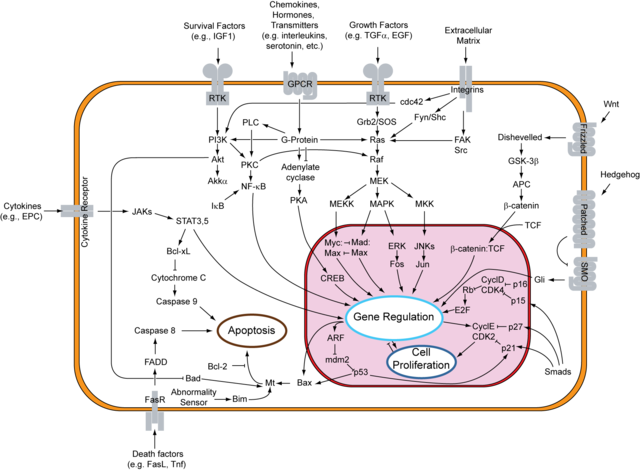
DVLは古典的(β-カテニン依存的)Wnt経路と非古典的(β-カテニン非依存的)Wnt経路において不可欠な部分を構成する[2]。いずれの場合も、DVLはFrizzled受容体の下流の因子として作用する[6]。
古典的Wnt経路はWnt/β-カテニン経路とも呼ばれ、発生、調節、細胞分化、増殖時に活性化される[7]。古典的Wnt経路では、DVLは保存された核外搬出配列(NES)と核局在化配列(NES)を介して細胞質と核を往復し、そのどちらも適切な機能に必要である。WntのFrizzled受容体への結合はDVLの細胞膜へのリクルートを助け、DVLはAxinとGSK3βが結合してLRP5/6をリン酸化するための足場となってβ-カテニンの恒常的分解を妨げる。DVLはこの分解を阻害することでβ-カテニンの核内への蓄積を可能にし、β-カテニンは核内でTCFのコアクチベーターとして機能してWnt応答性遺伝子を活性化する。逆に、Wntシグナルが存在しない場合には、APC、CKI、GSK3β、Axinから構成される分解複合体が細胞内のβ-カテニン濃度を低く維持している[7]。
平面内極性(planar cell polarity)経路は、最も特筆すべきβ-カテニン非依存的経路である。WntシグナルはFrizzled受容体によって受容され、FrizzledはDVLへシグナルを伝達する。DVLは2つの独立した経路の分岐点となり、低分子量GTPアーゼであるRhoとRacの活性化をもたらす[3][7]。Rho側の経路では、WntシグナルはDVLとDAAM1の複合体形成を誘導する[3]。その後、この複合体はRhoのグアニンヌクレオチド交換因子であるWGEF(weak-similarity GEF)と相互作用し、WGEFはRhoやRhoキナーゼ(ROCK)などのエフェクターを活性化する。そしてこれらが細胞内のアクチンや細胞骨格構造を活性化する。Rac側の経路では、DVLによるRacの活性化は下流のエフェクターであるc-Jun N末端キナーゼ(JNK)を刺激し、JNKは細胞骨格の再構成と遺伝子発現を制御する[7]。より具体的には、脊椎動物(ツメガエルなど)の原腸形成、神経管閉鎖、内耳における聴毛の配向決定などの過程において、細胞の極性と移動を調節する[7]。
β-カテニン非依存的な他の経路にはWnt-Ca2+経路があり、この経路はがん、炎症、神経変性に関与している。WntはFirzzledを介してCa2+の放出に至るカスケードを活性化し、細胞の運命決定や遊走に重要な遺伝子の転写を制御するエフェクター(CaMKIIなど)を活性化する[7]。この経路はWnt/β-カテニンカスケードのスイッチをオフにすることができ、またDVLの活性化によって阻害される[8]。
全てのDVLには5つの高度に保存された領域が存在し、N末端のDIXドメイン、PDZドメイン、C末端のDEPドメイン、そして2つの正に帯電したアミノ酸残基領域が存在する[3]。正に帯電した領域の1つ目はDIXドメインとPDZドメインの間に位置し、保存されたセリンとスレオニン残基が存在する。2つ目はPDZドメインとDEPドメインの間に位置し、プロリンに富む。これらの領域はタンパク質間相互作用を媒介し、DVLによるβ-カテニン依存的・非依存的経路のいずれかへのシグナル伝達を補助する[3]。さらに、保存された核外搬出配列(NES)と核局在化配列(NLS)が存在し、これらによるDVLの核-細胞質間移行はDVLの機能の重要な部分をなしている可能性がある[3]。

DIX(Dishevelled-Axin)ドメインはDVLのN末端領域付近に位置し、約82–85アミノ酸から構成される。DIXドメインはAxinやコイルドコイルタンパク質DIXDC1などのタンパク質にも存在する。DVLのDIXドメインは5本のβストランドと1本のαヘリックスからなり、アミノ酸残基は高度に保存されている[3][6]。
PDZドメインの名称は、共通した構造ドメインを持つ3つのタンパク質(Post synaptic density protein [PSD95]、Drosophila disc large tumor suppressor [Dlg1]、Zonula occludens-1 protein [zo-1])の頭文字に由来する。DVLのPDZは中心領域に位置する。PDZドメインはヒトのDVLタンパク質では約73アミノ酸から構成され、一般的に5–6本のβストランドと2–3本のαヘリックスから構成される[3][6]。このモチーフはリガンド結合とタンパク質のコンフォメーションに重要な役割を果たす。この領域は多くのタンパク質間相互作用を媒介し、複数の生物学的過程を調節する[3]。
DEP(Dishevelled-EGL-10-Pleackstrin)ドメインは、DVLのC末端に位置するドメインである。ヒトのDVLタンパク質では75アミノ酸の長さで、3本のαヘリックス、1つのβヘアピン、2本の短いβストランドから構成される[3][6]。このドメインはDVLとDAAM1との相互作用を可能にし、そのため非古典的経路を活性化する。DEPドメインがWnt刺激に伴うDVLタンパク質の膜への標的化を担うことを支持する結果が得られている。また、DEPドメインは機能的なシグナロソームの組み立てと核へのWntシグナルの伝達に必要不可欠である[3]。
DVLにはNESとNLSの双方が存在し、核-細胞質間の移動によってDVLの細胞内局在を調節する。NLSはPDZドメインとDEPドメインの間に位置し、NESはDEPドメインとC末端との間に位置する[3]。
DVLの翻訳後修飾には、リン酸化、ユビキチン化、メチル化という3種類の主要なタイプが存在する。リン酸化が最もよく研究されており、部位特異的なリン酸化によって幅広いさまざまな生物学的応答が引き起こされているようである[3]。ユビキチン化はDVLの分解を調節する役割を果たす翻訳後修飾である。
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.