トップQs
タイムライン
チャット
視点
シクロオキシゲナーゼ2
ウィキペディアから
Remove ads
シクロオキシゲナーゼ2(英: cyclooxygenase-2、略称: COX-2)またはプロスタグランジンエンドペルオキシドシンターゼ2(英: prostaglandin-endoperoxide synthase 2、略称: PTGS2)は、ヒトではPTGS2遺伝子にコードされる酵素である[5]。COX-2はヒトに2種類存在するシクロオキシゲナーゼのうちの1つである。COX-2はアラキドン酸からプロスタグランジンH2への変換に関与しており、炎症時に発現する。プロスタグランジンH2はプロスタサイクリンの重要な前駆体である。
→「シクロオキシゲナーゼ」も参照
Remove ads
機能
COX-2(PTGS2)は、アラキドン酸をプロスタグランジンH2(PGH2)に変換する。COXはNSAIDの標的であり、COX-2特異的阻害薬はコキシブ(coxib)と呼ばれる。COX-2は二量体を形成し、各単量体にはペルオキシダーゼとシクロオキシゲナーゼの活性部位が存在する。COXはアラキドン酸からプロスタグランジンへの変換を2段階で触媒する。まず、アラキドン酸の13位の炭素から水素が引き抜かれ、その後2分子の酸素が付加されてプロスタグランジンG2(PGG2)が形成される。続いて、PGG2はペルオキシダーゼ活性部位でPGH2に還元される。合成されたPGH2は組織特異的イソメラーゼによって、プロスタグランジン(PGD2、PGE2、PGF2α)、プロスタサイクリン(PGI2)またはトロンボキサンA2へ変換される[6]。
COX-2はアラキドン酸を主にPGG2へ代謝するが、少量は15-ヒドロキシエイコサテトラエン酸(15-HETE)のラセミ混合物へも変換される。この混合物は、約22%が15(R)-HETE、約78%が15(S)-HETEであり、11(R)-HETEも少量含まれる[7]。2つの15-HETE立体異性体自体にも生物学的活性は存在するが、リポキシンへの代謝がおそらくより重要性が高いものである。アスピリン処理されたCOX-2はアラキドン酸をほぼ15(R)-HETEのみに代謝し、代謝産物はさらにエピリポキシン(epi-lipoxin)へと代謝される[8]。
Remove ads
機構


触媒過程では、ペルオキシダーゼ活性とシクロオキシゲナーゼ活性の双方がmechanism-based inhibitionによって不活性化される。このことは、基質が十分に存在する場合でも、ペルオキシダーゼ活性とシクロオキシゲナーゼ活性の双方が1–2分以内に0にまで低下することを意味する[11][12][13]。
アラキドン酸からPGG2への変換は、多価不飽和脂肪酸の自動酸化に類似した一連のラジカル反応であることが示されている[14]。13-pro(S)水素が引き抜かれ、二原子酸素が11位の炭素のペンタジエニルラジカルを捕捉する。11-ペルオキシラジカルは9位の炭素と環化し、8位の炭素で形成された炭素中心ラジカルが12位の炭素と環化し、エンドペルオキシドが形成される。形成されたアリルラジカルは15位の炭素で二原子酸素に捕捉されて15-(S)-ペルオキシルラジカルとなり、その後このラジカルはPGG2に還元される。この反応は以下の証拠によって裏付けられている。(1) 13-pro(S)-水素の引き抜きには大きな速度論的同位体効果が観察される。(2) 触媒の際に炭素中心ラジカルが捕捉される[15]。(3) 13位と15位のアリルラジカル中間体が酸素に捕捉されることで少量の酸化生成物が形成される[16][17]。
13-pro(S)水素が脱プロトン化され、カルバニオンが酸化されてラジカルになるという別の機構も理論的には可能である。しかし、10,10-ジフルオロアラキドン酸の酸素化による11-(S)-ヒドロキシエイコサ-5,8,12,14-テトラエン酸の生成は、フッ素が脱離して共役ジエンが形成されるカルバニオン中間体の生成とは一致しない[18]。また、10,10-ジフルオロアラキドン酸に由来するエンドペルオキシドを含む生成物が存在しないことから、PGG2の合成におけるC-10カルボカチオンの重要性が示唆されていると考えられている[19]。しかし、カチオン性機構では、エンドペルオキシドの生成が13-pro(S)水素の脱離よりも先に起こることが必要である。このことは、アラキドン酸の酸素化の同位体実験の結果と一致しない[20]。
Remove ads
構造

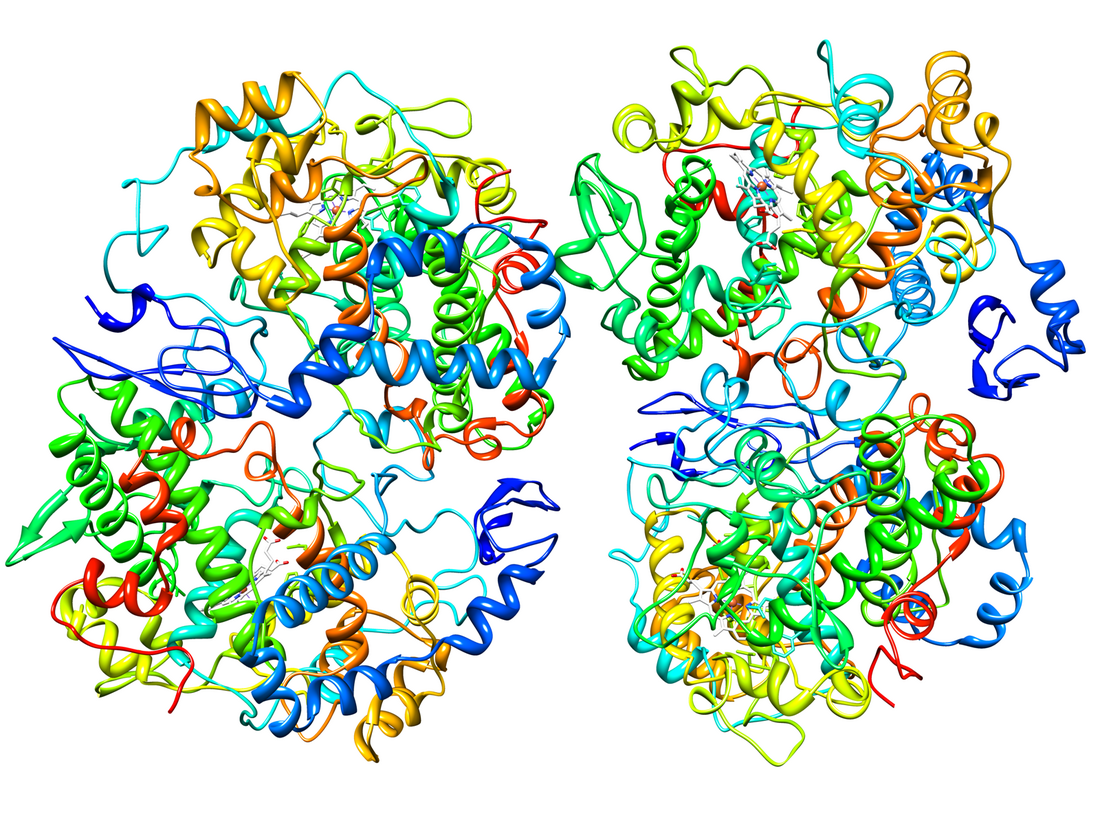
COX-2はホモ二量体として存在し、各単量体は約70 kDaである。COX-1(PTGS1)とCOX-2(PTGS2)の三次・四次構造はほぼ同一である。各サブユニットには、N末端の短いEGFドメイン、αヘリカル膜結合領域、C末端の触媒ドメインという3つの構造ドメインが存在する。COXはモノトピック膜タンパク質である。膜結合ドメインは両親媒性のαヘリックスからなり、いくつかの疎水性アミノ酸が膜の単分子層へ露出している。COX-1とCOX-2は二機能酵素であり、空間的には異なる位置にあるが機械的に共役した2つの活性部位で2つの化学反応を連続的に行う。触媒ドメインにはシクロオキシゲナーゼ(COX)活性部位とペルオキシダーゼ活性部位の双方が位置し、タンパク質の約80%を占める。触媒ドメインは、ミエロペルオキシダーゼなどの哺乳類のペルオキシダーゼと相同である[22][23]。
ヒトのCOX-2は触媒単量体(Ecat)とアロステリック単量体(Eallo)という、コンフォメーションの異なる単量体からなる二量体として機能することが判明している。ヘムはEcatのペルオキシダーゼ部位にのみ結合し、EcatのCOX部位は基質や特定の阻害剤(セレコキシブなど)が結合する。EalloのCOX部位には基質と基質以外の脂肪酸(FA)と一部の阻害剤(ナプロキセンなど)が選択的に結合する。アラキドン酸(AA)はEcatとEalloに結合することができるが、Ealloに対するAAの親和性はEcatよりも25倍高い。COX-2の効果的な促進因子であるパルミチン酸はEalloにのみ結合することがマウスのCOX-2とパルミチン酸の共結晶構造から示されている。基質以外の脂肪酸は、脂肪酸の種類や、阻害剤がEcatとEalloのどちらに結合するかに依存して、COX阻害剤の効果は増強されたり減弱されたりする。COX-2が機能する細胞内環境の遊離脂肪酸プールの濃度と組成(FA toneとも呼ばれる)が、COX-2の活性とCOX阻害剤への応答を調節する重要な因子であることが示唆されている[21]。
臨床的意義
要約
視点

COX-2は正常条件下では大部分の細胞では発現しておらず、炎症時に発現が上昇することが知られている。COX-1は多くの組織で構成的に発現しており、胃粘膜と腎臓における主要なCOXである。非ステロイド性抗炎症薬(NSAID)は、COX-1とCOX-2によるプロスタグランジンの産生を阻害する。COX-1の阻害は胃で細胞保護作用を有するPGE2やPGI2の基底レベルの産生を低下させ、胃潰瘍に寄与している可能性がある。COX-2は一般的にプロスタグランジンがアップレギュレーションされている細胞(炎症時など)でのみ発現するため、COX-2を選択的に阻害する薬剤候補ではこうした副作用は少ないと考えられているが[23]、一方で心不全、心筋梗塞、脳卒中などの心血管イベントを引き起こす可能性がある[24]。
低用量のアスピリンはCOX-1を遮断してトロンボキサンA2と呼ばれるプロスタグランジンの形成を防ぐことで、心臓発作や脳卒中から保護する。トロンボキサンA2は血小板を凝集させ、血液凝固を促進する。一方、COX-2選択的阻害薬(コキシブ)は心血管イベントを引き起こす可能性がある。ヒトの薬理学や遺伝学、遺伝子操作された齧歯類や他の動物モデル、ランダム化試験での研究からは、COX-2選択的阻害薬によって引き起こされる心血管イベントは、COX-2依存的に心臓を保護するプロスタグランジン、特にプロスタサイクリンの抑制によるものであることが示唆されている。COX-2は血管内壁に存在するプロスタサイクリンのより重要な産生源であり、プロスタサイクリンは血小板の凝集を防ぐため、血液凝固による心血管イベントのリスクが増加する[24][25]。
COX-2の発現は多くのがんでアップレギュレーションされている。COX-2の過剰発現は、血管新生やSLC2A1(GLUT1)の発現の増加とともに、胆嚢がんと強く関係している[26]。さらに、COX-2の産物であるPGH2はプロスタグランジンEシンターゼによってPGE2に変換され、がんの進行を促進する。したがって、COX-2の阻害はこれらのタイプのがんの予防と治療に有効である可能性がある[27]。
COX-2の発現はヒトの特発性網膜前膜でもみられる[28]。炎症の急性期にロルノキシカムによってCOXを阻害することで、増殖性硝子体網膜症(PVR)のジスパーゼモデルでは膜形成の頻度が43%、コンカナバリンモデルでは31%低下する。ロルノキシカムは、いずれのPVRモデルにおいてもCOXの発現を正常化しただけでなく、炎症促進因子の注入による網膜や脈絡膜の厚さの変化を抑制した。これらの事実は、PVRの発症におけるCOXとプロスタグランジンの重要性を強調するものである[29]。
PTGS2遺伝子のアップレギュレーションは、ヒトの生殖の複数の段階と関係している。PTGS2遺伝子は、羊膜上皮の絨毛膜板、合胞体性栄養膜、絨毛線維芽細胞、chorionic trophoblast、amniotic trophoblast、胎盤基底板、脱落膜細胞、絨毛外細胞性栄養膜で発現している。絨毛膜羊膜炎/脱落膜炎の過程における羊膜、絨毛脱落膜におけるPTGS2のアップレギュレーションは、子宮内での炎症の3つの限定的な効果の1つである。卵膜におけるPTGS2遺伝子の発現上昇は炎症の存在と関連しており、子宮でのプロスタグランジン遺伝子の発現や、chorionic trophoblast cellや隣接する絨毛膜または絨毛脱落膜へのプロスタグランジン経路タンパク質の免疫局在化を引き起こす。PTGS2(COX-2)は免疫系と関係しており、炎症性白血球で観察される。羊膜でのPTGS2の発現と自然分娩の過程には正の相関が存在し、分娩によって妊娠期間に応じて発現が増加することが発見されているが、胎盤や絨毛脱落膜では早産・正期産に関わらず変化はみられない。また、オキシトシンは子宮筋層細胞でPTGS2の発現を刺激する[30]。
漢族では、PTGS2 5939C変異アレルの保有者は胃がんのリスクが高いことが示されている。また、ピロリ菌Helicobacter pyloriの感染と5939Cアレルの存在との間に関連性が認められている[31]。
Remove ads
相互作用
歴史
COX-2は1991年にブリガム・ヤング大学のDaniel Simmonsの研究室によって発見された[33]。
出典
関連文献
関連項目
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads