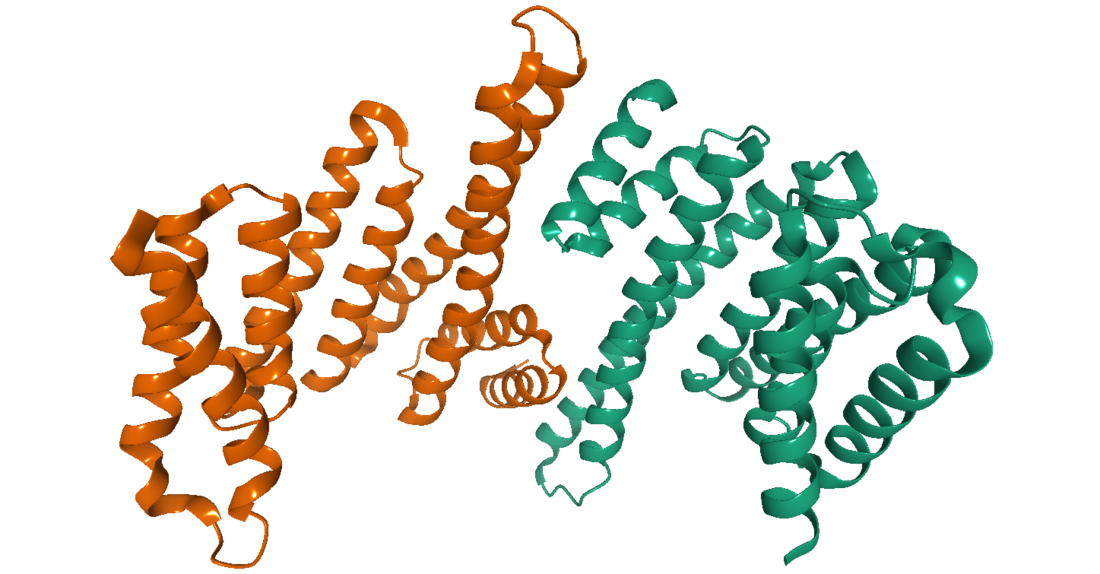14-3-3タンパク質
ウィキペディアから
14-3-3タンパク質(14-3-3タンパクしつ、英: 14-3-3 protein)は、すべての真核生物の細胞で発現している保存された調節分子のファミリーである。14-3-3タンパク質は、キナーゼ、ホスファターゼ、膜貫通受容体など、機能的に多様な多数のシグナル伝達タンパク質に結合する能力を持つ。200種類以上のシグナル伝達タンパク質が14-3-3のリガンドとなることが報告されている。
脳脊髄液中の14-3-3タンパク質レベルの上昇は、クロイツフェルト・ヤコブ病の徴候である可能性がある[2]。

性質
要約
視点
大部分の哺乳類には7種類の異なる14-3-3タンパク質をコードする遺伝子が存在し(ヒトの遺伝子に関しては下を参照)、シロイヌナズナでは13から15種類と推定され、酵母では2種類である[3][4]。
14-3-3タンパク質は構造的にはテトラトリコペプチドリピート(TPR)スーパーファミリーに類似しており、一般的には9本か10本のαヘリックスを持ち、通常はN末端のヘリックスの相互作用によってホモ二量体またはヘテロ二量体を形成する。これらのタンパク質には既知の修飾ドメインが多数含まれており、二価カチオンとの相互作用や、リン酸化、アセチル化、タンパク質分解による切断などが行われる領域が同定または予測されている[5]。
14-3-3はペプチドを結合する。14-3-3タンパク質の一般的な認識モチーフにはリン酸化セリンまたはスレオニン残基が含まれるが、リン酸化されていないリガンドも報告されている[6]。こうしたリガンドとの相互作用は両親媒的性質を持つ溝で行われる[6]。
| 標準的(cannonical)モチーフ |
R[^DE]{0,2}[^DEPG]([ST])(([FWYLMV].)
|([^PRIKGN]P)
|([^PRIKGN].{2,4}[VILMFWYP])) |
|---|---|
| C末端型モチーフ |
R[^DE]{0,2}[^DEPG]([ST])[^P]{0,1}$ |
| 非リン酸化型モチーフ |
IR[^P][^P]N[^P][^P]WR[^P]W[YFH][ITML][^P]Y[IVL] |
| モチーフは正規表現を用いて記されている。可読性のために改行が加えられ、リン酸化部位が太字で示されている。
モチーフはここに示されているパターンよりもはるかに多様であり、ニューラルネットワークを用いた予測も行われている[8]。 | |
発見と命名
14-3-3タンパク質は1967年に脳組織中に発見され、クロマトグラフィーとゲル電気泳動によって精製された。ウシの脳試料では、14-3-3タンパク質はDEAEセルロースカラムから溶出する14番目の分画に位置し、デンプン電気泳動ゲルでposition 3.3に位置していた[9]。
機能
14-3-3タンパク質はクラススイッチ組換えにおいてアイソフォーム特異的な役割を果たす。クラススイッチ組換えの媒介の際に、活性化誘導シチジンデアミナーゼと相互作用すると考えられている[10]。
CHEK1とCHEK2によるCDC25Cのリン酸化は、14-3-3ファミリーのリン酸化セリン結合タンパク質の結合部位を形成する。14-3-3の結合はCDC25Cの活性にほとんど影響を与えないが、CDC25Cを細胞質へ隔離し、G2/M期の移行時に核に局在しているサイクリンB-CDK1との相互作用を防ぐことで調節を行っていると考えられている[11]。
ヒトの遺伝子
- YWHAB – 14-3-3β
- YWHAE – 14-3-3ε
- YWHAG – 14-3-3γ
- YWHAH – 14-3-3η
- YWHAQ – 14-3-3θ
- YWHAZ – 14-3-3ζ
- SFN or YWHAS – 14-3-3σ (Stratifin)
14-3-3αと14-3-3δ(YWHAAとYWHAD)は、それぞれ14-3-3βと14-3-3ζ(YWHABとYWHAZ)のリン酸化型である。
植物
緑色植物亜界において14-3-3タンパク質の大きな遺伝子ファミリーが存在することは、植物の生理学におけるそれらの必要不可欠な役割を反映している。14-3-3タンパク質は細胞膜の自己阻害状態のP型ATPアーゼを活性化する。14-3-3タンパク質はATPアーゼのC末端の保存されたスレオニン残基に結合する[13]。
出典
関連文献
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.