長期増強
ウィキペディアから
神経科学の分野において、長期増強(ちょうきぞうきょう、英: Long-term potentiation、略称: LTP)は、神経細胞を同時刺激することにより2つの神経細胞間の信号伝達が持続的に向上する現象である[2]。神経細胞はシナプス結合を介して信号伝達しており、記憶はこのシナプスに貯えられていると信じられているので[3]、長期増強は学習と記憶の根底にある主要な細胞学的機構の1つであると広く考えられている[2]。

長期増強と長期記憶には多くの共通点が存在するため、長期増強は学習の細胞学的機構の有力な候補となっている。例えば、長期増強と長期記憶はともに、急速に開始され、新しいタンパク質の生合成に依存していて、連合性をもち、何か月もの持続が可能である[2]。長期増強は、すべての動物に見られる比較的単純な古典的条件づけから、ヒトに見られるより複雑な高次の認知までの、様々な種類の学習を説明する現象である可能性がある[2]。
シナプス伝達強度を増加させることで、長期増強はシナプス前細胞とシナプス後細胞がシナプスを介して信号伝達する能力を向上させる。長期増強は脳の領域やその動物の年齢、種類などにより異なる複数の機構で成り立っていることなどにより、その正確な機構は完全に分かっているわけではない。現在最もよく分かっている長期増強の形式は、シナプス前細胞から受け取られるシグナルに対するシナプス後細胞の感受性の増加によって、信号伝達が向上するものである[4]。このシグナルは神経伝達物質の形で、シナプス後細胞の膜表面にある神経伝達物質受容体に受け取られる。長期増強は多くの場合、シナプス後細胞の表面に既に存在する受容体の活動性を増加させるか、受容体の数を増加させることにより、シナプス後細胞の応答性を増加させる[4]。
長期増強は1966年に初めてテリエ・レモによりウサギの 海馬で発見され、それ以降多くの研究の対象となった。現在の長期増強の研究の大部分はこの現象の基礎生物学的理解に関するものだが、長期増強と行動学的学習の因果関係に関するものも存在する。さらに他にも、学習と記憶を向上させるために長期増強を強化するような薬理学的手法などの開発も行われている。また、長期増強は臨床研究の対象にもなっている。例えば、アルツハイマー型認知症や薬物依存に関する研究がそれにあたる。
歴史
要約
視点
学習の初期理論

19世紀の終わりに、科学者の間では成人の脳にある(約1000億[5]の)脳細胞の数が年齢に従って大きく増えることはないことが一般的に知られており、記憶は新しい神経細胞が生まれることにより生じるわけではないと考えられていた[6]。このことから、新しい神経細胞の形成を仮定することなしに記憶の形成を説明する理論が求められていた。
スペイン人の神経解剖学者のサンティアゴ・ラモン・イ・カハールは、新しい神経細胞の形成を仮定せずに学習のメカニズムを提唱した最初の人物である。1894年のクルーニアン講義において彼は、既に存在する神経細胞間の信号伝達効率が向上することにより、神経細胞の結合が強化されることで記憶が生じると提唱した[6]。ドナルド・ヘッブにより1949年に提唱されたヘッブの法則はカハールのアイディアに応えるものであり、神経細胞は新たな結合の形成や代謝の変化などにより、その信号伝達能力が向上するとした。
これらの記憶形成の理論は現在では確立しているものの、当時は注目されることは少なかった。19世紀後半から20世紀前半の神経科学者と心理学者間で、動物の学習の生物学的基盤を解明するのに必要な電気生理学手法がまだ確立していなかったためである。このような手法は20世紀後半に成立し、ちょうどその時期に長期増強も発見されたのであった。
長期増強の発見

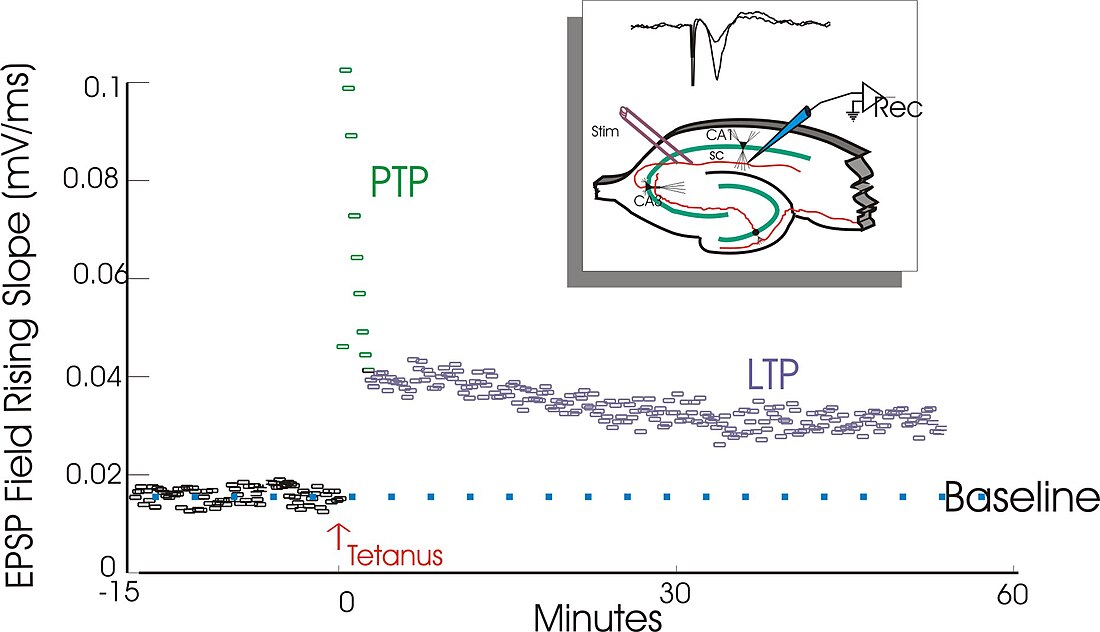
長期増強はテリエ・レモにより1966年にノルウェーのオスロにあるペール・アンデルセンの研究室で初めて発見された[7]。レモは麻酔下のウサギの短期記憶における海馬の役割に関する電気生理学実験を行っている所であった。
海馬の有孔質路と歯状回の 2 つの部分の神経結合を取り出し、レモは有孔質路の刺激によって生じる歯状回の電気生理学的変化を観察した。レモの予想通り、シナプス前線維である有孔質路線維の単一パルス刺激を行うと、歯状回のシナプス後細胞集団に興奮性シナプス後電位 (EPSP : excitatory postsynaptic potential) が起きた。しかしレモが予想もしなかったことに、シナプス後線維に高頻度刺激を行うと、上で示したようなシナプス後細胞集団の単一パルス刺激に対する応答が長期に渡って向上した。このような高頻度刺激を行った後の、単一パルス刺激に対するシナプス後細胞集団の興奮性シナプス後電位は強く、持続性のあるものであった。高頻度刺激によってシナプス後細胞集団の単一パルス刺激に対する応答性が長期に渡って向上するこの現象は、初めは "long-lasting potentiation" と呼ばれていた[8][9]。
アンデルセンの研究室に1968年に加わったティモシー・ブリス[7]は、レモと共同で1973年にウサギの海馬における "long-lasting potentiation" の特徴を初めて述べた論文を発表した[8]。さらに、ブリスとトニー・ガードナー・メドウィン (Tony Gardner-Medwin) は覚醒時の動物においてブリスとレモが発表したのと同様な "long-lasting potentiation" が起きるとする論文を発表した[9]。1975年に、ダグラス (Douglas) とゴダール (Goddard) はそれまで "long-lasting potentiation" と呼ばれていた現象を『長期増強 ("long-term potentiation") 』と呼ぶことを提唱した[10][11]アンダーソンは "long-term potentiation" の頭字語である "LTP" が発音しやすいことから、"long-term potentiation" という呼称を論文の著者達に勧めたとされている[12]。
長期増強の種類
ウサギの海馬における最初の発見以来、長期増強は大脳皮質、小脳、扁桃体[13]などの様々な神経構造で見つかっている。長期増強の代表的な研究者の1人であるロバート・マレンカは長期増強は哺乳類の持つ全ての興奮性シナプスで起きているとしている[4]。
異なる脳領域では、長期増強の形も異なっている。神経細胞間で起きる長期増強の種類は多くの要素に依存している。その要素の1つとして、長期増強が観察される時の生物の年齢がある。例えば、未成熟な海馬の長期増強の分子機構は大人の海馬のそれとは異なっている[14]。また、特定の細胞が用いる信号伝達経路によっても異なる種類の長期増強が起きている。例えば、ある海馬の長期増強にはNMDA型グルタミン酸受容体によるもの、代謝型グルタミン酸受容体 (mGluR : metabotropic glutamate receptor) によるもの、さらにまったく別の受容体によるものがある[4]。長期増強に寄与する様々な種類の信号伝達経路と、この様々な経路の脳における幅広い分布は、神経細胞間で起きる長期増強の種類が、長期増強を観察する脳の部位によって一部異なっていることの理由になっている。例えば、海馬にあるシェファー側枝経路で起きる長期増強はNMDA型グルタミン酸受容体依存性である一方、苔状線維経路における長期増強はNMDA型グルタミン酸受容体非依存性である[15]。
導入が容易であることから、海馬のCA1における長期増強は哺乳類の長期増強研究の基本的なものになっている。特に大人の海馬のCA1におけるNMDA型グルタミン酸受容体依存性長期増強は最も広く研究されている長期増強である[4]。したがって本記事でもこの種の長期増強について主に解説する。
長期増強の特性
NMDA 型グルタミン酸受容体依存性長期増強は主に入力依存性、連合性、共同性の3つの特性を示すとされている。
- 入力特異性
- 一度誘導されたら、1 つのシナプスにおける長期増強は他のシナプスに広がることはない。つまり長期増強は入力特異的である。長期増強は連合性と共同性のみによって伝播する。しかし、短い距離における長期増強の入力特異性は完全ではない。
- 連合性
- 「連合性」は、1 つのシナプスにおける刺激が長期増強を引き起こすのに十分な強さではなかったとしても、別のシナプスからの強い刺激が同時に起きることによって長期増強が起きるという特性である。
- 共同性
- 長期増強は 1 つのシナプス経路の強いテタヌス刺激か、複数の経路の弱い刺激が共同して行われることにより起きる。弱い刺激が1つのシナプスから起きた場合、生じる脱分極は長期増強を引き起こすのには不十分である。しかし、弱い刺激が複数のシナプスからシナプス後膜の一部に集中して起きた場合、個々の脱分極が集まって長期増強を引き起こすのに十分な脱分極が起きる。 後述するシナプティック・タギング (synaptic tagging) は連合性と共同性の根底にある共通した機構であるとされている。
特に、ブルース・マクノートンは連合性と共同性の違いは語義の問題に過ぎないとしている[16]。
長期増強のメカニズム
要約
視点
長期増強は神経系のいたる所で様々な機構によって起きる。したがって、多くの種類の長期増強の全てを統一して説明するような単一の機構というものは存在しない。しかし研究のために、長期増強は一般的に短期増強 (STP : short-term potentiation) 、前期長期増強 (early LTP)、後期長期増強 (late LTP) の、順番に起きる3種類の段階に分けられる[17]。短期増強についてはまだよく分かっていないため[17]、ここでは解説しない。
長期増強のそれぞれの段階は、その段階を指令するメディエーター (mediator) と呼ばれる小分子によって支配されている[4]。これらの分子の中には細胞外の出来事に応答するタンパク質受容体や、細胞間の化学反応を実行する酵素、1 つの段階から次の段階への進行を行うシグナリング分子などがある。これらのメディエーターに加え、メディエーターと相互作用して、長期増強を最終的な形へと調整する調節分子 (modulator molecule) が存在する。調節分子に関しては後で解説する。
前期長期増強 (E-LTP) と後期長期増強 (L-LTP) はさらに誘導 (induction)、維持 (maintenance)、発現 (expression) の3種類の出来事に分けられる。まず誘導とは、長期増強のその段階が始まる引き金となる短期間のシグナルの処理のことを示す。次に維持とは、誘導に対する応答として起きる持続的な生化学的変化に相当する。最後に発現とは、維持シグナルの活性化の結果として起きる長期持続性の細胞変化のことを示す[17]。したがって長期増強の機構について、前期長期増強 (E-LTP) と後期長期増強 (L-LTP) の誘導、維持、発現におけるメディエーターの観点から解説を行う。
前期長期増強


誘導
前期長期増強の誘導は、シナプス後細胞内のカルシウム濃度が閾値を超えたときに起きる[18]。多くの種類の長期増強において、カルシウム濃度変化にはNMDA型グルタミン酸受容体が必要とされるので、これらの種類の長期増強はNMDA型グルタミン酸受容体依存性であると考えられる[18]。NMDA型グルタミン酸受容体依存性長期増強のは 2 つの神経細胞間の結合に対して高頻度刺激を数回行うことで実験的に誘導することが出来る[19]。通常のシナプス伝達を理解することにより、どのようにしてこのテタヌス刺激により前期長期増強の誘導が起きるのかが説明できる。
化学シナプスは、神経系のいたる所に存在する神経細胞間の機能的結合である。一般的なシナプスでは、情報はシナプス前細胞からシナプス伝達と呼ばれる過程を経てシナプス後細胞へと伝えられる。実験操作において、シナプス前細胞にパルス刺激を行うと、神経伝達物質(例えば、グルタミン酸)がシナプス後膜へと放出される。放出されたグルタミン酸はシナプス後膜に埋め込まれているAMPA型グルタミン酸受容体 (AMPAR : AMPA receptor) に結合する。AMPA型グルタミン酸受容体は脳にある主な興奮性受容体の1つで、その時々の急速な興奮性活動を引き起こす[20]グルタミン酸がAMPA型グルタミン酸受容体に結合することによりシナプス後細胞へナトリウムイオンが流入し、興奮性シナプス後電位 (EPSP : excitatory postsynaptic potential) と呼ばれる短時間の脱分極が起きる。
この脱分極の強さは、前期長期増強がシナプス後細胞で誘導されるか否かを決定する。1つの刺激では前期長期増強を誘導するのに十分な脱分極を起こせなくても、高頻度の反復した刺激によって興奮性シナプス後電位の時間的加重 (EPSP summation) を起こすことで漸次的に強い脱分極を起こさせることができる。興奮性シナプス後電位の加重とは、前の興奮性シナプス後電位による脱分極が減少しきる前に、次の興奮性シナプス後電位がシナプス後細胞に到着することにより、さらに強い脱分極を起こす現象である。NMDA型グルタミン酸受容体依存性長期増強を示すシナプスでは、十分な脱分極によりNMDA型グルタミン酸受容体 (NMDAR : NMDA receptor) が解放され、受容体にグルタミン酸が結合した際にカルシウムの細胞内への流入が起きる。シナプス後膜にあるほとんどのNMDA型グルタミン酸受容体は静止膜電位時にマグネシウムイオンによってブロックされ、シナプス後細胞へのカルシウムの流入が阻害されている。興奮性シナプス後電位の加重による十分な脱分極により、NMDA型グルタミン酸受容体がマグネシウムのブロックから解放され、カルシウムの流入が生じることとなる。細胞内カルシウム濃度の急激な上昇は、前期長期増強の誘導を仲介する酵素の短期間の活性化の引き金となる。中でも特に重要なのはカルシウム/カルモジュリン依存性プロテインキナーゼII (CaMKII: calcium/calmodulin-dependent protein kinase II) や プロテインキナーゼC (PKC: protein kinase C) などのいくつかのプロテインキナーゼである[17]。それ以外の酵素として、プロテインキナーゼA (PKA : protein kinase A) や 分裂促進因子活性化タンパク質キナーゼ (MAPK: mitogen-activated protein kinase) も前期長期増強の誘導に寄与している[17]。
維持
前期長期増強の誘導の結果、CaMKIIとPKCの「一時的」な活性化が起きる。前期長期増強の維持ではそれらの酵素の「持続的」な活性化が行われる。この段階では、カルシウム非依存性のプロテインキナーゼMζ (PKMz: Protein kinase Mζ) が自律的に活性化する。その結果、前期長期増強の発現に必要なリン酸化が起きる[17]。
発現
リン酸化とは小さいリン酸基が他の分子に結合することで、その分子の活性を変化させる化学反応である。自律的に活性化したCaMKIIとPKCによるリン酸化によって、前期長期増強の発現の2つの主要な機構が実行される。初めに、最も重要なプロセスとして、この2つの酵素によるAMPA型グルタミン酸受容体のリン酸化による活動の上昇が起きる[4]。次に、この2つの酵素による仲介、または調節により、AMPA型グルタミン酸受容体のシナプス後膜への挿入が起きる[4]。重要なことに、前期長期増強におけるAMPA型グルタミン酸受容体のシナプスへの輸送はタンパク質生合成非依存性である。この現象は、シナプス後膜付近にある小胞に貯えられたAMPA型グルタミン酸によって起きる。前期長期増強を引き起こすのに適切な刺激が到着した際に、小胞にあるAMPA型グルタミン酸受容体はプロテインキナーゼの影響を受けて即座にシナプス後膜に輸送される[21]。前述した通り、AMPA型グルタミン酸受容体は脳の中にある最も豊富なグルタミン酸受容体であり、大部分の興奮性活動を仲介している。AMPA型グルタミン酸受容体の活動性や膜上の数を増加させることにより、次に来る興奮性刺激はシナプス後細胞において強い応答を引き起こす。
上で示したモデルは前期長期増強の誘導、維持、発現のシナプス後膜における変化を述べたものであるが、シナプス前膜でも発現の段階において変化が起こっている[22]。シナプス前細胞における反応の仮説として、前期長期増強の際のCaMKIIの持続的な活性化によって後述する逆行性メッセンジャー (retrograde messenger) の生合成が起きるというものがある。この仮説によると、新しく合成されたメッセンジャーがシナプス後細胞からシナプス前細胞へとシナプス間隙を横断して、次の刺激に対するシナプス前細胞の応答性を上げるいくつかの反応を引き起こす。この反応は、神経伝達物質小胞体の数や、神経伝達物質の放出確率の増加などであると考えられる。逆行性メッセンジャーは前期長期増強に加えて、後期長期増強の発現でも役割を担っていると考えられている。
後期長期増強

前期長期増強の延長上に、後期長期増強が存在する。タンパク質生合成非依存的な前期長期増強とは違い、後期長期増強はシナプス後細胞における遺伝子の転写[23]とタンパク質生合成[24]を必要とする。後期長期増強には、タンパク質生合成に依存する段階と、遺伝子の転写とタンパク質生合成の両方に依存する段階の2つの段階が存在する[18]。これらの段階をそれぞれLTP2とLTP3と呼び、前期長期増強をLTP1と呼ぶことがある。
誘導
前期長期増強の際のMAPKなどのプロテインキナーゼの持続的な活性化によって引き起こされた、遺伝子発現やタンパク質生合成の変化によって、後期長期増強は誘導される[17][25][18]。実際、MAPK、特にその下位ファミリーであるERKは前期長期増強と後期長期増強を繋ぐ分子であるとされている。これは、CaMKIIやPKCを含む、多くの前期長期増強の信号伝達の流れが細胞外シグナル制御キナーゼへと収束しているためである[25]。最近の研究によって、後期長期増強の誘導は、cAMP応答配列結合タンパク質 (CREB : cAMP response element binding protein) の強力な転写共役因子 (transcriptional coactivator) であるCRTC1 (TORC1) へと収束する分子的な現象である、PKAの活性化とカルシウムの流入が同時に起きることに依存することが示されている[26]。この2つの現象が同時に起きることが必要とされることは、長期増強、ひいては学習がもつ連合性という性質の完璧な説明となる。
維持
神経細胞が活動した際、細胞外シグナル制御キナーゼは多数の細胞質分子と核内分子をリン酸化し、最終的に後期長期増強において観察されるタンパク質生合成と細胞の形態的変化を引き起こす[18]。このような細胞質分子と核内分子には、CREBのような転写因子がある[17]。細胞外シグナル制御キナーゼを介して起きる転写因子の活性の変化は、後期長期増強の維持に関わるタンパク質の生合成の引き金となる。このようなタンパク質の例としてPKMζと呼ばれる長期増強の誘導の後に生合成が増加し、持続的に活性化するキナーゼがある[27][28]。PKMζはPKCの特殊なアイソフォームで、調節ユニットを失っているために構成的活性化が起きたままになっている[27]。長期増強を仲介する他のキナーゼと違い、PKMζは長期増強の誘導から初めの30分は活性がなく、長期増強の後半の段階である長期増強の維持に必要なキナーゼである[27]。したがって、PKMζは記憶の持続に重要であり、長期記憶の維持に重要であると見られている。実際、ラットの海馬にPKMζ阻害剤を導入することにより、短期記憶を阻害することなく逆行性健忘を起こさせることができる[28](PKMζは短期記憶の成立には関与していない)。PKMζは最近、後期長期増強の発現に関わるシナプス足場タンパク質の輸送の指令や再編成によって後期長期増強に関わっていることが示されている[27][28]。
発現
PKMζの他に、数種類のタンパク質が後期長期増強の際に合成されていることが知られている。これらはその種類に関係なく、後期長期増強における樹状突起棘の数や表面積、シナプス後細胞の神経伝達物質に対する応答性などの増加に寄与していると考えられている[18]。この内の神経伝達物質に対する応答性の増加は、後期長期増強の際のAMPA型グルタミン酸受容体の生合成の増加による面がある[18]。後期長期増強はシナプス前細胞におけるシナプトタグミンの生合成とシナプス小胞の数の増加とも関連付けられることから、後期長期増強によってシナプス後細胞だけではなくシナプス前細胞でもタンパク質の生合成が誘導されることが示唆される[18]。前述の通り、シナプス後細胞における長期増強の誘導により、シナプス前細胞でタンパク質の生合成が起きるためには、シナプス後細胞からシナプス前細胞への信号伝達が必要である。この信号伝達は後述する逆行性メッセンジャーの生合成によるものであると考えられている。
シナプス後細胞における反応に限っても、後期長期増強を行うタンパク質の生合成が起きる場所は特定されていない。特に、タンパク質の生合成が起きるのが細胞体か樹状突起かも定かではない[25]。1960年代に、樹状突起において(タンパク質の生合成メカニズムの重要な要素である)リボソームが発見されたにもかかわらず、神経細胞におけるタンパク質の生合成が主に行われるのは細胞体であるという考えが優勢であった[25]。1980年代に、細胞体との結合が断たれた樹状突起でもタンパク質の生合成が起きることが示されるまでは、この考えに挑む者はいなかった[25]。より最近になって、この種の局所的なタンパク質の生合成がある種の長期増強に必要であることが示されている[29][30]。
局所的なタンパク質の生合成による長期増強の仮説が有力になりつつある理由として、長期増強における入力特異性の機構を説明できる点がある[25]。もし実際に後期長期増強に局所的なタンパク質の生合成が関わっているとすれば、長期増強を誘導するような刺激を受けた樹状突起棘のみで長期増強が起き、隣接するシナプスに長期増強が伝播することはない。一方、細胞体における広範囲のタンパク質の生合成では、長期増強を誘導するような刺激を受け取っていないシナプスを含めた、細胞の隅々までタンパク質を輸送することが必要になる。局所的なタンパク質の生合成による長期増強の仮説は入力特異性のメカニズムを説明できる一方で、広範囲のタンパク質の生合成による仮説は分が悪いようにも見える。しかし、後述するシナプティック・タギング仮説により、広範囲のタンパク質の生合成でもシナプス特異性と、さらに連合性が説明できる。
逆行性シグナリング
逆行性シグナリングとは、シナプス後細胞で誘導、発現した長期増強がシナプス前細胞でも発現することを説明しようとする仮説である[4][22][31]。この仮説の名前は、通常のシナプス伝達はシナプス前細胞からシナプス後細胞へと一方向的に伝わることから付けられた。シナプス後細胞で長期増強が誘導され、シナプス前細胞でも長期増強が発現するには、何らかの信号がシナプス後細胞からシナプス前細胞へと『逆行』しなくてはならない。その信号によりシナプス前細胞における反応の連鎖が開始され、神経伝達物質の放出確率の増加などのシナプス前細胞における長期増強の発現が起きると考えられる[32]。
長期増強の発現におけるシナプス前細胞の寄与を認めない研究者などにとって、逆行性シグナリングは論争の対象となっている[4]。仮説の支持者の間でさえも、逆行性メッセンジャー種類については論争が存在する。初期の考えでは一酸化窒素に焦点が集まっていたが、最近の研究により細胞接着タンパクが重要であるとみられている[4]。
シナプティック・タギング
局所的なタンパク質の生合成の仮説が十分な支持を得る以前は、長期増強に関わるタンパク質の生合成は細胞体で起きていると一般的に考えられてきた。さらに、この生合成によって作られたタンパク質は細胞全体へと非特異的に運ばれると考えられていた。したがって、長期増強のもつ入力特異性と矛盾することなくどのようにして細胞体でタンパク質が生合成されるのかを説明する仮説が必要とされた。シナプティック・タギングは細胞体で合成されたタンパク質が、長期増強を誘導する刺激を受け取ったシナプスにのみ輸送されることを可能にする仮説である。
シナプティック・タギング仮説によると、長期増強を誘導するような刺激を受け取ったシナプスで『シナプティック・タグ』が合成され、細胞全体に輸送されたシナプス可塑性に関わるタンパク質をこのタグが捕捉する[33]。ジャンボアメフラシと呼ばれるウミウシの長期増強に関する研究から、シナプティック・タギングが長期増強の入力特異性のメカニズムであることが示唆されている[34][35]。例えば、2つの遠く離れたシナプスがあるとする。長期増強を誘導する刺激を1つのシナプスに行うと(前述したような)いくつかの信号の連鎖が起き、細胞の核で遺伝子の発現が開始される。この時に、刺激を受けたシナプスでは、短時間(3時間以内)で分解されるシナプティック・タグが局所的に合成される。遺伝子発現によって作られたタンパク質は細胞全体に輸送されるが、シナプティック・タグが発現したシナプスでのみ捕捉される。したがって、長期増強を誘導する刺激を受け取ったシナプスのみが増強され、長期増強の入力特異性が生まれる。
シナプティック・タギング仮説は長期増強の持つ連合性と共同性も説明できる。連合性(「#長期増強の特性」を参照)は、長期増強を誘導するに十分な刺激が1つのシナプスで起きている時に、他のもう1つのシナプスが弱く刺激された時に起きる。(後者のシナプスに行った刺激は長期増強を引き起こすには不十分であるため)前者の強く刺激されたシナプスでのみ長期増強が起きると一見考えられるが、実際には「両方」のシナプスで長期増強が起きる。弱い刺激では細胞体におけるタンパク質の生合成を引き起こすことは不可能だが、シナプティック・タグの生合成を引き起こす。同時に強い刺激を他のシナプスに行うことにより、細胞体でタンパク質の生合成が起き、シナプス可塑性に関わるタンパク質が細胞全体に輸送される。 両方のシナプスでシナプティック・タグが発現しているので、両方のシナプスでタンパク質が捕捉される。その結果、強く刺激されたシナプスと弱く刺激されたシナプスの両方で長期増強が起きる。
共同性は2つのシナプスが、それぞれのみでは長期増強を引き起こすのに不十分なほど弱く刺激された時に見られる。弱い刺激が同時に起きることで、両方のシナプスで長期増強が共同的に起きる。シナプティック・タギング仮説は複数の弱い刺激がどのようにして長期増強を誘導するのに十分な刺激になるのかを説明はしない(これは前述した興奮性シナプス後電位の空間的加重によるものである)。むしろシナプティック・タギングは、それぞれのみでは長期増強を引き起こすのに不十分なシナプスに対して、どのようにしてタンパク質の生合成の産物を輸送するのかを説明する。前述の連合性と同様に、この輸送は弱い刺激によって発現したシナプティック・タグによって行われる。
長期増強の調節
| 調節因子 | 標的 |
|---|---|
| β-アドレナリン受容体 | cAMP, MAPK |
| 一酸化窒素合成酵素 | グアニルシクラーゼ, PKG, NMDAR |
| ドーパミン受容体 | cAMP, MAPK |
| 代謝型グルタミン酸受容体 | PKC, MAPK |
前述の通り、長期増強に関わる分子はメディエーターと調節因子に分けられる。長期増強のメディエーターはNMDA型グルタミン酸受容体やカルシウムのような、その分子の存在や活性がほとんどすべての条件において長期増強に必要な分子のことである。一方、調節因子は長期増強に影響を与えるが、長期増強の発生や変化には必要ではない分子である[4]。
上で示したシグナリング経路に加えて、海馬の長期増強は多くの調節因子の影響を受ける。例えば、ステロイドホルモンのエストラジオールはCREBのリン酸化とそれに続く樹状突起棘の成長を引き起こすことで長期増強を強化する[36]。加えて、β-アドレナリン受容体のアゴニストであるノルアドレナリンなどは、タンパク質生合成依存である長期増強の後半段階を変化させる[37]。また、一酸化窒素合成酵素の活性化は、グアニルシクラーゼとプロテインキナーゼG (PKG) を活性化する[38]。同様に、ドーパミン受容体の活性化はcAMP/PKAシグナリング経路を通して長期増強を強化する[39][40]。
行動学的な記憶との関連
要約
視点
細胞培養下におけるシナプスの長期増強は記憶と学習の基盤を説明できると一見思われるかもしれない。しかし、長期増強の行動学的学習 (つまり生物レベルの学習) に対する寄与に、in vitroの研究結果を単純に適用することは出来ない。このことから、動物の記憶と学習に長期増強が必要であることを示すために、多くの研究が行われている。
空間記憶

1986年にリチャード・G・モリスは長期増強が記憶の形成に実際に必要であることをin vivoで示した[41]。モリスは空間記憶における役割が確立している脳構造である海馬を、薬理学的に操作したラットの空間記憶能力を試験した。ラットはモリスの水迷路課題と呼ばれる、濁った水槽の中を水中に隠されたプラットホームに向かって泳がせる空間記憶課題で事前に訓練してあった。訓練の際に通常のラットは、水中に隠されたプラットフォームの位置と水槽の壁の特定の位置にある目印とを関連付ける。事前の訓練の後、ラットの1グループにはNMDA型グルタミン酸受容体ブロッカーであるAPVを海馬に投与し、もう一方のグループは対照群とした。そしてその後に、両方のグループでもう一度モリスの水迷路課題を行った。対照群のラットはプラットホームの位置を覚えプールから上がったが、APVを投与されたラットでは課題の成績が有意に低下していた。加えて、両方のグループの海馬の切片を比較したところ、対照群のラットの海馬切片では容易に長期増強が誘導されたのに対して、APVを投与されたラットの海馬切片では誘導することができなかった。この結果はNMDA型グルタミン酸受容体、さらには長期増強が少なくともある種の記憶と学習に必要であることを示した初期の研究である。
同様に、利根川進は1996年に生体のマウスにおける空間記憶に海馬のCA1と呼ばれる領域が必要不可欠なことを示した[42]。この領域にある場所細胞 (place cell|) と呼ばれる細胞はマウスがある空間における特定の場所(場所受容野 place fieldと呼ばれる領域)に来た時にのみ選択的に発火する。この場所受容野はその空間全体に分布していて、場所細胞のグループで海馬内に地図を作っていると解釈されている。この地図の正確性はマウスの空間の学習能力を決定している。利根川はCA1領域のNMDA型グルタミン酸受容体のNR1サブユニットを遺伝子的に除去することにより、受容体を特異的に阻害することで、場所細胞の反応選択性が対照群より低下することを示した。予想通り、このマウスは対照群に比べて空間記憶課題の成績が低下しており、長期増強の空間記憶における役割を支持する結果となった。
海馬のNMDA型グルタミン酸受容体の活性を強化することで、長期増強を強化し、空間記憶を向上させることができる。2001年にジョー・Z・チェンは海馬のNMDA型グルタミン酸受容体のNR2Bサブユニットを過剰発現させることで受容体の機能を強化したマウスを作り出した[43][44]。その結果出来た賢いマウスはドラマの天才少年ドギー・ハウザーの主人公、ドギーハウザーにちなんで "ドギー・マウス" (Doogie mice) というニックネームがつけられた。このマウスは強化された長期増強と優れた空間記憶能力を持ち、海馬依存性の記憶における長期増強の重要性をさらに証明した。
抑制性回避
2006年に、ジョナサン・ウィットロック (Jonathan Whitlock) らは長期増強が行動学的記憶に関わっていることを示す、新たな実験を報告した[45]。明室と暗室の2つの部屋のある小屋にラットを入れ、(ラットが通常好む)暗室にラットが入ると足元に弱い電気刺激が流れることを学習させる抑制性回避 (inhibitory avoidance) 学習課題が実験では用いられた。その結果、海馬のCA1のシナプスにおいて、抑制性回避課題によりイン・ビトロの長期増強で起きるのと同様なAMPA型グルタミン酸受容体のリン酸化がイン・ビボでも起きていることが示された。加えて、課題の間に増強されたシナプスは、実験操作によってさらに長期増強を起こすことが出来ないことも示された。この論文に対してティモシー・ブリスらは、「(これら一連の実験は)長期増強が記憶の神経基盤であることを示すための新たな一歩である」と述べている[46]。
臨床面での重要性
アルツハイマー型認知症

長期増強は、著しい認知機能の低下と認知症を引き起こす神経変性疾患であるアルツハイマー型認知症 (AD : Alzheimer's disease) を研究する人々の間で注目を集めている。この変性の多くは海馬と他の側頭葉内側部で起きる。海馬は長期増強における役割が確立しているので、アルツハイマー型認知症における認知機能の低下は長期増強の障害によるものであると示唆する者もいる。
2003年の総説論文において、ローワン (Rowan) らは長期増強がどのようにしてアルツハイマー型認知症に影響を及ぼすかに関するモデルを提唱した[47]。アルツハイマー型認知症の原因の少なくとも一部はアミロイド前駆体タンパク質 (APP : amyloid precursor protein) の異常な処理によるものであると考えられている。その結果、このタンパク質の断片であるアミロイドβ (Aβ : amyloid β) の蓄積が起きる。アミロイドβには可溶型 (soluble form) と繊維型 (fibrillar form) が存在する。ローワンの説によれば、アミロイド前駆体タンパク質の間違った処理により、可溶型アミロイドβの蓄積が起き、海馬の長期増強が阻害されることでアルツハイマー型認知症の認知機能の低下が引き起こされるとされている。
アミロイドβとは異なった原因でも、アルツハイマー型認知症により長期増強が阻害される。例えば、アルツハイマー型認知症のマーカーである神経原線維変化においてPKMζの蓄積が起きている。このPKMζは後期長期増強の維持に決定的に重要な酵素である[48]。
薬物依存症
依存性薬物の研究においても、長期増強に注目が集まっている。これは薬物依存症において、記憶や学習が強く形成されているという仮説があるためである[49]。依存症は複雑な神経行動学的現象であり、腹側被蓋野 (VTA : ventral tegmental area) や側坐核 (NAc : nucleus accumbens) などの多くの脳部位が関わっている。腹側被蓋野と側坐核のシナプスで長期増強が起きることが示されており[49]、この長期増強が依存症特有の行動を引き起こしていると考えられる[50]。
脚注
推奨文献
関連項目
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.