モノアミン酸化酵素B
ウィキペディアから
モノアミン酸化酵素B(モノアミンさんかこうそB、モノアミンオキシダーゼB、英: monoamine oxidase B、略称: MAO-B)は、ヒトではMAOB遺伝子にコードされる酵素である。
MAO-Bはフラビンモノアミンオキシダーゼファミリーに属し、ミトコンドリア外膜に位置している。生体物質や生体異物のアミンの酸化的脱アミノ化を触媒し、中枢神経系や末梢組織において神経作動性や血管作用性を有するアミンの異化に重要な役割を果たしている。このタンパク質はベンジルアミンやフェネチルアミンを選択的に分解する[5]。モノアミン酸化酵素A(MAO-A)と同様に、ドーパミンも分解する(ただし一部の研究ではこれに反する結果が得られており、MAO-Bはドーパミンを直接的には分解せず、GABAの合成を担っていることが示唆されている[6])。
構造と機能
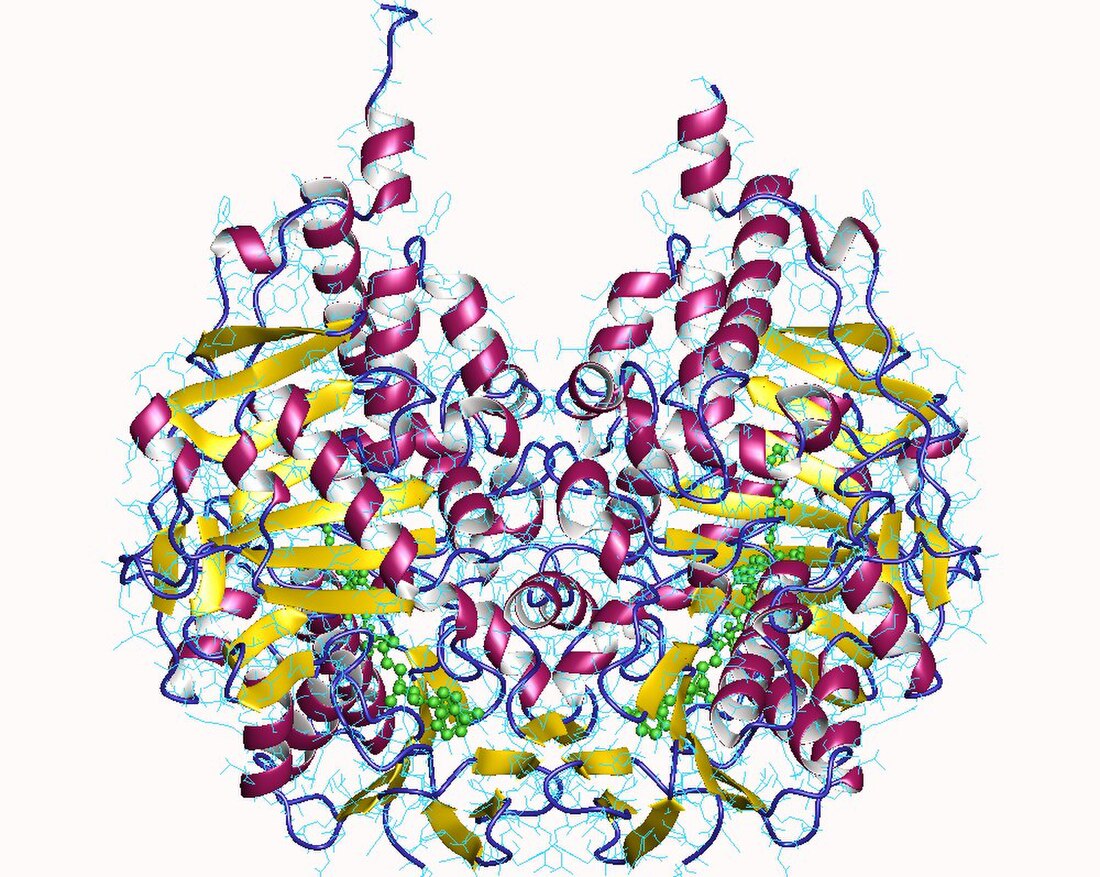
MAO-Bの基質結合部位には2つの部分からなる疎水的で細長い形状のくぼみが存在し、「開いた」コンフォメーションではこのくぼみの総体積は700 Å3近くになる。一方、MAO-Aの基質結合部位のくぼみは1つの部分からなる丸い形状であり、体積はMAO-Bのものよりも大きい[7]。
MAO-Bの2つのくぼみはentrance cavity(約290 Å3)、substrate cavity(active site cavity、約390 Å3)と呼ばれており、Ile199の側鎖が両者の間でゲートとして機能している。基質または阻害剤の結合によって「開いた」または「閉じた」形状のいずれかの状態となり、このことが阻害剤のMAO-B特異性に重要であることが示されている。Substrate cavityの末端には補因子のFADが位置しており、aromatic cageと呼ばれる2つのほぼ平行なチロシン残基(398と435)とフラビンによってアミンの結合に適した部位が形成されている[7]。
MAO-Aと同様に、MAO-Bは一級アリールアルキルアミンに対する酸素依存的酸化反応を触媒する[8]。反応産物は対応するアルデヒド、過酸化水素、アンモニアである。
- Amine + O2 + H2O → Aldehyde + H2O2 + NH3
この反応は三段階で進行すると考えられている。まず、アミンが対応するイミンに酸化され、FADがFADH2へ還元される。続いて、酸素がFADH2から2つの電子と2つのプロトンを受容して過酸化水素が形成され、FADが再生される。最後に、イミンが水分子によって加水分解され、アンモニアとアルデヒドが形成される[7][9]。
MAO-Aとの差異
MAO-Aはチラミンの代謝に関与しているため、MAO-Aの阻害、特に不可逆的阻害は、チーズなどチラミンを多く含む食品を摂取した際に血清チラミン濃度の上昇による高血圧症状の原因となる場合がある(この作用は俗に「チーズ効果」("cheese effect")と呼ばれている)。MAO-Aはセロトニン、ノルアドレナリン、ドーパミンの代謝に関与し、MAO-Bは主にドーパミンを代謝する[10]。特定の疾患の治療に際しては両者の基質選択性の差異が利用され、MAO-A阻害薬はうつ病の治療に、そしてMAO-B阻害薬はパーキンソン病の治療に利用されるのが典型的である[11][12]。
疾患と老化における役割
アルツハイマー病とパーキンソン病は、どちらも脳内のMAO-B濃度の上昇と関連している[13][14]。MAO-Bの正常な活性は活性酸素種の形成をもたらし、細胞を直接的に傷害する[15]。MAO-B濃度は年齢とともに上昇することが示されており、加齢に伴う認知機能の低下や神経疾患の発症可能性の増大に関与していることが示唆される[16]。MAOB遺伝子の高活性型多型は負の情動性と関連しており、抑うつの根底因子として疑われている[17]。また、MAO-Bの活性はストレスによる心損傷にも関与していることが示されている[18][19]。脳内でのMAO-Bの過剰発現や濃度の上昇は、γ-セクレターゼを介した機構によってアミロイドβ(Aβ)の蓄積と関連している。γ-セクレターゼはアルツハイマー病やパーキンソン病の患者にみられるプラークの形成を担っている。siRNAによるMAO-BのサイレンシングやMAO-B選択的阻害薬(セレギリン、ラサギリン)による阻害は、脳内のAβプラークの減少といった、アルツハイマー病やパーキンソン病と関係した症状の進行の低下や改善をもたらす可能性がある[20][21]。
動物モデル
MAO-Bを産生することができないトランスジェニックマウスは、パーキンソン病モデルに対して抵抗性を示すことが示されている[22][23][24]。また、ストレスに対する応答性の増加(これはMAO-Aノックアウトマウスでもみられる)[25]やβ-フェネチルアミンの増加も示す[23][25]。さらに、行動の脱抑制や不安関連行動の低下もみられる[26]。
ラットでは、MAO-Bの阻害によって視神経変性など加齢と関連した多くの生物学的変化が防がれることが示されており、寿命も最大で39%伸長する[27][28]。
ヒトでの欠損の影響
MAOA遺伝子の欠損は境界知能と異常行動をもたらし、またMAOAとMAOBをともに欠損している場合には重度の知的障害となるのに対し、MAOBのみを欠損している場合には尿中フェネチルアミン濃度の上昇を除いて異常はみられない[29]。フェネチルアミンやその他の微量アミンの重要性を示す研究もあり、これらはアンフェタミンと同じ受容体TAAR1を介してカテコールアミンやセロトニンによる神経伝達を調節していることが知られている[30]。
健康な人物において自然な加齢を遅らせることを目的としたMAO-B阻害薬の予防的使用が提唱されているものの、依然として多くの議論のあるトピックである[31][32]。
選択的阻害剤



種依存的な多様性が阻害効力の外挿の障害となる場合がある[33]。
可逆的
天然物
合成化合物
- サフィナミドとそのアナログ[39]
- 5H-Indeno[1,2-c]pyridazin-5-ones[33][40][41]
- カルコン誘導体[42]
- 2-(N-Methyl-N-benzylaminomethyl)-1H-pyrrole[43]
- 1-(4-Arylthiazol-2-yl)-2-(3-methylcyclohexylidene)hydrazine[44]
- 2-チアゾリルヒドラゾン[45]
- 3,5-ジアリールピラゾール[46]
- ピラゾリン誘導体[47][48]
- いくつかのクマリン誘導体[49][33]
- フェニルクマリンとそのアナログ[50][51][52][53]
- クロモン-3-フェニルカルボキサミド[54]
- イサチン[55]
- フタルイミド[56]
- 8-ベンジルオキシカフェイン[57][58]および8-(3-クロロスチリル)カフェインアナログ[59]
- (E,E)-8-(4-phenylbutadien-1-yl)caffeines(A2A受容体に対するアンタゴニスト作用も有する)[60]
- インダゾール-5-カルボキサミドおよびインドール-5-カルボキサミド[61]
不可逆的(共有結合)
出典
関連項目
Wikiwand - on
Seamless Wikipedia browsing. On steroids.