トップQs
タイムライン
チャット
視点
ファージセラピー
ウィキペディアから
Remove ads
ファージセラピーはバクテリオファージを用いた細菌感染症の治療法である[1]。 以前は、1920年頃の旧ソビエト連邦で広く使用・研究されていたが、ロシアおよびグルジア以外の国でこの治療法は用いられていない。ファージセラピーは医学のみならず、歯学、獣医学、農学などの分野にも応用できる可能性がある[2]。 ファージセラピーによる治療の対象が動物ではない場合、「生物的防除」 という用語が一般に用いられ、ファージセラピーと呼ばれることはあまりない。
この項目「ファージセラピー」は翻訳されたばかりのものです。不自然あるいは曖昧な表現などが含まれる可能性があり、このままでは読みづらいかもしれません。(原文:en:Phage therapy (10:01, 28 January 2014 UTC)) 修正、加筆に協力し、現在の表現をより自然な表現にして下さる方を求めています。ノートページや履歴も参照してください。(2014年3月) |

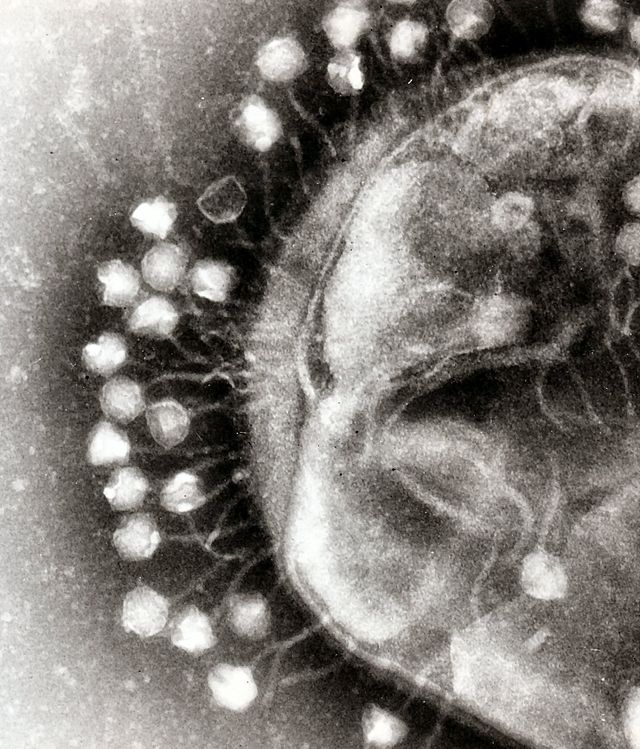
バクテリオファージは抗生物質に比べてより特異的である。そのため理論上、宿主生物(ヒト, 動物, および植物)に対して無害なだけでなく, 腸内細菌叢のように病原性を持たず、日和見感染症を防ぐ善玉細菌に対しても無害であるバクテリオファージを選択して用いることができる[3]。 ファージセラピーは高い治療係数を持ち、それ故にファージセラピーはほとんど副反応を起こさないと考えられている。ファージはin vivoで増殖するため、投与量を減らすことができる。一方でこの特異性は欠点にもなる。ファージは特異性の高い、一部の細菌株しか殺さない。そのため、ファージが細菌を殺す確率を高めるため、ファージを混ぜて用いるか、または予め試料を採取して感染している細菌に適合するファージを選択して用いるといった手法が採られる。
近年では、ファージはロシア[4]やグルジア[5][6][7]で汎用抗生物質に反応しない細菌感染の治療に使用されている。抗生物質が浸透できない、多糖の層に覆われたバイオフィルムが形成されている部位では抗生物質よりも効果的である傾向がある[8]。西欧では、ヒトに対する使用は承認されていないが、食中毒細菌(リステリア)を殺すためのファージが現在使用されている[9]。
Remove ads
歴史
要約
視点


1915年と1917年のフレデリック・トウォートとフェリックス・デレーユ(Felix d'Hérelle)によるバクテリオファージの発見以降[10]、ファージセラピーは細菌感染症根絶の鍵となると多くの研究者に認識された。グルジア人のギオルギ・エリアバ(Giorgio (Giorgi; George) Eliava)も類似の発見をしている。彼はパリのパスツール研究所へ赴任し、そこでデレーユと出会い、1923年にはグルジアのトビリシにファージセラピーの発展を目的とした機関、Eliava Instituteを創設した。
ロシアを含む近隣諸国でも、この分野における大規模な研究開発が始められた。1940年代のアメリカでは、大製薬会社のイーライ・リリーによってファージセラピーの商業化が請け負われた。
ファージの生物学的知見と正しいファージカクテルの使用法が明らかになってきていた一方で、初期のファージセラピーはしばしば信用に欠けたものであった[11]。1941年に抗生物質が発見され、アメリカとヨーロッパで一般的に売られるようになると、いつしか欧米の科学者たちはファージセラピーの使用と研究からほとんど興味を失っていた[12]。
1940年代に抗生物質の開発が進んだ西側諸国と異なり、ロシアの科学者たちは既に野戦病院で負傷兵士の治療に成功していたファージセラピーの開発を続けた。第二次世界大戦の間、ソ連では赤痢や壊疽など様々な細菌感染症にり患した兵士をバクテリオファージを用いて治療している。ロシアの研究者たちはファージセラピーの開発と改善を続け、自らの研究成果を発表した。しかし冷戦が障壁となり、この知見が翻訳されて、世界中に広まることはなかった[13][14] 。この時代の研究成果は2009年に英語で発行された"A Literature Review of the Practical Application of Bacteriophage Research"に要約されている[15]。
1950年代の抗生物質耐性菌の出現と科学的知見の発展により、細菌感染症と慢性多菌性バイオフィルムを根治できるファージセラピーに対し、再び注目が集まっている[16]。
ファージセラピーは生の食材中のカンピロバクター[17]や新鮮な食材中のリステリア、食材中の腐敗菌[18]などの病原菌を除去するための手段として研究されてきた。農産業の現場ではファージは家畜のカンピロバクター、大腸菌、サルモネラ、養殖魚のラクトコッカス、ビブリオ、及び農業な重要性から植物のErwinia、Xanthomonasといった病原菌を制する目的で使われていた。しかしながら、最も古い使用例は医学におけるものである。ヒトの医学ではファージは大腸菌、赤痢菌、ビブリオなどによって引き起こされる下痢や皮膚常在菌であるブドウ球菌や連鎖球菌による創傷感染などに用いられてきた。近年ではファージセラピーは全身感染症や、さらには細胞内寄生細菌感染症にも適応されてきており、増幅しないファージやライシンのようなファージ由来の酵素も細菌と戦うための武器に加えられた。しかしながら、実際の現場における、これらの新規ファージ療法の効果は明らかになっていない[18]。
西側諸国でファージセラピーが脚光を浴びたのは1994年に遡る。この年、Soothillは動物実験モデルを用いて、ファージが潜在性の緑膿菌感染症を抑えることで皮膚移植の成功率をあげることを示した[19]。近年のモデルによる研究もこのSoothillによる発見を支持してきた[20]。
ファージセラピーの目的ではないが、既存の抗生物質のデリバリー体としてファージを用いる手法も、治療に用いられる可能性がある[21][22]。また、抗癌剤の運搬にファージを用いる手法も、組織培養によるin vitroの予備実験の報告がある[23]。
Remove ads
潜在的有効性
バクテリオファージによる治療法は細菌感染症に対して一般的に用いる、抗生物質による治療法の代替法となり得る[24]。細菌はファージに対して耐性を獲得し得るが、抗生物質に対する耐性と比較してファージに対する耐性は克服しやすいと考えられる[25] 。細菌がファージに対する耐性を獲得するように対し、ファージもまた耐性を克服するように進化するためである。一方で、ファージが進化することは、ファージセラピーの安全性に疑問を投げかける[16]。
バクテリオファージは極めて特異的であり、標的となる細菌株はせいぜい2,3種類と限られている[26]。従前の抗生物質はこれに比べ多くの種の細菌に対し効果を持ち、消化を助けるようなものを含め、害のある細菌も有益な細菌も、いずれも殺してしまう。バクテリオファージはその特異性により、感染症の治療時に有益な細菌を殺してしまう危険性を小さくできる。
ファージは髄膜炎などの感染症に際し、血液脳関門を通過して、細菌宿主の細胞内で増殖することも明らかになっている。一方で場合によっては患者の免疫系がファージに対して応答を起こしてしまうこともある (ポーランドの調査では44人中2人[27]) 。
広いスペクトラムを持つファージの開発を行うグループは西側諸国に少数存在し、彼らはまた、湿潤療法、熱傷における予防的療法、ファージ浸潤縫合糸など様々な形のMRSA治療法を開発している[28]。ファージ酵素の組み換え体の精製物もそれ自体で独自の抗細菌物質として用いることが可能である[29]。
多剤耐性クレブシエラ・ニューモニエなどの細菌に対しては、毒性のない有効な抗生物質が存在しない。しかし、ファージは腹腔内投与、静脈内投与、経鼻投与において前述のような抗生物質の効きにくい細菌に対しても有効であることが、基礎研究レベルのin vivo実験で示されている[30]。
Remove ads
応用への障害
一般
ファージの高い細菌株特異性のため、臨床応用の場で治療に用いるためには、同一の疾患でも、その場その場で異なったファージカクテルを調整しなくてはならない。これは同一の疾患でもそれぞれの地域ごとに、さらに言えば患者ごとに感染している細菌の構成が異なるためである。
加えて、特異性の高いファージを用いて治療の成功率を上げるため、ファージは混ぜて用いられる。このため多種のファージを同時に保管する必要があり、さらに保管されているファージは常に新しいものに置き換える必要がある[3]。
一般的なウイルスに対する否定的なイメージも、ファージセラピーの導入に対する拒否感の原因となるかもしれない[31]。
安全性
西欧ではファージセラピーのヒトへの使用は承認されていない。一番の問題は、進化能を持つ自己増殖体の使用の安全性を証明することである[16]。
抗生物質などの、他の細菌感染症の治療法と同様、細菌が患者の体内で破壊されると、エンドトキシンが菌体から放出される (ヘルクスハイマー反応)。これにより患者は発熱などの症状を示し、最悪の場合毒素性ショックを引き起こす可能性もある (この問題は抗生物質による治療でも起こりうる) [32]。 Janakiraman Ramachandran[33]は、毒素性ショックなどを引き起こすような感染症に対して用いるバクテリオファージを、エンドライシン[注釈 1]をコードする遺伝子を除いた遺伝子組み換えファージにすることで、上述のような合併症を防ぐことができると訴えている。この遺伝子が無くとも宿主細菌は死ぬが、溶菌できないため菌体が傷害されることもない。ただしこの調整によってファージは指数的な増殖ができなくなるため、1つのファージが殺すことのできる細菌は1つのみとなる[7]。死んだ菌体は、最終的に正常な「家掃除」機構である食作用によって消化される。この機構により、細菌とその中身は酵素の働きで無害なタンパク質、多糖類、脂質に分解される[34]。
テンペレートファージは通常治療目的で用いられることはない。これは、テンペレートファージが細菌のDNAを交換する方法となり得るためで、この事はむしろ抗生物質の耐性を拡散し、さらに原理的には病原性の獲得にも寄与する可能性があることを意味する(en:Vibrio cholerae参照)[注釈 2]。
脚注
関連項目
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
