Remove ads
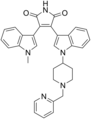
スタウロスポリン(staurosporine、抗生物質AM-2282、STS)は、1977年に大村智らによってストレプトマイセス属の放線菌Streptomyces staurosporeusから単離された天然物である[1][2]。以後、ビスインドール骨格を有する同種の化合物が50種類以上単離されている。平面構造および相対立体配置はX線回折によって1978年、1981年に[3][4]、絶対立体配置も同様にX線回折によって1994年に決定された[5]。
| (+)-スタウロスポリン | |
|---|---|
 | |
(9S,10R,11R,13R)-2,3,10,11,12,13-Hexahydro- | |
別称 antibiotic AM-2282, STS, CGP-39360 | |
| 識別情報 | |
| CAS登録番号 | 62996-74-1 |
| PubChem | 5280487 |
| 日化辞番号 | J445.409J |
| 特性 | |
| 化学式 | C28H26N4O3 |
| モル質量 | 466.53 g mol−1 |
| 外観 | 白色あるいはやや灰色がかった白色結晶性粉末 |
| 融点 |
240-243 °C |
| 水への溶解度 | 不溶 |
| DMSOへの溶解度 | 可溶 |
| エタノールへの溶解度 | 可溶 |
| λmax | 292 nm (MeOH) |
| 比旋光度 [α]D | +35.0 (c 1, MeOH, 25 °C) |
| 危険性 | |
| 安全データシート(外部リンク) | LC Laboratories |
| 半数致死量 LD50 | 6.6 mg/kg(マウス、静注)[1] |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
スタウロスポリンは、抗菌活性から降圧作用まで幅広い生理活性を示す[6][7]。また、抗がん活性を示すことも明らかにされている[8]。
スタウロスポリンはプロテインキナーゼの酵素活性を阻害することで、生理活性を示す。これは、スタウロスポリンが、酵素のアデノシン三リン酸 (ATP) 結合部位に強力に結合するためである。スタウロスポリンはプロテインキナーゼC (PKC) 阻害剤としての活性が注目されていたが、多くのキナーゼに結合して活性を阻害し選択性をほとんど示さない[9]。この特異性の欠如は臨床応用を不可能にしているが、研究のツールとしては有用である。研究では、スタウロスポリンはアポトーシスの誘導に用いられる。アポトーシス誘導の機構ははっきりと解明されていないが、カスパーゼ3の活性化によるアポトーシス誘導機構の経路が明らかにされている[10] 。
スタウロスポリンは様々なキナーゼ阻害剤のリード化合物・前駆体である(例: ミドスタウリン (PKC412)[11][12])。さらに、スタウロスポリンはスタウロスポリンアグリコン (K252C) の大量合成の出発原料として用いられる。K252Cは、スタウロスポリン生合成の前駆体である。
スタウロスポリン類縁体の構造を基にして開発されたPKCβアイソザイム選択的阻害剤エンザスタウリン は悪性リンパ腫に対する分子標的薬として[13][14]、ルボキシスタウリンは糖尿病性網膜症治療薬として、臨床試験が行なわれるなどしている。
Remove ads
インドロカルバゾールはアルカロイドのビスインドール類に分類される。これらのカルバゾールの中で、Indolo(2,3-a)carbazolesが最もよく単離され、特にIndolo(2,3-a)pyrrole(3,4-c)carbazoleが最も一般的な形である。Indolo(2,3-a)pyrrole(3,4-c)carbazoleは大きく2つのグループに分類される: 一つは、インドール環がハロゲン化され、7位炭素原子が酸化され、インドールの片方の窒素原子がβ-グリコシド結合を有する化合(例: レベッカマイシン)であり、もう一つは両方のインドールの窒素原子がグリコシル化され、ハロゲンを持たず、7位炭素原子が酸化されていない誘導体である。スタウロスポリンは2つめの、非ハロゲン化誘導体に属する[15]。
スタウロスポリンの生合成は、L-トリプトファンから出発する。トリプトファンはL-アミノ酸酸化酵素StaO(FAD依存性と考えられる)によってイミンへと変換される。イミンはStaDによって未同定の不安定中間体(イミンの二量体と推定される)へと変換される。この中間体は自発的にクロモピロール酸 (chromopyrrolic acid) へと変換する。酵素VioEを持っている種では、この中間体はVioEによって酵素的に変換され、violaceinの生合成経路へ分かれる。アリル-アリルカップリングによる芳香環の形成はシトクロムP450によって触媒されると考えられている[16]。
その後、P450であるStaPによるインドール環同士が環化、StaCによる脱炭酸反応によりスタウロスポリンアグリコンK252cが生成する[17]。グルコースは酵素群StaA/B/E/J/I/KによってNTP-L-ristosamineに変換された後[16]、StaGによってスタウロスポリンアグリコンのインドール環の1位に付加される[18]。StaNはもう一方のインドール環に糖を分子内で結合させ、O-demethyl-N-demethyl-staurosporineが生成する。最後にStaMAによるO-メチル化、StaMBによるN-メチル化によってスタウロスポリンが生成する[18]。
Remove ads
スタウロスポリンの全合成は、1995年にサミュエル・ダニシェフスキーのグループによって達成された[19][20]。その他スタウロスポリンをはじめ、類縁体の全合成が報告されている[21][22]。
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.
Remove ads