化学の分野において、構造式(こうぞうしき、英: structural formula)は、構造化学的な手法で決定された化合物の分子構造を図式的に表現したもので、原子が実際の3次元空間にどのように配置されうるかを示す。分子内の化学結合も明示的または暗黙的に示される。国際純正・応用化学連合(IUPAC)による定義は「分子中の原子がどのように接続され、空間中にどのように配置されているかに関する情報を与える式」である[1]。

記号の数や記述力が限られた他の種類の化学式とは異なり[注釈 1]、構造式は分子構造をより完全に幾何学的に表現することができる。たとえば、多くの化学物質には、鏡像異性体的な構造は異なるものの分子式は同じである、さまざまな異性体が存在する。構造式の描き方には、ルイス構造式、示性式、骨格式、ニューマン投影式、シクロヘキサン立体配座、ハース投影式、フィッシャー投影式などの種類がある[3]。
化学データベースで見られるように、幾何学的構造と同等で、かつ強力ないくつかの系統的な化学命形式が使用されている。これらの化学命名法には、SMILES、InChI、CML(ChemML)などがある。これらの系統的な化学名は構造式に変換することができ、またその逆も可能である。しかし、化学者は化学反応や化学合成を化学名ではなく構造式で説明することがほとんどである。それは、構造式は化学反応中に分子とその内部で起こる構造変化を視覚化することができるからである。ChemSketchやChemDrawは、ユーザーが反応式や構造式(通常はルイス構造式)を描くことができる人気のソフトウェアである。
構造式における構造
結合
結合は、1つの原子と別の原子を結ぶ線として示されることが多い。1本の線は単結合を示す。2本の線は二重結合を、3本の線は三重結合を示す。構造によっては、各結合の間にある原子を特定して表示することがある。ただし、構造によっては、炭素分子を具体的に描かないこともある。その代わり、これらの炭素は2本の線を結んだときにできる角によって示される。水素原子も暗示的なものであり、通常は描かれない。こうした省略は、炭素が他の原子と何個結合しているかによって推測できる。たとえば、炭素Aが別の炭素Bと結合している場合、炭素Aはオクテット則を満たすために3個の水素を持つと見なされる[4]。


電子

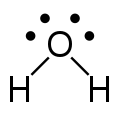
電子は一般に色付きの円で表示される。1つの円は1個の電子を示し、2つの円は2個の電子の組を示す。一対の電子は通常、負電荷も示す。色付きの円は、各原子の原子価殻にある電子数を示し、分子内の原子の反応性をより詳しく説明するものである[4]。
電荷
原子の最外殻電子数(オクテット)が満たされず、正または負の電荷を持つことがよくある。原子が一対の電子を欠くか、原子にプロトンが付いている場合、原子は正電荷を持つことになる。原子が他の原子と結合していない電子を持っている場合、負電荷を持つことになる。構造式では、正電荷は⊕で、負電荷は⊖で表される[4]。

立体化学(骨格式)

骨格式におけるキラリティーは、ナッタ投影式によって示される。立体化学は、分子内の原子の相対的な空間配置を示すために使用される。これを表すのに「くさび(楔)」が使われ、破線と塗りつぶしの2つの種類がある。塗りつぶされたくさびは、くさびの広い端側の原子が尖った端側の原子よりも読者からみて手前側にあることを意味する。破線のくさびは、逆にくさびの広い端側の原子が尖った端側の原子よりも読者からみて奥側にあることを指している。破線でない直線は、両端の原子が紙面と平行な同一面上にあることを示す。この空間配置は、3次元空間内における分子の着想を与えるものであり、空間的な配置については制約がある[4]。
不特定の立体化学

波線状の単結合は、立体化学が不明または特定できないか、異性体の混合物であることを表す。たとえば、上の図は、左側のHOCH2-基が波線状に結合しているフルクトース分子を示している。この場合、2つの可能な環構造は互いに化学的に平衡な状態にあり、また開鎖構造とも化学的に平衡である。環は自動的に開閉し、一方の立体化学で閉じるときもあれば、他方の立体化学で閉じるときもある。
骨格式は、アルケンのシス-トランス異性体を表現することができる。波線状の単結合は、立体化学が不明または特定できないか異性体の混合物を表す標準的な方法である(四面体キラル中心と同様)。交差した二重結合が使われることもあるが、現在では一般的に許容される様式とは見なされない[5]。

ルイス構造式

ルイス構造式(またはルイス点電子構造式)は、原子の結合性と、孤立電子対または不対電子を示す平坦なグラフ式で、立体構造は示さない。この表記法は主に小分子に用いられる。各線は単結合における2つの電子を表す。原子の対の間にある2本または3本の平行線は、それぞれ二重結合または三重結合を表す。また、点の組を使用して、結合対を表すこともできる。さらに、すべての非結合電子(対または非対)および原子上のあらゆる形式電荷が示される。ルイス構造式を使用することで、電子の配置が結合であろうと孤立対であろうと、分子内の原子の形式電荷を特定し、安定性を理解し、反応で生成する最も可能性の高い分子(分子構造の違いに基づく)を決定できるようになる。ルイス構造式では、実際の分子を表現するために、結合が特定の角度で描かれていることが多いので、分子の構造をある程度念頭に置く必要がある。ルイス構造式は、電子と結合の両方が示されているため、形式電荷の計算や原子同士が結合するかを計算するのに最適である。ルイス構造式は、結合と孤立対の存在に基づいて変化する分子および電子の幾何配置を示し、これを通じて結合角と混成を決定することができる。
示性式
図版の使用が非常に制限されていた有機化学の初期の出版物では、示性式(英: condensed structural formulas)という、有機構造を一行で記述する活版印刷上の体系が登場した。この方式は、環状化合物への適用で問題がある傾向があるが、単純な構造を表現するには便利な方法として残されている。
- (エタノール)
括弧は、複数の同一の基を示すために用いられ、式中に現れる場合は左側の最も近い非水素原子へ、また式の最初に現れる場合は右側の原子に結合していることを示す。
- または (2-プロパノール)
いずれの場合も、水素原子を含むすべての原子が表示されている。また、 が括弧内に配置されることで が暗示されるカルボニル基を示すことも役に立つ。たとえば:
- (アセトン)
したがって、括弧の中の原子の左側を見て、どの原子と結合しているかを確認することが重要である。これは、示性式から骨格式やルイス構造式などの別の形式の構造式に変換するときに便利である。また、示性式ではアルデヒドを 、カルボン酸を または 、エステルを または など、さまざまな官能基の表し方がある。ただし、示性式を使用しても、化合物の分子構造や炭素間の結合数がすぐにわかるわけではなく、炭素に結合している原子の数や、炭素に電荷があるかどうかから確認する必要がある。
骨格式
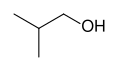
骨格式は、より複雑な有機分子に対する標準的な表記法である。この種類の図は、有機化学者のアウグスト・ケクレが最初に使用したもので、炭素原子を原子記号Cで示さず、線分の頂点(角)と末端に位置することを暗示している。炭素原子に結合した水素原子は示されておらず、各炭素原子は炭素原子に4つの結合を与えるのに十分な水素原子と結合していると解釈される。炭素原子に存在する正または負の電荷は、暗示された水素原子の1つによって置き換えられる。炭素以外の原子に結合している水素原子は、明示的に書かなければならない。骨格式のもう一つの特徴は、特定の構造を加えることによって、化合物の立体化学、すなわち三次元構造を決定することができることである。多くの場合、骨格式は、線の代わりにくさびを用いることで立体化学を示すことができる。実線のくさびは紙面より上向きの結合を表し、破線のくさびは紙面より下向きの結合を表している。
- イソブタノールの骨格式,(CH3)2CHCH2OH
透視図
ニューマン投影式とのこぎり台投影式
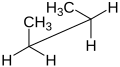
ニューマン投影式やのこぎり台投影式は、特定の配座異性体を描いたり、ビシナル立体化学を区別するために使われる。どちらの場合も、特定の2つの炭素原子とそれらを結ぶ結合が関心の対象となる。違いは視点が少し異なることで、ニューマン投影式は関心のある結合を真っすぐ見下ろすのに対し、のこぎり台投影式は同じ結合をやや斜めから見ている。ニューマン投影式では、結合に垂直な平面を円で表し、手前の炭素にある置換基と奥の炭素にある置換基を区別している。のこぎり台投影式では、手前側の炭素は通常左側で、常に少し低い位置に位置する。手前側の炭素を示すのに矢印を使うこともある。のこぎり台投影式は骨格式に非常によく似ており、線の代わりにくさびを使って分子の立体化学を示すこともできる。のこぎり台投影式は、分子の形状や配置をあまりうまく表示できないため、骨格式とは区別される。ニューマン投影式とのこぎり台投影式のどちらを用いても、フィッシャー投影式を作成することができる。
- ブタンのニューマン投影式
- ブタンののこぎり台投影式
シクロヘキサンの立体配座
シクロヘキサンやその他の小員環化合物の具体的な立体配座は、標準的な表記法を使って示すことができる。たとえば、シクロヘキサンの標準的ないす形配座は、炭素原子の平均面よりやや上からの透視図によって、どの基がアキシアル(上下に垂直)であり、どの基がエクアトリアル(ほぼ水平で上下にわずかに傾斜)であるかを明確に示す。前方の結合は、より強い線やくさびで強調してもよいし、しなくてもよい。立体配座は、いす - 半いす - ねじれ舟 - 舟 - ねじれ舟 - 半いす - いす、というように変化する。また、シクロヘキサンの立体配座は図に示すように、各段階で存在するポテンシャルエネルギーを示すために用いることもできる。いす形配座(A)はエネルギーが最も低く、半いす形配座(D)はエネルギーが最も高い。舟形配座(C)には山/極大があり、ねじれ舟形配座(B)には谷/極小がある。さらに、シクロヘキサンの立体配座は、分子が1,3-ジアキシアル相互作用(1, 3, 5位上のアキシアル置換基間の立体相互作用)を持っているかどうかを示すために使用することができる[6]。


ハース投影式
ハース投影式は環状糖に使用される。アキシアルとエクアトリアルの位置の区別はなく、置換基は結合している環原子の真上または真下に配置される。水素置換基は通常省略される。
しかし、ハース投影式を読むときに留意すべきことは、環状構造は平面ではないということである。したがって、ハースは3次元の形状を提供しない。ウォルター・ハースはイギリスの化学者で、炭水化物の研究とビタミンCの構造の発見でノーベル賞を受賞した。彼は今日、ハース投影式と呼ばれるさまざまな構造式も導き出した。ハース投影式では、ピラノース糖は六角形、フラノース糖は五角形で描かれる。酸素は通常、ピラノース糖では右上、フラノース糖では上部中央に配置される。環の上部にある細い結合は、遠くにある結合を示し、環の下部にある太い結合は、見る人に近い方の環の端を示す[7]。

- β-D-グルコースのハース投影式
フィッシャー投影式
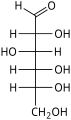
フィッシャー投影式は主に直鎖状の単糖に用いられる。任意の炭素中心において、垂直の結合線は立体化学的な位置番号に対応し、観察者から離れる方向に向けられ、横の線はくさびに対応し、観察者の方に向かう方向にある。糖鎖がこのような広がった重なり形配座をとることはありえないので、この投影は非現実的である。それにもかかわらず、フィッシャー投影式は、複数の連続したキラル中心を描く簡単な方法で、実際の立体配座に関する知識も必要としない。フィッシャー投影式は、3次元の分子を2次元に制限するため、キラル中心の配置を変更するには限界がある。フィッシャー投影式は、キラル炭素(不斉炭素)上のRおよびSの配置を決定するために用いられ、カーン・インゴルド・プレローグ順位則を用いて行われる。これは、エナンチオマーとジアステレオマーを表現し、区別するのに便利な方法である[7]。
- D-グルコースのフィッシャー投影式
制限
構造式は単純化されたモデルであり、化学構造のある側面を表現することはできない。たとえば、 形式化された結合は、非局在結合のような動的システムには適用できない場合がある。芳香族はそのようなケースであり、結合を表現するために慣習に依存している。構造式の様式が異なると、芳香族性の表現方法が異なり、同じ化学物質でも異なる表現になる場合がある。もう一つの例は、電子密度が形式的結合の外側に広がっている形式的二重結合で、室温では部分的な二重結合の性質を示して相互変換は遅くなる。すべての動的効果において、温度は相互変換の速度に影響を与え、構造の表し方を変える可能性がある。構造式に関する明確な温度は決まっていないが、標準温度とされることが多い。
参照項目
注釈
脚注
外部リンク
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.