Timeline
Chat
Prospettiva
Tetrafluoruro di uranio
composto chimico Da Wikipedia, l'enciclopedia libera
Remove ads
Il tetrafluoruro di uranio o fluoruro di uranio(IV) è il composto binario tra fluoro e uranio con formula UF4. È un solido cristallino verde. UF4 è tipicamente un intermedio nella produzione di esafluoruro di uranio (UF6) o di uranio metallico a partire da ossidi di uranio (U3O8 e UO2).[2] Nell'industria della raffinazione dell'uranio è noto come sale verde.
Remove ads
Remove ads
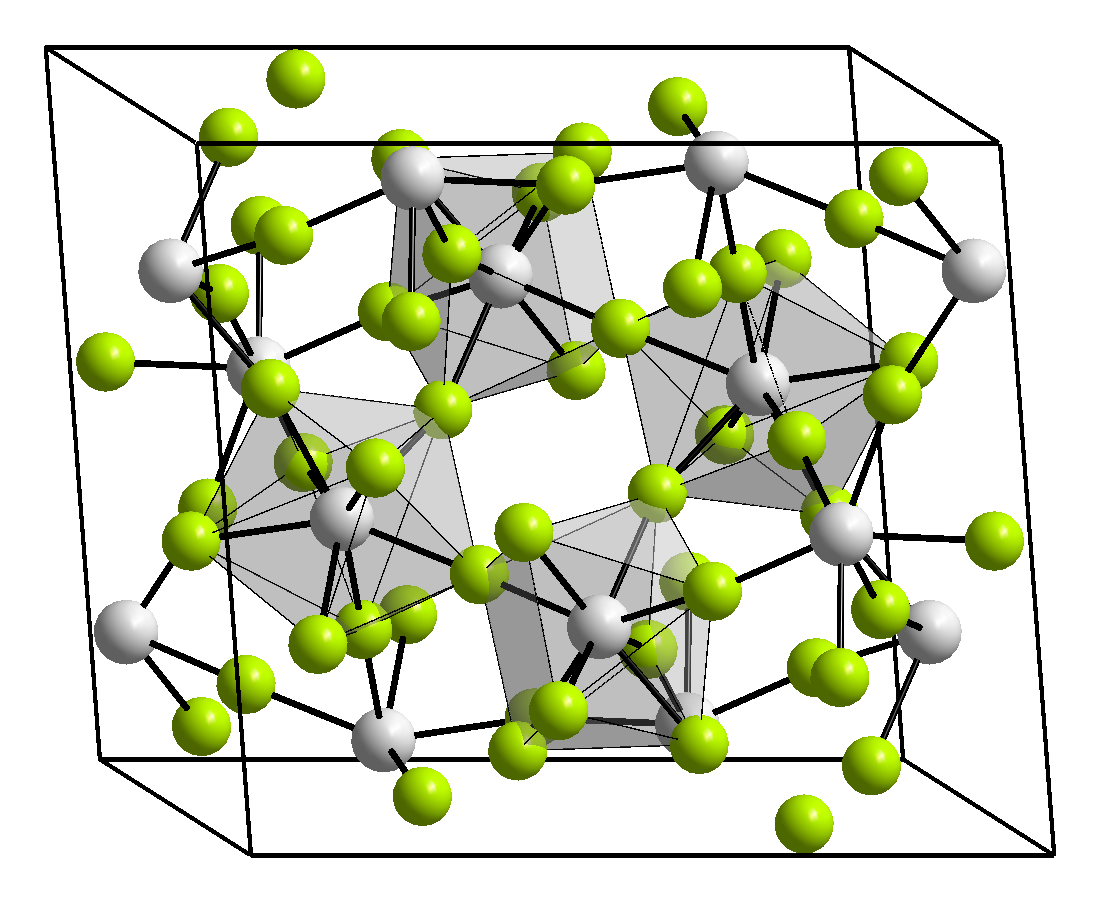
Struttura e proprietà
Il tetrafluoruro di uranio cristallizza nel sistema monoclino, gruppo spaziale C2/c con costanti di reticolo a = 1273 pm, b = 1075 pm, c = 843 pm, β = 126° e dodici unità di formula per ogni cella elementare.[3]
Sintesi
Riepilogo
Prospettiva
Processo teorico
Il tetrafluoruro di uranio si prepara trattando UO2 con HF:
- UO2 + 4HF → UF4 + 2H2O
o per reazione tra UF6 e idrogeno:
- UF6 + H2 → UF4 + 2HF
Tetrafluoruro di uranio molto puro si può ottenere passando diclorodifluorometano anidro su UO3 scaldato a i 400 °C.[4][5]
- UO3 + 2CCl2F2 → UF4 + Cl2 + COCl2 + CO2
Produzione industriale
La produzione industriale parte dallo yellowcake, esegue quindi la fluorizzazione dell'uranio in tetrafluoruro di uranio (UF4), mediante vari processi fisico-chimici che impiegano acido nitrico, ammoniaca, idrogeno e acido fluoridrico.
Raffinazione
Dissoluzione

I fusti e i contenitori di yellowcake vengono svuotati in un silo, che si apre in un serbatoio di dissoluzione alimentato da acido nitrico, per ottenere un prodotto liquido contenente il nitrato di uranile avente la formula chimica UO2(NO3)2, il nitrato di sodio (NaNO3) e varie impurità. Il diuranato di sodio - uno dei più importanti costituenti dello yellowcake con uranati di magnesio, di ammonio, ecc. - viene attaccato dall'acido nitrico secondo la reazione:
- Na2U2O7 + 6HNO3 → 2(UO2(NO3)2 + 2NaNO3 + 3H2O
Questo trattamento è seguito da una filtrazione[6].
Purificazione
La soluzione acquosa di nitrato di uranile viene purificata in una colonna di purificazione per estrazione liquido-liquido con una soluzione organica di tributilfosfato (TBP) diluito nel dodecano e/o nel cherosene. Poiché la fase acquosa e la fase organica sono immiscibili, il TBP lega il nitrato di uranile sotto forma di un complesso alla superficie di separazione tra le due fasi:
- UO22+(aq) + 2NO3-(aq)+ 2TBP(org) → (UO2(NO3)2 . 2TBP)(org)[7]
Le impurità rimangono nella fase acquosa dell'acido nitrico. Questo passaggio consente quindi di ottenere un nitrato di uranile ad elevata purezza detto "purezza nucleare" (> 99,95%). La purificazione è un processo idrometallurgico convenzionale. La purezza dell'uranio destinato al combustibile nucleare è molto superiore a quella ottenuta nella metallurgia classica[8].
Riestrazione
La fase di riestrazione consiste nel rifar passare il nitrato di uranile purificato nella fase acquosa. Si verifica nella colonna alimentata questa volta con acqua demineralizzata. Il solvente organico recuperato durante la riestrazione viene quindi riciclato[6].
Conversione
Precipitazione
La dissoluzione dell'ammoniaca (NH3) gassosa nella soluzione purificata produce idrossido di ammonio (NH4OH). Questo reagisce con il nitrato di uranile per formare un precipitato di diuranato di ammonio (NH4)2U2O7 (DUA) secondo la seguente reazione:
- 2UO2(NO3)2 + 6 NH4OH → (NH4)2U2O7 + 4 NH4NO3[9]
Denitrazione

Dopo filtrazione ed essiccamento, il diuranato di ammonio viene calcinato (o denitrato) in triossido di uranio UO3[10] in un forno ad una temperatura molto elevata (circa 400 °C).
- (NH4)2U2O7 → 2UO3 + 2NH3 + H2O
Nel quadro del progetto Comurhex II, l'impianto di Malvési implementerà un processo di denitrazione termica denominato Isoflash per sostituire le fasi di precipitazione e calcinazione del diuranato di ammonio[11].
Riduzione e fluorizzazione

In uno stesso forno a forma di "L", il triossido di uranio è ridotto dall'idrogeno in diossido di uranio (UO2), intorno a 650-800 °C, poi fluorizzato in tetrafluoruro di uranio (UF4) da acido fluoridrico (HF), fra 350 e 600 °C[12].
- riduzione mediante l'idrogeno del triossido di uranio in bdiossido di uranio:
- UO3 + H2 → UO2 + H2O
- fluorizzazione in tetrafluoruro di uranio per passaggio del diossido di uranio nell'acido fluoridrico (HF) gassoso:
- UO2 + 4HF → UF4 + 2H2O
Il tetrafluoruro di uranio (UF4) ottenuto può essere eventualmente ridotto con calcio per ottenere l'uranio puro nella sua forma metallica.
Remove ads
Reattività
UF4 è meno stabile degli ossidi di uranio e reagisce lentamente con l'umidità a temperatura ambiente, formando UO2 e HF che sono corrosivi.
Tossicità / Indicazioni di sicurezza
Come tutti i sali di uranio, UF4 è tossico ed è dannoso per inalazione, ingestione e contatto cutaneo.
Note
Bibliografia
Altri progetti
Collegamenti esterni
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads