Formammide
composto chimico Da Wikipedia, l'enciclopedia libera
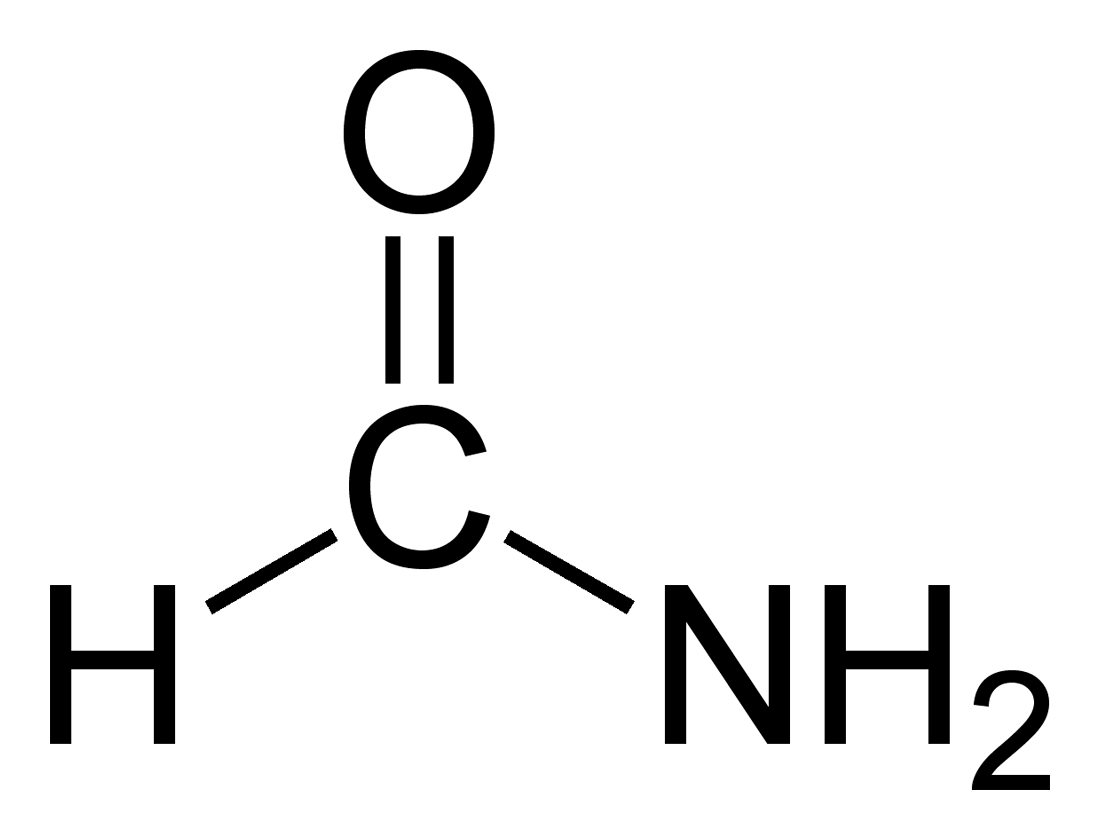
La formammide[2] o metanammide (nome sistematico) è l'ammide dell'acido formico ed è la più semplice delle ammidi degli acidi carbossilici (carbossammidi); la sua formula è H-C(=O)–NH2 e da questa derivano le formammidi sostituite H-C(=O)–NRR'. Come tutte le ammidi, ha come suo tautomero l'acido formimmidico,[3] H-C(=NH)–OH,[4] che però è molto meno stabile; la conversione tra i due è catalizzata dall'acido formico.[5]
| Formammide | |
|---|---|
 | |
 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | HCONH2 |
| Massa molecolare (u) | 45,04 g/mol |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 200-842-0 |
| PubChem | 713 |
| SMILES | C(=O)N |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,13 (20 °C) |
| Solubilità in acqua | (20 °C) solubile |
| Temperatura di fusione | 2 °C (275 K) |
| Temperatura di ebollizione | 210 °C (483 K) |
| Indicazioni di sicurezza | |
| Punto di fiamma | 175 °C (448 K) |
| Limiti di esplosione | 2,7 - 19,0 Vol% |
| Temperatura di autoignizione | 500 °C (773 K) |
| Simboli di rischio chimico | |

| |
| pericolo | |
| Frasi H | 360d |
| Consigli P | 201 - 308+313 [1] |
Caratteristiche
A temperatura ambiente la formammide si presenta come un liquido oleoso incolore, igroscopico e altobollente, leggermente più denso dell'acqua e completamente miscibile con essa;[6] è inodore se pura,[7] ma spesso esibisce un odore molto lieve di ammoniaca.[3] Pur essendo una sostanza combustibile, è difficilmente infiammabile.[6] La formammide è l'unica carbossammide liquida a temperatura ambiente:[8] le altre, a partire dall'acetammide, sono solidi cristallini.
Struttura molecolare e proprietà
Riepilogo
Prospettiva
La formammide è un composto molto stabile: ΔHƒ° = -251 kJ/mol in fase liquida a 25 °C.[9] La molecola è un ibrido di risonanza:
- H-C(=O)–NH2 ←→ H-C(O–)=+NH2
Nell'ibrido la seconda forma limite è meno favorita della prima, per la presenza della separazione di carica, anche se di tipo favorevole, ma comunque questa forma è presente e contribuisce all'ibrido di risonanza (molecola reale) e questo implica che anche l'atomo N sia ibridato sp2 per poter fare un legame π, come anche C e O. Quindi, in base a queste considerazioni, la molecola è prevista essere planare.
Un'indagine spettroscopica rotazionale nella regione delle microonde ha assunto una struttura essenzialmente planare ed in base a questa ipotesi ha fornito i parametri strutturali della molecola, alcuni dei quali sono i seguenti:[10][11]
r(C–H)) = 109,8 pm; r(C–O) = 121,9 pm; r(C–N) = 135,2 pm; r(N–Hcis, trans) = 100,15 pm;
∠(HCO) = 122,5°; ∠(HCN) = 112,7°; ∠(NCO) = 112,7°; ∠(HcisNC) = 118,5°; ∠(HtransNC) = 120°.
Da un'indagine di diffrazione elettronica in fase gassosa appena successiva sono stati ricavati parametri strutturali sufficientemente simili.[12] Si può notare che il legame C–N è decisamente più corto del normale per un legame semplice (147 pm[13]) e che il legame C=O è lievemente più lungo che nella formaldeide H2C=O (120,8 pm[14]), dove quella risonanza coinvolgente la coppia solitaria dell'atomo di azoto non c'è.
Nella struttura ricavata allo stato solido tramite cristallografia a raggi X, dove si osserva la presenza di dimeri planari della formammide, si nota, rispetto alla fase gassosa, un legame C=O più lungo (125,5 pm) e un legame C–N più corto (130,0 pm).[15]
La molecola della formammide risulta essere molto polare (μ = 3,71 D; per l'acqua, μ = 1,86 D)[16] ed è capace di essere donatrice di due legami idrogeno (con il gruppo –NH2) e di poter riceverne tre, due sull'ossigeno carbonilico e uno sull'atomo di azoto. Questo e l'alta costante dielettrica del liquido (εr = 111 a 20 °C; per l'acqua, εr = 80,1 a 20 °C)[17] ne fanno un buon solvente protico non acquoso che può sciogliere diversi composti ionici, anche alcuni poco solubili in acqua;[18] è un buon solvente anche per gli zuccheri e a volte si mostra un solvente anche migliore dell'acqua stessa per i polisaccaridi,[19] come per il caso del destrano[20] e dell'amilosio.[21] Il suo derivato dimetilsostituito sull'azoto, la N,N-dimetilformammide, è invece un comune solvente polare aprotico, utilmente impiegato nelle sostituzioni nucleofile SN2 e in vari casi in cui occorra solvatare bene specie cationiche, ma poco quelle anioniche.
Proprietà acido-base
In acqua non si comporta apprezzabilmente come acido o come base, il suo pKa in dimetilsolfossido è 23,5,[22] contro il valore di 25,5 per l'acetammide,[23] che quindi è notevolmente meno acida. La forma protonata H-C(=O+–H)–NH2, che è un importante intermedio nelle reazioni di idrolisi acido-catalizzate della formammide, ha pKa ≈ -2 in ambiente acquoso.[24]
L'affinità protonica della formammide, che è una misura della sua basicità intrinseca e che coinvolge ovviamente la stessa specie protonata, ma in fase gassosa, ammonta a 822,2 kJ/mol,[25] contro 863,6 kJ/mol dell'acetammide, anche in questo caso parecchio più basica.[26]
Produzione ed applicazioni
Riepilogo
Prospettiva
La formammide veniva storicamente prodotta per reazione dell'acido formico con l'ammoniaca per formare inizialmente formiato di ammonio; questo, per riscaldamento, elimina una molecola di acqua, dando così la formammide:[27][28]
- H-COOH + NH3 → H-COO− NH+4
- H-COO− NH+4 → H-CONH2 + H2O
A livello industriale viene sintetizzato per reazione diretta tra ammoniaca ed ossido di carbonio (una reazione di carbonilazione):[29]
- CO + NH3 → H-CONH2
In alternativa, si può sfruttare l'ammonolisi[30] del formiato di metile, il quale è prodotto a sua volta tramite la carbonilazione del metanolo:
- CO + CH3OH → H-COOCH3
- H-COOCH3 + NH3 → H-CONH2 + CH3OH
Il metanolo che si produce può poi ritornare ad essere impiegato nel primo stadio.
Trova impiego come intermedio nella sintesi di farmaci e di prodotti per l'agricoltura (erbicidi, pesticidi, ecc.). È un composto tossico per la riproduzione (teratogeno).
Viene anche usato in chimica organica come composto riducente. Ad esempio, è capace di convertire l'acido urico (2,4,8-triossi-purina) nel suo precursore xantina (2,4-diossi-purina) secondo la seguente reazione:
- urato + formamide = xantina + anidride carbonica + ammoniaca.
Il suo metil-derivato N,N-dimetilformammide è uno dei solventi polari di maggior uso nella chimica organica. È un composto capace di rompere anche le tipologie più forti di legami idrogeno, come quelli della cellulosa.
Note
Altri progetti
Collegamenti esterni
Wikiwand - on
Seamless Wikipedia browsing. On steroids.