Timeline
Chat
Prospettiva
Acido fluoroantimonico
composto chimico Da Wikipedia, l'enciclopedia libera
Remove ads
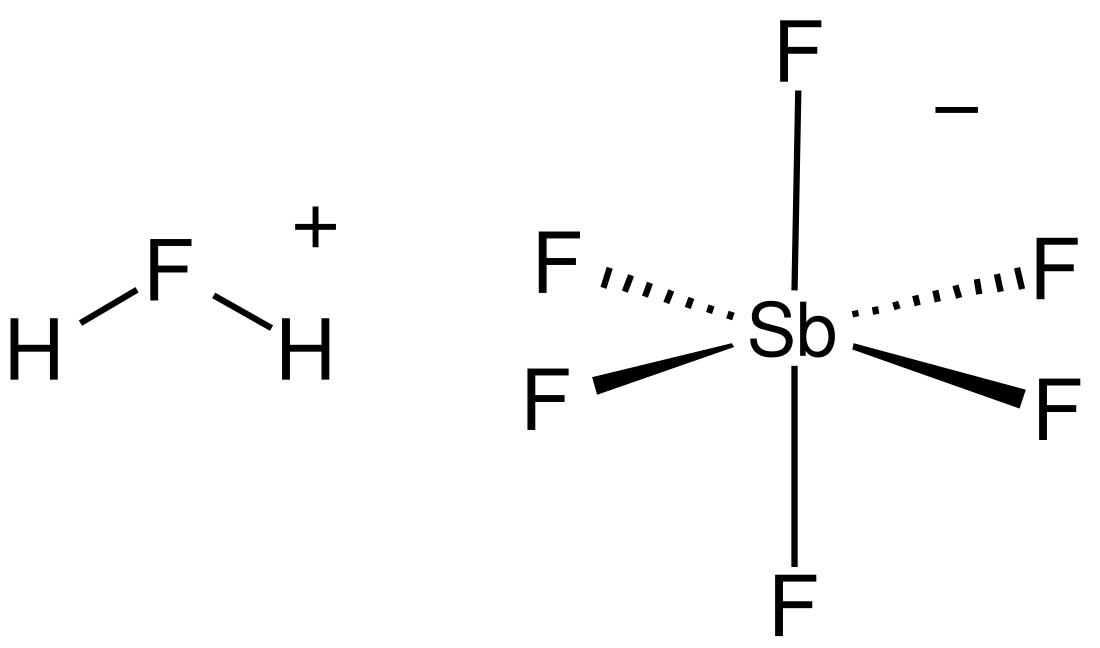
L'acido esafluoroantimonico o acido fluoroantimonico HSbF6 è una miscela di acido fluoridrico e pentafluoruro di antimonio in diverse proporzioni.[2] La miscela con rapporto 1:1 costituisce il più forte superacido. La reazione tra HF e SbF5 è estremamente esotermica. HF rilascia il suo protone (H+) mentre la sua base coniugata (F-) viene sequestrata da una o più molecole di SbF5 a dare l'ottaedro SbF6-. Tale anione è classificato come non-coordinante, perché è sia un nucleofilo molto debole sia una base molto debole. In pratica il protone rimane "nudo", e ciò causa l'estrema acidità del composto. L'acido fluoroantimonico è oltre 2×1019 volte (20 miliardi di miliardi di volte) più potente dell'acido solforico al 100%[3].
Remove ads
Remove ads
Struttura
Due prodotti correlati sono stati cristallizzati da soluzioni di HF-SbF5, ed entrambi sono stati analizzati da una cristallografia a raggi X a cristallo singolo. Questi sali hanno formule [H2F+][Sb2F11−] e [H3F2+][Sb2F11−]. In entrambi i sali l'anione è Sb2F11−.[4] Come detto in precedenza, SbF6− è classificato come una base debole; il più grande monoanione Sb2F11− ci si aspetta sia ancora più debole.
Confronto con altri acidi
I seguenti valori[senza fonte] sono basati sulla funzione di acidità di Hammett. L'acidità è indicata dagli alti valori negativi H0.
Per fare un confronto, l'acido solforico (usato come riferimento per la definizione di superacido) presenta un valore pari a -12.
- Acido fluoroantimonico (1990) (H0 = −31,3)
- Acido magico (1974) (H0 = −19,2)
- Carborano superacido (1969) (H0 = −18,0)
- Acido fluorosolforico (1944) (H0 = −15,1)
- Acido triflico (1940) (H0 = −14,9)
Lo status di acido più potente, non va confuso con quello di più corrosivo (per la materia organica), che invece spetta alla soluzione piranha[5].
Remove ads
Applicazioni
Riepilogo
Prospettiva
Questo straordinario superacido è in grado di protonare quasi tutti i composti organici. Nel 1967, Bickel e Hogeveen hanno mostrato come HF-SbF5 rimuova H2 dall'isobutano, e metano dal neopentano:[6][7]
Remove ads
Sicurezza
HF-SbF5 viene rapidamente decomposto dall'acqua con una violenta reazione esplosiva. Teoricamente reagisce con tutti i solventi conosciuti.[2] I solventi che sono stati dimostrati essere compatibili con HF-SbF5 sono il clorofluoruro di solforile (SO2ClF) e l'anidride solforosa liquefatta. Sono stati usati come solventi anche i fluorocarburi. I contenitori per HF-SbF5 sono fatti di teflon (PTFE).
Note
Altri progetti
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads