Utente:Grasso Luigi/sanbox1/diazoto
Da Wikipedia, l'enciclopedia libera
Il diazoto è una molecola biatomica che consiste di due atomi di azoto con un legame covalente triplo. Ha formula chimica N2.
In condizioni normali di temperatura e pressione, le molecole di diazoto formano un gas incolore, che costituisce un composto dell'aria. Oggi, il diazoto viene generalmente ottenuto dalla liquefazione dell'aria, che è il componente principale con una concentrazione di 78.06% in volume e 75,5% in peso, seguita da distillazione frazionata.
| Diazoto | |
|---|---|
 | |
| Nome IUPAC | |
| [1] | |
| Caratteristiche generali | |
| Formula bruta o molecolare | N2 |
| Massa molecolare (u) | 28,0134 ± 0,0004 |
| Aspetto | gas: liquido incolore e inodore |
| Numero CAS | |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,808 al punto di ebollizione |
| Temperatura di fusione | -210,01 °C |
| Temperatura di ebollizione | -159,79 °C |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| attenzione | |
| Frasi H | --- |
| Consigli P | --- |
Produzione
Il diazoto atmosferico può essere convertito in ammoniaca utilizzando il processo Haber-Bosch. L'ammoniaca così prodotta viene utilizzata principalmente per la produzione di fertilizzanti. Produzione globale in milioni di tonnellate nel 2014: [2] :
| Paese | Produzione | % mondiale | |
|---|---|---|---|
| 1 | Cina | 47.3 | 32.6 |
| 2 | Russia | 11.8 | 8.1 |
| 3 | India | 11.0 | 7.6 |
| 4 | USA | 9.33 | 6.4 |
| 5 | Indonesia | 5.0 | 3.4 |
| 6 | Trinidad e Tobago | 4.73 | 3.3 |
| 7 | Ucraina | 4.24 | 2.9 |
| 8 | Canada | 3.94 | 2.7 |
| 9 | Arabia Saudita | 3.2 | 2.2 |
| 10 | Qatar | 2.99 | 2.1 |
| 11 | Germania | 2.8 | 1.9 |
| 12 | Pakistan | 2.7 | 1.9 |
| 13 | Egitto | 2.66 | 1.8 |
| 14 | Francia | 2.6 | 1.8 |
| 15 | Iran | 2.5 | 1.7 |
| TOTALE | 145.0 | 100 | |
Metodi di preparazione
Riepilogo
Prospettiva
In laboratorio N2 si può ottenere sottraendo O2 all'aria facendola passare attraverso fili di rame al calor rosso; si può anche, e questa è un'area di ricerca in forte crescita, separare N2 e O2 sfruttando membrane permeabili all'ossigeno biatomico ma non all'azoto biatomico.
Un altro metodo di preparazione è la decomposizione termica di alcuni sali che lo contengono, per esempio:
- NH4NO2(aq) → N2(g) + 2 H2O
Se si vuole ottenere N2 a maggior grado di purezza si sfrutta la decomposizione termica di un azoturo di un metallo alcalino o alcalino terroso:
- 2NaN3(s) → 3N2(g) + 2Na(s)
Nell'industria viene invece esclusivamente ottenuto dalla distillazione frazionata dell'aria liquida. Di norma l'azoto molecolare N2 che ne risulta contiene impurezze in ppm, soprattutto Ar e O2 , in misura più o meno significativa a seconda dei metodi impiegati e della qualità dell'impianto di produzione; le moderne colonne di frazionamento garantiscono purezze superiori al 99,9995%, dato che soddisfa la massima parte delle necessità.
Tra i metodi di purificazione (tesi a ridurre il tenore di O2) resi oggi obsoleti dal miglioramento delle colonne di frazionamento si annoveravano:
- la reazione con piccole quantità di idrogeno su catalizzatore di platino;
- il passaggio del gas su rame al calor rosso;
- il passaggio del gas attraverso soluzione riducente (p.e.contenente V2+ o Cr2+).
Caratteristiche fisiche e chimico-fisiche
Riepilogo
Prospettiva
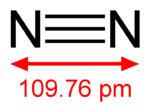
Strutturali
| Caratteristiche strutturali di N2 | ||
|---|---|---|
| Gruppo puntuale | D∞h | |
| Distanza di legame (pm) |
14N2 | 110,010 |
| 14N15N | 110,003 | |
| 15N2 | 109,998 | |
| Massa molecolare (u.a.) |
14N2 | 28,0062 |
| 14N15N | 29,0032 | |
| 15N2 | 30,0002 | |
| Momenti d'inerzia 14N2 (g m2) |
Ia = 0 | |
| Ib = 1,407×10−43 | ||
| Ib = 1,407×10−43 | ||
Elettroniche
| Caratteristiche elettroniche di N2 | |
|---|---|
| Configurazione elettronica | (σg1s)2(σu*1s)2(σg2s)2(σu*2s)2(πu2p)4(σg2p)2 |
| Stati | 1Σ+g |
| Energia di legame 14N2(kJ mol−1) | 941,7 |
| Energia di ionizzazione | 15,59 eV |
| Momento di dipolo (Debye) | 0 |
| Polarizzabilità (10−30m³) | 1,77 |
Sia la configurazione elettronica MO, che le teorie elementari della valenza sono concordi nel ritenere l'ordine di legame dell'azoto molecolare (N2) uguale a 3. Ciò è coerente con gli elevati valori dell'energia di dissociazione e della costante vibrazionale.
Spettro UPS

Il primo picco che si osserva nello spettro fotoelettronico UPS He I, quello a 15,59 eV, porta a N2+ (2Σ+g) strappando un elettrone dall'orbitale σg2p. Mostra una struttura vibrazionale molto modesta, vi è solo un debole picco secondario distanziato dal primo di circa 0,267 eV, quindi la costante vibrazionale di N+2(2Σ+g) è 1906,87 N m−1. È un valore inferiore a quello di N2 ma ancora elevato, sintomo del fatto che il contributo legante dell'orbitale σg2p è scarso.
Il secondo picco, che porta a N+2 (2Πu), presenta invece una struttura vibrazionale molto marcata. Si può notare che il picco più intenso della serie è quello del primo stato vibrazionale eccitato, ciò significa che la distanza di legame in N+2 (2Πu) è sensibilmente superiore a quella di N2 (1Σ+g). L'espulsione di un elettrone πu2p comporta quindi un importante indebolimento del legame, come si può anche dedurre dalla separazione dei livelli vibrazionali di N+2 (2Πu) che è di circa 0,224 eV, con una costante vibrazionale che questa volta diminuisce decisamente (1351,46 N m−1).
L'ultimo picco che si può osservare in UPS è a 18,75 eV, porta a N+2 (2Σ+u), la struttura vibrazionale è simile a quella del primo picco, questa volta la separazione dei livelli vibrazionali è 0,296 eV e quindi la costante vibrazionale uguale a 2356,35 N m−1. È un valore superiore a quello di N2 (1Σ+g) e infatti l'elettrone espulso proviene da un orbitale debolmente antilegante (σu*2s).
Spettroscopiche
| Caratteristiche spettroscopiche di N2 | |
| Costante rotazionale 14N2 (cm−1) | 1,9987 |
| Costante della distorsione centrifuga al 1º ordine (cm−1) | 5,744×10−6 |
| Frequenza vibrazionale fondamentale 14N2 (cm−1) | 2358,07 |
| Energia di punto zero 14N2 | 0,1462 |
| Costante vibrazionale 14N2 (N m−1) | 2293,8 |
Il piccolo valore della costante al 1º ordine della correzione centrifuga e l'elevata costante vibrazionale sono indici di una notevole
rigidità della molecola e sono coerenti con l'elevata energia di legame e con l'ordine di legame uguale a 3.
Mentre lo spettro rotazionale Raman della molecola 14N15N, di simmetria C∞v,
presenta intensità concordi con quanto ci si aspetterebbe dalla distribuzione di Boltzmann, la molecola
14N2, di simmetria D∞h, mostra le tipiche alternanze (in questo caso I = 1 quindi Jdispari : Jpari = 1: 2) dovute alla statistica nucleare che possono essere interpretate solo alla luce del principio di Pauli.
Termodinamiche

| Caratteristiche termodinamiche di N2 | |
| Punto di fusione (p = 1 bar) | 63,179 K |
| Entalpia di fusione (kJ mol−1) | 0,719 |
| Punto di ebollizione (p = 1 bar) | 77,244 K |
| Entalpia di vaporizzazione (kJ mol−1) | 5,586 |
| Entropia molare a 298 K (J K−1 mol−1) | 191,61 |
| Cp,m a 298 K (J K−1 mol−1) | 29,125 |
| Cv,m a 298 K (J K−1 mol−1) | 20,818 |
| Coefficiente di Joule-Thomson a 298 K (K atm−1) | 0,27 |
Stato gassoso
| Caratteristiche di N2 in fase gassosa | ||
| Densità (kg m−3, 1 bar, 298 K) | 1,1308 | |
| Temperatura critica | 126,3 K | |
| Pressione critica (atm) | 33,54 | |
| Volume critico (cm³ mol−1) | 90,10 | |
| Collision cross section (nm2) | 0,43 | |
| Parametro a dell'eq. di van der Waals (atm L2 mol−2) | 1,408 | |
| Parametro b dell'eq. di van der Waals (10−2L mol−1) | 3,913 | |
| Parametro ε del potenziale di Lennard-Jones (K/k) | 91,85 | |
| Parametro r0 del potenziale di Lennard-Jones (pm) | 391,9 | |
| Costante della legge di Henry a 298 K (K/torr) per H2O | 6,51×10−7 | |
| Entalpia di fisisorbimento (max osservata) (kJ mol−1) | −21 | |
| Entalpia di chemisorbimento (kJ mol−1) | Ta | −589 |
| Fe | −293 | |
Stato solido
Sono state osservate sei fasi solide dell'azoto, denominate α, β, γ,
δ, ε e ζ, ma a pressioni inferiori a 3500 bar
esistono solo le fasi alfa e beta. La temperatura di transizione tra le due fasi
alla pressione di 1 bar è 36,61 K. La fase alfa, quella che esiste a minor temperatura, ha un reticolo cubico a facce centrate
Errore in {{M}}: parametro 1 non è un numero valido.), mentre la fase beta un reticolo esagonale (a = 4 036 Å e
c = 6 630 Å). La fase gamma ha un reticolo tetragonale a corpo centrato. Le altre fasi sono stabili solo a
pressioni superiori a 20 000 bar.
Sopra l'elevatissima pressione di 1,5 Mbar vi è una fase semiconduttrice. Studi strutturali accurati non sono ancora stati eseguiti,
ma da misure spettroscopiche si può dedurre che non siano più presenti molecole N2.
Proprietà di trasporto
| Proprietà di trasporto di N2 in fase gassosa (p = 1 bar, T = 298 K) | |
| Conducibilità termica (W m−1 s−1) | 0,025724 |
| Conducibilità elettrica | — |
| Viscosità (μP) | 178,05 |
| Velocità del suono (m s−1) | 351,98 |
| Proprietà di trasporto di N2 in fase liquida (p = 1 bar, T = 77,244 K, p.eb.) | |
| Conducibilità termica (W m−1 s−1) | 0,14605 |
| Conducibilità elettrica | — |
| Viscosità (μP) | 1613,7 |
| Velocità del suono (m s−1) | 852,53 |
Applicazioni
Riepilogo
Prospettiva
Il diazoto viene utilizzato:
- In forma gassosa viene usato come gas criogenico.
- Come atmosfera inerte per proteggere i prodotti ( sodio,alimenti, composti organici , vini per esempio), oggetti o contenitori (serbatoi) dall'ossidazione, dalla corrosione, dagli insetti, dai funghi, ecc.
- Per regolare la composizione delle miscele respiratorie nelle camere di decompressione o nei serbatoi per le immersioni.
- Altri usi:
- Come pesticida per eliminare per asfissia dai tarli o da coleotteri che hanno colonizzato mobili di antiquariato (cornici, sculture e oggetti di legno, incunaboli, pergamene, stampe, etc.);
- gas di gonfiaggio degli accumulatori idraulici grazie alla sua passività nei confronti degli oli;
- Agente antincendio: combinato con argon al 50% e talvolta con anidride carbonica, è presente in alcuni sistemi automatici di estinzione del gas che proteggono le sale computer o aree di stoccaggio speciali che non devono essere danneggiate dal fuoco, polvere o acqua. Immagazzinato in sacchetti di metallo a una pressione di circa 200 bar , viene rilasciato in una stanza in cui è stato rilevato un incendio. Il volume di azoto iniettato sostituisce parte dell'atmosfera della stanza e provoca una diminuzione dei livelli di ossigeno nell'aria. Il livello generalmente mantenuto del 15% di comburente interrompe il fenomeno della combustione senza effetti letali sulla respirazione umana;
- Gas di gonfiaggio dei pneumatici. Sebbene l'aria contenga già il 78% di azoto (ossido di azoto per essere più precisi), alcuni professionisti dell'aviazione, del settore automobilistico e della Formula 1 aumentano questa proporzione e gonfiano i pneumatici con azoto quasi puro. Questo gas, avendo la proprietà di essere inerte e stabile, mantiene una pressione più costante anche in caso di riscaldamento intenso del pneumatico. Inoltre, fugge con difficoltà.
Sicurezza
Ioni correlati
Il diazoto possiede una certa tendenza a protonarsi; a seconda dei casi può subire una protonazione singola o doppia con la formazione rispettivamente del catione diazonio e del diazonio dicatione.
Diazonio
Lo ione diazonio ha formula chimica N2H+ con le strutture:
presenta una carica positiva dislocata sull'atomo di azoto derivato dalla protonazione del diazoto
- |N≡N| + H+ → |N≡N+-H
Diazonio dicatione
Lo ione diazonio dicatione ha formula chimica N2H2+2 con le strutture:
presenta due cariche positive nette dislocate sugli atomi di azoto, cariche che derivano dalla doppia protonazione del diazoto
- |N≡N| + 2H+ → HN+≡N+H
Note
Wikiwand - on
Seamless Wikipedia browsing. On steroids.





