Loading AI tools
Il carbonio-14 (14C) o radiocarbonio è un isotopo radioattivo del carbonio avente 6 protoni e 8 neutroni. Fu scoperto il 27 febbraio 1940 da Martin Kamen e Sam Ruben al laboratorio radiologico dell'Università della California di Berkeley, ma la sua esistenza era già stata ipotizzata da Franz Kurie nel 1934.[1]
| Carbonio-14 | |
|---|---|
| Generalità | |
| Simbolo | 14C |
| Protoni | 6 |
| Neutroni | 8 |
| Peso atomico | 14,0032419887 |
| Abbondanza isotopica | <10−12% |
| Proprietà fisiche | |
| Spin | 0 |
| Emivita | 5 730 anni |
| Decadimento | β− |
| Prodotto di decadimento | 14N |
| Energia di legame | 7,520319 MeV |
| Energia in eccesso | 3,01989305 MeV |
I tre isotopi del carbonio naturalmente presenti sulla Terra sono: 12C (99%), 13C (<1%) e in tracce il 14C. Il carbonio-14 è presente in natura con un'abbondanza relativa di 1 parte su mille miliardi di tutto il carbonio presente sulla Terra, a causa di un tempo di dimezzamento di soli 5730 anni.[2] La principale fonte di carbonio-14 sulla Terra è la reazione tra i raggi cosmici e l'azoto gassoso presente nell'atmosfera (nella troposfera e nella stratosfera): l'assorbimento di neutroni termici da parte dell'azoto forma un atomo di carbonio-14:

La produzione maggiore di carbonio-14 avviene ad una quota tra i 9 e i 15 km e ad alte latitudini geomagnetiche. Il carbonio-14 così prodotto reagisce con l'ossigeno per dare anidride carbonica 14CO2, che viene riutilizzata dalle piante durante la fotosintesi clorofilliana. In questo modo il carbonio-14 si trasferisce nei composti organici e, attraverso la rete alimentare, è presente ovunque secondo un preciso rapporto (abbondanza isotopica).[6] Essa penetra anche negli oceani, sciogliendosi nell'acqua.
Il carbonio-14 è anche prodotto nel ghiaccio da neutroni che causano reazioni di spallazione nucleare nell'ossigeno.
Il carbonio-14 può inoltre essere prodotto dai fulmini[7][8] ma in quantità trascurabili in confronto ai raggi cosmici.
Occasionalmente possono verificarsi dei picchi. Per esempio, vi è la prova di un aumento insolitamente alto del tasso di produzione nel periodo compreso tra il 774 e il 775 d.C.,[9] causato probabilmente da un evento estremo, rappresentato dal brillamento solare più forte degli ultimi dieci millenni.[10][11]
Grazie alla sua lunga emivita rispetto alla vita degli organismi viventi, il carbonio-14 rimane integrato in ogni sistema organico vivente. Dopo la morte, l'organismo smette di assumere carbonio-14. La quantità dell'isotopo presente nell'organismo nell'istante della sua morte andrà via via affievolendosi negli anni a causa del decadimento radioattivo.
Questo principio è sfruttato nella datazione radiometrica di campioni organici, tecnica con la quale si misura la quantità residua di carbonio-14 presente in un reperto archeologico organico (come un fossile o una struttura in legno): conoscendo la curva di decadimento e la quantità iniziale di carbonio-14 presente nel reperto quando la sua struttura organica era ancora vitale (ovvero un istante prima di morire), si può facilmente stabilire quanti anni sono trascorsi dalla morte dell'organismo. In generale, è possibile radiodatare solo reperti risalenti fino a 40 000-60 000 anni fa.[6]
La maggior parte dei prodotti chimici prodotti dall'uomo sono ottenuti a partire da combustibili fossili come il petrolio o il carbone, dove il carbonio-14 è decaduto. La presenza di tracce isotopiche di carbonio-14 in un campione di materiale carbonaceo indica quindi una possibile origine biogenica.
Formazione durante test nucleari
I test nucleari superficiali che vennero eseguiti in molti paesi tra il 1945 e il 1980 hanno drammaticamente aumentato la quantità di carbonio-14 nell'atmosfera e quindi anche nella biosfera. Da quando i test sono stati sospesi la concentrazione dell'isotopo ha cominciato a diminuire. Infatti la concentrazione di carbonio-14 in atmosfera corrisponde attualmente ad un'attività di 238 Bq/Kg[13] (prima dei test nucleari avvenuti a partire dal 1950 corrispondeva a 226 Bq/Kg[13]).[12]
Il carbonio-14 ha un'attività specifica (definita come il rapporto tra l’attività, A (Bq), di una sostanza radioattiva contenente un radionuclide e la massa in grammi quel radionuclide presente nella sostanza) di 1,66.1011 Bq/g.[13]
Il carbonio-14 subisce un decadimento beta- e decade quindi per emissione di un elettrone dando origine al nucleo figlio di azoto-14:
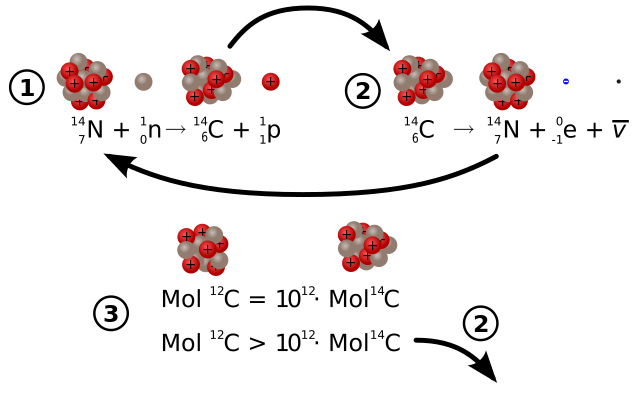
2: Decadimento del carbonio-14
3: L'equazione con l'uguale è per gli organismi viventi, mentre quella con il diverso è a ciclo vitale terminato, nel quale il 14C decade (Vedi 2).
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.