From Wikipedia, the free encyclopedia
A szerves kémiában a karbonilcsoport olyan funkciós csoport, amelyben egy szénatom kettős kötéssel kapcsolódik egy oxigénatomhoz: C=O.
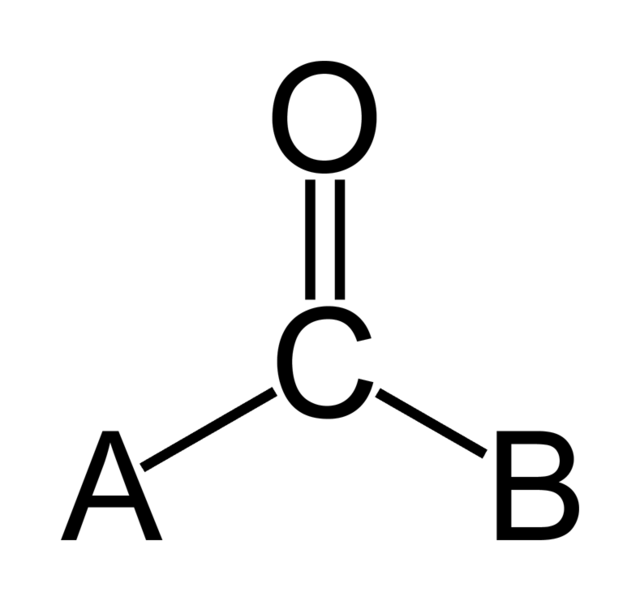
A karbonil kifejezés jelentheti a szén-monoxidot is, mint szervetlen vagy fémorganikus komplexek ligandumát (fém-karbonilokban, például nikkel-karbonilban); ilyenkor a szén és az oxigén között hármas kötés található: C≡O.
A cikk további része a szerves kémiai értelemben vett karbonillal foglalkozik, amikor a szén- és oxigénatom között kettős kötés van.
Karbonilcsoport az alábbi vegyülettípusokban fordul elő:
| Vegyület | Aldehid | Keton | Karbonsav | Észter | Amid | Enon | Savhalogenid | Savanhidrid |
| Szerkezet |  |  |  |  |  |  | ||
| Általános képlet | RCHO | RCOR' | RCOOH | RCOOR' | RCONR'R'' | RC(O)C(R')CR''R''' | RCOX | (RCO)2O |
A csoportba sorolásnál többnyire a legszűkebb meghatározás használatos. Az R(CO)O(CO)R' szerkezet például savanhidrid, nem pedig az általánosabb észter, noha jelen van benne az észterekre jellemző szerkezeti egység.

További szerves karbonilvegyületek a karbamid és a karbamátok, a kloroformátok és foszgén, melyek a savkloridok származékai, a karbonát észterek, tioészterek, laktonok, laktámok, hidroxamátok és izocianátok. Szervetlen karbonilvegyületre példa a szén-dioxid és karbonil-szulfid.
A karbonilvegyületek speciális csoportja az 1,3-dikarbonil vegyületek, melyek központi metilén részéhez savas protonok kapcsolódnak. Ilyen vegyület például a Meldrum-sav, a dietil-malonát és acetil-aceton.
Az oxigén elektronegativitása nagyobb, mint a széné, ezért a szénatomtól maga felé húzza az elektronsűrűséget, növelve ezzel a kötés polaritását. A karbonil szénatom ezért elektrofillé válik, és könnyebben lép reakcióba nukleofilekkel. Egyúttal az elektronegatív oxigén is reagálhat elektrofilekkel, például savas oldatban egy protonnal vagy más Lewis-savakkal.
A karbonilvegyületek alfa-hidrogénje sokkal (~103-szor) savasabb, mint az átlagos C−H kötés. Például az acetaldehid és aceton pKa értéke 16,7, illetve 19.[1] Ennek az az oka, hogy a karbonilvegyület rezonanciában van az enol tautomerrel. Az enol erős bázis hatására történő deprotonálódása enolátot hoz létre, amely erős nukleofil, és elektrofileket – például egy másik karbonilvegyületet – alkilezhet.
A karbonilszármazékok közül az amidok a legstabilabbak, ami a nitrogén-szén és szén-oxigén kötések közötti nagy rezonancia stabilitás eredménye.
A karbonilcsoport hidrid reagensekkel, például nátrium-borohidriddel és lítium-alumínium-hidriddel redukálható, vagy katalitikusan hidrogénezhető réz-kromit, Raney-nikkel, rénium, ruténium vagy akár ródium katalizátor alkalmazásával. Ketonok redukciója során szekunder alkohol keletkezik, aldehidekből, észterekből és karbonsavakból pedig primer alkohol.
A karbonilvegyületek alkilezhetők fémorganikus vegyületek, például lítiumorganikus és Grignard-reagens nukleofil támadásával. Az aldol-reakcióban enolátokkal is alkilezhetők.
További fontos reakciók:
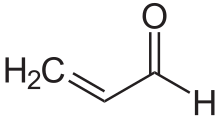
Az α,β-telítetlen karbonilvegyületek a karbonilvegyületek egyik fontos csoportja, általános képletük Cβ=Cα−(C=O)−. Ezekben a vegyületekben a karbonilcsoport egy alkénnel konjugálódik (erre utal a telítetlen jelző), ami különleges tulajdonságokat idéz elő. Telítetlen karbonilvegyület például az akrolein (propénal), mezitil-oxid, akrilsav és maleinsav. Telítetlen karbonilvegyület előállítható laboratóriumban aldol reakcióval és Perkin-reakcióval.
A karbonilcsoport elszívja az elektronokat az alkéntől, ezért az alkéncsoport az elektrofilekkel – például brómmal vagy hidrogén-kloriddal – szemben deaktiválódik.
Elektrofil addíciós reakciókban általános szabályként a nem szimmetrikus elektrofilek hidrogénje az α helyzetbe lép be. Ugyanakkor a nukleofil 1,4-addíciós reakciókban ezen vegyületek a nukleofilekkel szemben aktiváltak.
Ez a szócikk részben vagy egészben a Carbonyl című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.