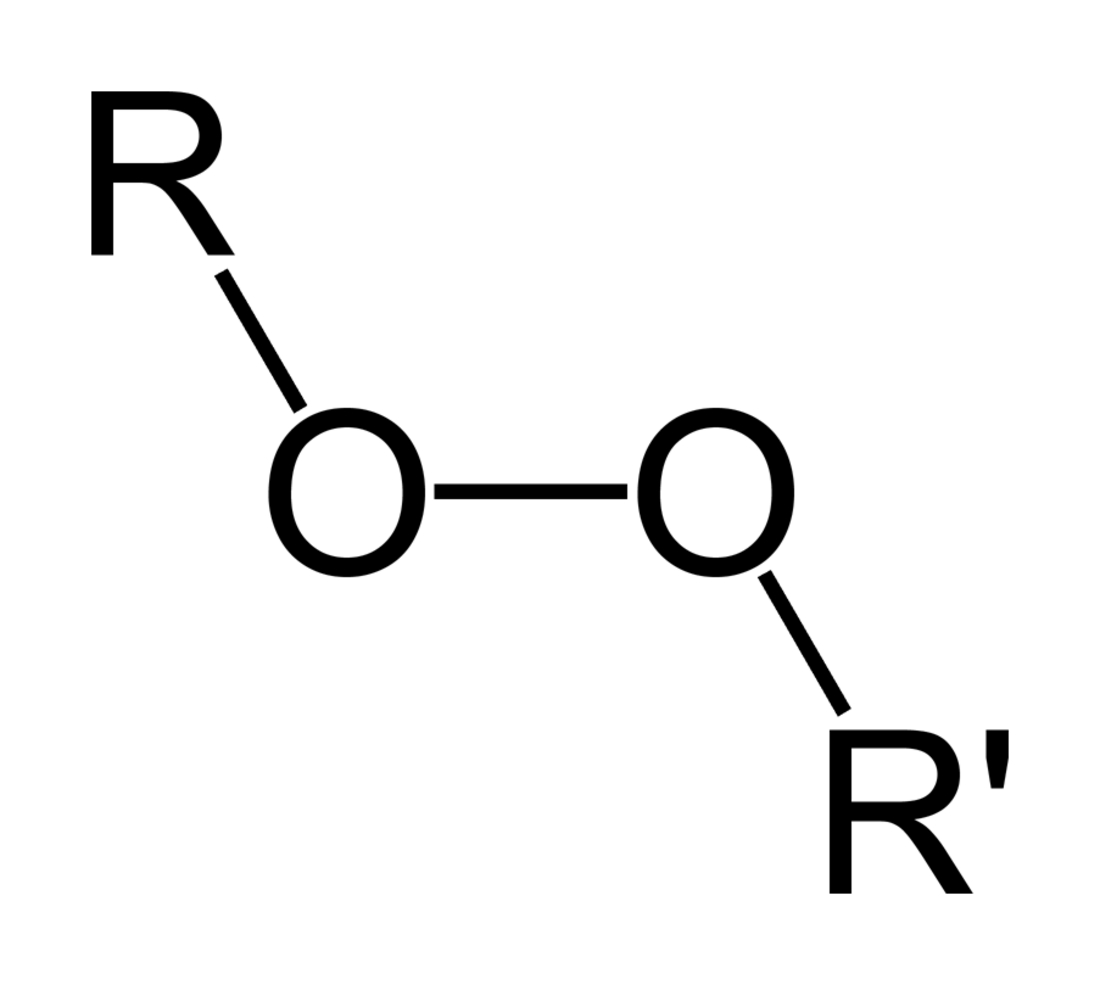
A szerves peroxidok olyan szerves vegyületek, melyekben peroxid funkciós csoport (ROOR') található. Ha az R' csoport hidrogén, akkor szerves hidroperoxidról beszélünk. A perészterek általános szerkezete RC(O)OOR. Az O−O kötés könnyen felszakad, ilyenkor RO· szabad gyökök keletkeznek. A szerves peroxidokat ezért bizonyos típusú polimerizációs reakciókban iniciátorként alkalmazzák, például az üvegszálerősítésű műanyagokban használt vinilésztergyanták esetén. Erre a célra gyakran használják a metil-etil-keton-peroxidot (MEKP) és a benzoil-peroxidot. Gyökkeltő voltuk miatt a szerves peroxidok ugyanakkor telítetlen kötéseket tartalmazó anyagokban szándékosan vagy véletlenül robbanásszerű polimerizációs reakciót indíthatnak. Ezt a folyamatot robbanószerekben is felhasználják. A szerves peroxidok – a szervetlen megfelelőikhez hasonlóan – erős fehérítőszerek.[1]



Tulajdonságaik
A peroxidokban az O−O kötéstávolság mintegy 145 pm, az R−O−O kötésszög (R = H, C) körülbelül 110° (a vízhez hasonló). Az C−O−O-R (R = H, C) diéderes szögek jellegzetesen 120° körüliek. Az O−O kötés viszonylag gyenge, kötés disszociációs energiája 45–50 kcal/mol (190–210 kJ/mol), ami kevesebb mint fele a C−C, C−H vagy C−O kötéserősségnek.[2]
A peroxidok oxidálóképessége a szubsztituensek elektronegativitásával van összefüggésben. Az elektrofil peroxidok O-átadó képessége nagyobb. A hidroperoxidok esetén az O-donor erősség az O−H kötés savasságával korrelál. Az oxidálóképesség így a CF3CO3H > CH3CO3H > H2O2 sorrendben változik.
Ipari felhasználása
Polimerkémia
A szerves peroxidokat számos, többnyire hasonló kémián alapuló célra alkalmazzák. Így tehát akceletároként, aktivátorként, keresztkötéseket kialakító adalékként, vulkanizálószerként, térhálósítóként, polimerizációs iniciátorként és promoterként használatosak. A festékekben és lakkokban található száradóolajok viselkedése is a hidroperoxidok képződésén alapul.
A metil-etil-keton-peroxidot, a benzoil-peroxidot és kisebb mértékben az aceton-peroxidot is iniciátorként használják néhány műgyanta, például poliészter és szilikon gyökös polimerizációval történő előállításánál, különösen ha üvegszálat készítenek.
Fehérítő- és fertőtlenítőszer
A benzoil- és a hidrogén-peroxidot a liszt fehérítésére és kezelésére alkalmazzák, hogy a szemcsék gluténleadását gyorsítsák. Másik lehetőségként a lisztet levegőn állva kell oxidálódni hagyni, de ez a folyamat az ipar korában túlságosan lassú. A benzoil-peroxid az akné legtöbb fajtájának kezelésére hatásos helyileg alkalmazott gyógyszer.
Szerves vegyületek szintézise
Számos szerves vegyületet állítanak elő peroxidok felhasználásával, ezek közül a legismertebbek az alkénekből előállított epoxidok. A terc-butil-hidroperoxid (TBHP) szerves fázisban oldódó oxidálószer, melyet többféle fém által katalizált oxidációs reakcióban, például a Halcon-folyamatban (propilén-oxid előállítása) és a Sharpless-epoxidálásban alkalmaznak.
Robbanószerek
Az aceton-peroxid előállítása egyszerű, ezért instabilitása ellenére a katonai jellegű szervezetek által használt robbanószerek összetevője. Hő-, dörzs- és ütésérzékenysége közismert.
Előállítása
Autoxidáció
A peroxidok nagy részét szénhidrogénekre történő O2 addícióval állítják elő. Ezzel a módszerrel az allil- és benzil-helyzetű C−H kötések reagáltathatók.[3] A kumol-hidroperoxid a fenol kumolból történő ipari előállításának közbenső terméke (kumol-eljárás). Az éterek különösen hajlamosok peroxidok képzésére, tipikus példa a dietil-éter-peroxid keletkezése. A diének fotooxidációja során dialkil-peroxidok keletkeznek.
Számos fémorganikus vegyület is képes O2-t beilleszteni a fém-szén-kötésbe. A lítiumorganikus és Grignard-reagensek O2-nel hidrolízist követően hidroperoxidokká alakulnak. Az alkének oximerkurálását követő hidroperoxidos reakció hasonlóan játszódik le.
H2O2-ból
A karbonsavakból hidrogén-peroxiddal reagálva peroxisavak keletkeznek.
Reakciói
A peroxidok néhány reakciója:
- lítium-alumínium-hidriddel vagy foszfit-észterekkel alkoholokká redukálhatók
- a bázis által katalizált Kornblum–DeLaMare-átrendeződés során lánchasadással ketonná és alkohollá alakíthatók.
Veszélyek
Mivel a szerves peroxidok ugyanabban a molekulában lazán kötött oxigént, valamint hidrogént és szenet tartalmaznak, ezért könnyen meggyújthatók, gyorsan és hevesen égnek. Ugyanez igaz a szerves peroxidokkal szennyezett anyagokra is. Mivel egyes anyagokban spontán módon is keletkezhetnek peroxidok, ezért ezeket az anyagokat körültekintően kell kezelni. Ide tartoznak például a gyakori éterek: a dietil-éter, a tetrahidrofurán vagy az etilén-glikol-dimetil-éter.
Az erős robbanószerként ismert aceton-peroxid több kémiai reakció nem kívánt és veszélyes mellékterméke, az MDMA szintézisétől kezdve (ahol az izoszafrol acetonban történő oxidációjának mellékterméke) a fenol ipari előállításáig (ahol a kumol-eljárás második terméke, az aceton a második reakciólépésében részlegesen peroxiddá oxidálódik).
Szerves peroxidok véletlenül is előállíthatók, ha keton oldószert (ez általában aceton) hidrogén-peroxidot vagy más oxidálószert tartalmazó hulladékkal keverünk, majd a keveréket néhány órára állni hagyjuk.
Fémekkel hajlamosak robbanásszerűen reagálni. Fényre érzékenyek, ezért sötétben kell tárolni őket. Egy részük szobahőmérsékleten bomlik, és a bomlás során gázállapotú termék keletkezik, az edény fedelén gázkivezető nyílásoknak kell lennie. Néhány peroxidot az öngyorsuló bomlási hőmérséklete alapján hűtve kell tárolni.
Peroxidok ártalmatlanítása
Kis mennyiségű szerves peroxid 10%-osra vagy annál jobban higított formában óvatosan elégetve vagy hidrolízissel megsemmisíthető. A hidrolízishez 80 rész vizet, 20 rész nátrium-hidroxidot és (a peroxid kristályok jobb nedvesíthetősége miatt) 0,3 rész felületaktív anyagot tartalmazó oldat használatos. Az oldat ajánlott mennyisége a peroxid tömegének 10-szerese. A peroxidot óvatosan, folyamatos keverés mellett kell az oldatba adni, hogy elkerüljük a helyi túlmelegedést. A reakció kissé exoterm, de külön hűtés nem szükséges. A reakció lassú, mintegy 12-24 órás kevertetést igényel, ezt követően tekinthető úgy, hogy a peroxid elbomlott.
Kapcsolódó szócikkek
- Peroxiacil-nitrátok
- Ozonid
Jegyzetek
Fordítás
További információk
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.