Sejtkommunikáció
kommunikáció a sejtek között From Wikipedia, the free encyclopedia
kommunikáció a sejtek között From Wikipedia, the free encyclopedia
A sejtkommunikáció határozza meg a sejtek alapvető tevékenységeit és szabályozza a sejtek összehangolt működését.





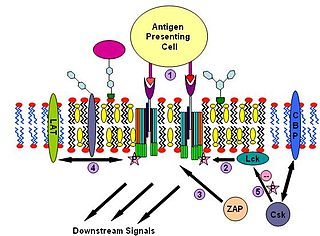


A biológiai folyamatok összetett molekuláris kölcsönhatások, amelyek nagyban támaszkodnak a jelek használatára. Az egyedfejlődésnek, a szövetgyógyulásnak, az immunitásnak és a szövet homeosztázisának alapvető feltétele, hogy a sejtek képesek legyenek jelek segítségével a mikrokörnyezetüket megfelelően érzékelni és arra helyes választ adni. A jelekkel kapcsolatos kölcsönhatásokban és a sejtek információfeldolgozásában előforduló hibák akár betegségeket is okozhatnak, például autoimmun betegségeket, cukorbetegséget, rákot.
Az első tudományos irodalom, amely specifikusan a jelátvitel kifejezést tartalmazta, 1972-ben jelent meg a MEDLINE adatbázisában. Az 1980-as évek végén, 1990-es évek kezdetén jelentek meg nagy számban azok a tanulmányok, tudományos cikkek, amelyek kifejezetten a jelátviteli folyamatokkal foglalkoztak. A jelátvitel (signal transduction) elnevezés a „transduce” szóból származik, aminek jelentése: „átvezet”.
Kémiai jelátvivők azok a molekulák, amelyek kizárólagos funkciója az információátadás, amelyek csak akkor kerülnek ki a sejtből vagy sejten belül, ha az üzenetre szükség van.
A jelút a jelátvitel útja, a jelfogótól a végrehajtó molekuláig tartó biokémiai folyamat, amely információ átadását eredményezi.[1][2][3] A biológiában a jelátvitel során a sejten kívüli jelátviteli molekulák membránreceptorokat aktiválnak, amelyek a sejten belüli jelátviteli molekulákat válasz adására serkentik.[4][5] A jelátvitelen alapul a külső és belső környezet sejtszintű érzékelése is, amely biztosítja a homeosztázist, a belső környezet állandóságát. A kémiai jelátvitel a sejtek közötti információ kémiai úton történő transzportja. Az egyik sejt (jeladó) által kibocsátott molekula egy másik sejt (jelfogó) számára információt hordoz, az illető sejt felfogja ezt és működésében változássá alakítja át.
A jelút több biokémiai folyamatból áll. A jeladó jelmolekulával üzen, ezt egy receptorfehérje fogadja (jelfogó) és átszállítja a jel-receptor-komplex jelzését a sejtplazmán keresztül a sejtmagban található DNS-hez, amely a megfelelő géneket beindítja és elkezdődik a génátíródás, majd a célfehérje képződése.[6] A keletkezett célfehérjéktől függően alakul a biokémiai hatás. A jelút tehát többlépcsős biokémiai folyamatból áll, a jelszállító anyag létrehozása és kibocsátása, bemutatása, hogy megkösse a jelet felfogó molekula (receptor), és az elküldött jelzésre válaszoljon. A biológiai jelátvitelben megkülönböztetik a sejthez kívülről érkező és a sejtben keletkező jelek átvitelét.[7]
A jelvonal egy jelátviteli szakasz, a jelútnak egy része, amely szokványos biokémiai folyamatként realizálódik, több jelútba is képes beépülni.[8] A jelút során a molekulák egymásra hatása szokványos, enzimek gerjesztik egymást láncszerűen, egy bekapcsolt enzim gerjeszt egy másik enzimet és így tovább. A gerjesztés egy aktiválás, rendszerint foszforilálással megy végbe, jóllehet több formája is létezik, például a foszfátcsoport-elvonás a defoszforilálás.


A Földön a baktériumok kb. 3,5 milliárd évvel, míg az első többsejtű élőlények csak 1 milliárd évvel ezelőtt jelenhettek meg. Ez jelenti azt is, hogy a soksejtűség létrejötte bonyolult, összetett folyamat volt, hiszen 2,5-szer több idő kellett hozzá, mint az összes soksejtű szervezet evolúciójához. Nagyon fontos, hogy egy soksejtű szervezetben a sejtek között a szervezet egészének működését szolgáló együttműködés alakuljon ki.
Az élő sejt jellemzője, hogy anyagcsere-folyamatait a környezetével folytonos kölcsönhatásban képes fenntartani. Környezetéből számos inger éri: hő, sugárzás, mechanikai, elektromos ingerek, kémiai jelek. Különösen fontosak ezek a sejten kívüli jelek a többsejtű szervezetek esetében. A sejtek közötti információáramlás biztosítja ennek köszönhetően a szervezet egészének homeosztázisát. A sejtek közötti információáramlás döntően kémiai anyagok részvételével történik. Ebben az esetben kémiai jelátvitelről, szignáltranszdukcióról beszélünk.
A kémiai kommunikáció általános elve:
A sejt be van zárva egy lipofil („zsírkedvelő”, vagyis zsírokban könnyen oldódó) plazmamembránba, amely keresztezi az összes bejövő jel útját. Hidrofób („vizet nem kedvelő”, vagyis vízben nem oldódó) hormonok, mint például a szteroidhormonok, egyszerű diffúzióval jutnak át a sejtfelszíni akadályon, hogy hozzáférjenek a fehérjereceptorokhoz a citoplazmában vagy a sejtmagban. Bonyolultabb mechanizmusokra van szükség a vízben oldható jelmolekuláknak (pl.: hormonok, neurotranszmitterek és növekedési faktorok) esetében, amelyek nem képesek a plazmamembránon diffúzióval átjutni.
A többsejtűekben a sejtek között egy olyan információcserére alkalmas hálózatos rendszer alakult ki, amely képes arra, hogy az egész szervezet életben maradását, normális működését szolgálja a sejtek közötti koordináció, funkcionális együttműködés segítségével. A sejtek közötti információáramlás, az egyes sejtek által kapott és adott jelek rendszere határozza meg a sejtek pozícióját, funkciójukat az egyedfejlődés, majd a kifejlett élet során. Ha valami folytán kiesik az információáramlás rendszeréből egy sejt, akkor vagy elpusztul, vagy kóros elváltozásokat fog mutatni.

A sejthez kívülről érkező jelek (stimulus, mediátor) által kiváltott információáramlás lépései:
Az oldékony jelátvivő molekulák a sejten kívüli (extracelluláris) téren keresztül juttatják el az információt a különböző távolságban található célsejtekhez, így biztosítják a sejtek közötti információáramlást.

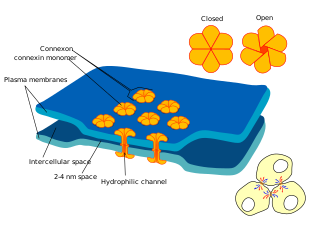
A szomszédos sejtek membránját átívelő speciális ioncsatornákon folyik az információáramlás. A gap junction alacsony ellenállású csatorna, amely egy intercelluláris (sejtek közötti) átjárót biztosít az ionok és kis molekulák áramlásához az egyik sejtből a másikba. Az ilyen közvetlen kommunikáció nagyon gyors, és különösen fontos az ingerelhető sejtekben, például a szívben. A gap junction nagy család (21 gén emberben) a connexineké (CXS), az különbözteti meg egymástól, hogy molekulatömege, amit jelez a követő szám a Cx rövidítése. Például, Cx43 a fő gap junction fehérje az asztrocitákban.

Az oldékony jelátvivő-molekulák a sejten kívüli téren keresztül juttatják el az információt a különböző távolságban található célsejtekhez, így biztosítják a sejtek közötti információáramlást. A jelátviteli molekulát termelő és kiválasztó sejt és a célsejt közötti távolság alapján négyféle jelátviteli folyamat különböztethető meg:
Nagy a távolság, a jelmolekula olykor szállítófehérjéhez kötötten, a vérárammal jut el a célsejthez. A többsejtűeknek szükségük van távolra ható jelmechanizmusokra, hogy koordinálni tudják a test működését. A belső elválasztású mirigyek hormonokat bocsátanak a vérbe. A hormonok az őket felismerő receptorokat tartalmazó sejtekhez kapcsolódnak. A szinaptikus kapcsolatok jellegzetessége a jelek távolra való küldése sejt-sejt kontaktus útján. A küldő, szinapszis előtti idegsejt közvetlenül adja át az információt a fogadó, szinapszis utáni neuronnak, azonban a fogadóneuron továbbítja a jelet a távoli célpontokhoz.
Közel helyezkedik el a célsejthez a parakrin jelet termelő sejt, a célmolekula egyszerű diffúzióval jut el a célsejthez. A közeli sejtek egymásra való hatása a parakrin jelátvitel. Az immunválasz részeként a fehérvérsejtek egy patogén támadására való válaszként, sokféle citokint és kemokint termelnek más fehérvérsejtek és egyéb lokális sejtek működésének befolyásolására. A parakrin szignálok nem diffundálhatnak messzire a közeli hatás esetében. Ezeket a molekulákat gyorsan felveszik a környező sejtek, majd elbontják a sejten kívüli enzimek, vagy immobilizálódnak a sejten kívüli (extracelluláris) mátrixon. Az ellentétes élettani hatással bíró molekulák szintén gátolják a parakrin jelek távoli hatását úgy, hogy hozzákapcsolódnak a jelmolekulához, vagy annak receptorához.
A mediátort termelő sejt és a célsejt egy és ugyanaz. A sejtek képesek kibocsátani olyan jeleket, amelyekre saját maguk válaszolnak. Az önszabályozás során a szomszéd sejteknek küldött jel a küldő sejt saját receptoraira is hat, negatív visszacsatolás útján. Az önszabályozó mechanizmus során a küldő sejt érzékeli azt, ha megfelelő számú jelmolekulát bocsátott ki a környezetébe és erre válaszul csökkenti saját aktivitását. Az adenozin egy példa az autokrin tényezőre, amely úgy működik, mint egy endogén alvásszabályozó molekula.
Az orexin az alvás és ébrenlét központi szabályozásában játszik fontos szerepet. Két orexin ismert (orexin-A és orexin-B), amelyek peptid neurotranszmitterek. Ezek a neurotranszmitterek a 7000 db orexin neuronban szintetizálódnak, és ebből szabadulnak fel, a neuronok a laterális hipotalamuszban találhatók. Egy prepro-orexin prekurzor peptidből szintetizálódnak, amelyek feldolgozott állapotban alkotják az orexin-A-t (egy 33 aminosavból álló peptidet) és az orexin-B-t (egy 28 aminosavból álló peptidet). Az orexin-A az OX1-receptorokon keresztül hat, amely kapcsolódik Gq/11-hez és a Gi/o-hoz is, így aktiválva a foszfolipáz C-t (PLC), az INSP3-t és a diacil-glicerolt (DAG), így gátolja a cAMP másodlagos hírvivőn keresztül megvalósuló jelátviteli útvonalat.
A receptorfehérjék jellemezhetők a ligandkötéssel és a végrehajtó (effektor) specifitásával. A sejtes választ a sejten kívülről érkező jelmolekula receptorhoz való specifikus kötődése határozza meg. A receptor elhelyezkedhet a sejten kívül (extracellulárisan), ez esetben a sejt felszínén, annak plazmamembránjában, illetve sejten belül (intracellulárisan), ez esetben vagy a sejt magjában vagy valahol a sejtmagon kívül, bárhol a sejt citoplazmájában. A jelmolekula lehet hormon, feromon vagy neurotranszmitter, amely mind ligandként viselkedik. A ligand a receptor meghatározott részéhez kötődik vagy „illeszkedik”. A ligand-receptor kötődés a receptor molekulaszerkezetének térbeli elhelyezkedésében történő változását (ún. konformációváltozását) eredményezi, amely esemény különféle biokémiai reakciók sorozatát indítja el, aminek végső következménye a sejtre jellemző specifikus válasz.
A sejtek számos, egyértelműen meghatározott jelutat használnak működésük szabályozásához. A figyelem középpontjában azok a mechanizmusok állnak, amelyek felelősek az információ sejtbe juttatását. Ezek két fő csoportba sorolhatók attól függően, hogyan történik a bekapcsolásuk. Legtöbbjük aktivált külső inger, amely információk közvetítése sejtfelszíni belső effektor rendszerekkel történik.
Az ioncsatornáknak két fő jelátviteli funkciójuk van: egyrészt képesek második hírvivőt termelni, másrészt effektorként is képesek működni, válaszolva, mint egy hírvivő. Szerepük elsősorban a jelgenerálás, középpontban a Ca2+-jelátviteli útvonallal, mely számos Ca2+ entry (belépés)- csatornából és a sejten belüli Ca2+ realese (kilépés, felszabadulás)- csatornából áll, mindkettő hozzájárul a Ca2+-jel generálásához.

A celluláris folyamatokat a jelutakon keresztül ható érzékelők (receptorok) szabályozzák úgy, hogy serkentik a további felhasználó (downstream) végrehajtó molekulákat (effektor), amelyek felelősek a különböző sejtfolyamatok irányításáért. Egyes esetekben az effektorok működése viszonylag egyszerű, amely egyetlen downstream effektor rendszer, de ennél bonyolultabb effektor rendszerek is léteznek, még több összetevővel. Ilyen vezérlésért felelős folyamat például a membrán- és fehérje-transzport, endocitózis, exocitózis, fagocitózis, motoros fehérjék, a géntranszkripció, génelfojtás és aktin-átalakítás.[9]
A különböző jelek, ingerek, szignálok hidrofil (vízoldékony, lipofób) vagy hidrofób (víztaszító, lipofil) tulajdonságuktól függően extra- vagy intracelluláris receptorokhoz kötődnek. Az extracelluláris receptorok feladata, hogy a szignál megkötése esetén a szignál által kiváltott jelet a sejt belsejébe továbbítsa. Az extracelluláris receptorok 3 fő csoportja alakult ki az evolúció során: a saját enzimaktivitással rendelkező receptorok, a 7-transzmembrán doménnel rendelkező (7-TM) vagy másnéven G-fehérjéhez kapcsolt (angolul G-protein coupled receptors, GPCRs) receptorok és a rodopszin-szerű receptorok csoportja.
Emberben 48 receptor ismert, de számos orphan receptor (árva receptor) létezik.
A jelutak belső jelzéseket generáló és azokból az OFF-folyamatokból állnak, amelyek eltávolítják azokat a jelzéseket, amelyek a sejtet kívülről stimulálják. A legnagyobb figyelmet arra kell fordítani, hogy milyen folyamatok vesznek részt a másodlagos hírvivők és downstream hatások inaktiválódásában. A másodlagos hírvivő cAMP és cGMP foszfodiészteráz (PDE) segítségével inaktiválódik. Az inozitol-trifoszfát (INSP-3) metabolizmusát az inozit-trifoszfatáz és az inozit-foszfatáz végzi. A diacil-glicerinné (DAG) alakulás két enzimrendszer a DAG-kináz és a DAG lipáz metabolizmusa révén történik.
Az élő szervezet sejtfunkciói és ezek hatékonysága nagyban függ a jelutak térbeli és időbeli voltától. Ami a térbeli szerveződést illeti, a jelkomponensek magasan szervezettek abban a tekintetben, hogy a sejt hol helyezkedik el, és hogyan továbbítja az információkat az egyik régióból a másikba. A jelutak térbeli szerveződése függ a molekuláris kölcsönhatásoktól, amelyek a jelátviteli doméneket használó jelátviteli komponensek között jönnek létre a jelutak kialakítása érdekében. Nagyon gyakran a komponensek felelősek az információcseréért, szerkezeti fehérjékkel megerősítve tartják a helyükön, makromolekuláris jelátviteli komplexet alkotva.
A jelutak különböző speciális érzékelőkkel és végrehajtókkal működő hírvivő rendszerek, abból a célból, hogy ellenőrizzék a különböző sejttípusokat. Minden speciális sejttípus kifejlesztett egy ellenőrzési mechanizmust, hogy bizonyos funkciók ellátására képes legyen.
A sejtproliferáció az a folyamat, amelynek során a sejtek reprodukálják önmagukat, növekednek, majd kettéosztódnak két egyenlő példányra. A növekedési faktorok számos növekedési faktor jelátviteli útvonalat használnak a sejtek aktiválásához, hogy belépjenek a sejtciklusba.
A központi idegrendszer tartalmaz körülbelül egy billió (1012) neuront, amelyek össze vannak kötve egymással, neuronális áramkörök formájában. A memória kialakítása az egyik elsődleges feladata ezeknek a neuronális áramköröknek, jelutak segítségével.
A sejteket ért intrinsic jelátviteli mechanizmusok, amelyek képesek érzékelni a különböző káros hatásokat, reagálni képesek különböző stressz válaszokkal.
Az egyedfejlődés folyamata a megtermékenyítéssel kezdődik, és az összetett, többsejtű élőlény kifejlődésével, éretté válásával zárul. A fejlődés során egyes sejttípusokat hoz létre a konkrét jelutakkal, amelyek szükségesek a sajátos funkciókhoz. A stabilitását ezen sejt-specifikus jelutak tartják egy belső értékelési rendszerrel, amelyek biztosítják, hogy a sejtek továbbra is szállítsák a megfelelő jeleket a szükséges szabályozó tevékenységükhöz.
Számos betegség oka egy hiba a jelút működése során. Ezek a hibák genotípusos vagy fenotípusos változásokat okoznak a sejtspecifikus jelátviteli utakban, amelyek szabályozzák az összetett celluláris funkciókat.

J. N. Langley 1905-ben kifejti azt az elméletét, hogy ingerlő és gátló (ún. "receptív anyagok") vannak a végrehajtó sejteken.[10]
A gyorsult ciklus („turnover”) jelenségét L. E. Hokin és M. Hokin írja le 1953-ban, vagyis egyes sejten kívüli jelmolekulák a plazmamembránban lévő inozitol (inozitol-trifoszfát) lipidekben felgyorsul a radioaktív foszfát beépülése. A gyorsult „turnover” jelenségének alapvető jelentősége csak évtizedekkel később derül ki.
A gyorsult „turnover” jelenségének jelentősége az inozitol-1,4,5-triszfoszfátot (IP3) M. J. Berridge és R. F. Irvine (1983-84) felfedezésével derül ki. Bebizonyítják, hogy egyes jelzőmolekulák hatására a membrán inozitol lipidjeiből IP3 hasad le úgy, hogy az IP3 a sejten belül Ca2+-jelet termel.
A ciklikus adenozin-monofoszfát (más néven ciklikus AMP vagy cAMP) szintézisét katalizáló enzimet 1959-ben E. W. Sutherland felfedezi, azt állítja, hogy egyes hormonok sejtmembránnal kialakult kapcsolata után egy „második hirvivő”, a ciklikus AMP felszabadulását eredményezi.
1973-ban M. Rodbell és kollégái kimutatják, hogy a cikláz aktiváláshoz GTP-re van szükség a cAMP rendszerben. A ciklázt aktiváló rendszer alkotórészét egy GTP-t kötő és hidrolizáló fehérjét (G-fehérje, heterotrimer G-fehérje) A. G. Gilman kollégáival a kutatások folytatásaként felfedezi.
E. H. Fisher és E. G. Krebs felfedezi 1955-ben, hogy a glikogén-foszforiláz aktivitását reverzíbilisen szabályozza az enzim foszforilációja a glikogén lebontásában. A cAMP-dependens proteinkináz felelős az enzim foszforilációjáért. Világossá válik, hogy a sejtműködés szabályozásának egyik alapvető mechanizmusa a fehérjék reverzíbilis foszforilációja.
Y. Nishizuka 1977-ben fedezi fel. Évekkel később kiderül, hogy egyes G-fehérjékhez kapcsolt receptorok ligandkötésekor a membránlipidekből diacil-glicerol válik szabaddá. A diacil-glicerin aktiválja a proteinkináz C enzimet.
R. F. Furchgott és J. V. Zawadski rájönnek 1980-ban arra, hogy az endothelium jelenléte szükséges egyes anyagok (pl. acetilkolin) értágító hatásához. Az (endothel-derived relaxation factor, EDRF) szabadul fel az érendothelből, amely értágító anyag.
1986-ban F. Murad munkatársaival nyilvánosságra hozzák felfedezésüket, vagyis az értágító hatású szerves nitrit- és nitrátvegyületekből szabad gyök, nitrogén-monoxid szabadul fel, és az értágító hatásért a guanilát-cikláz aktiválása a felelős.
L. J. Ignarro kollégáival 1987-ben, valamint S. Moncada kollégáival bizonyítják azt, hogy az EDRF azonos a nitrogén-monoxiddal.
Ez a szócikk részben vagy egészben a Cell signaling című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.