From Wikipedia, the free encyclopedia
Keratin (još i: rožnata supstanca, skleroprotein, citokeratin) je bjelančevina (strukturni protein) koja je odgovorna za stabilnost i oblik stanice.
Određene podgrupe ovog proteina (tzv. trihocitični keratini) su glavni sastojak kose i dlake sisavaca, ljusaka kod gmazova, perja, noktiju, kandži, rogova, usi kod kitova usana.
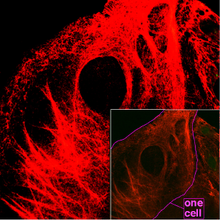
Keratin je skupina netopljivih citoskeletnih proteina koji pružaju strukturnu potporu epitelnim stanicama te djeluju kao važni markeri stanične diferencijacije. U jednostavnom epitelu, keratini su manje kompleksni, dok se u slojevitom epitelu javljaju u većoj raznolikosti i gustoći, pružajući dodatnu čvrstoću i otpornost.[1]
Alfa-keratin (α-keratin) je specifična vrsta keratina koja čini ključan strukturni materijal u različitim dijelovima tijela kod kralježnjaka, uključujući kosu, nokte, perje, rogove, kandže, kopita te epidermu. Beta-keratin (β-keratin) je član obitelji strukturnih proteina koji se nalazi u epidermisu gmazova i ptica. Obje vrste se nalaze u stratum corneum-u no alfa-keratini su bogati alfa-spiralama dok su beta-keratini bogati beta-pločama.
Nakon 1970-ih, istraživanja keratina proširila su se na proučavanje različitih oblika gela i filmova iz keratinskih otopina.[2] Prvi rad o keratinskim biomaterijalima opisuje uspješan implantat vaskularnog grafta obloženog keratinskim derivatom u modelu velike životinje tijekom 200 dana. Od tada, keratini se primjenjuju u širokom spektru in vitro i prekliničkih modela, uključujući zacjeljivanje rana, regeneraciju kostiju,[3] i popravak perifernih živaca.[4]
Keratini su intermedijarni filamenti promjera 10-12 nm koji zajedno s mikrofilamentima i mikrotubulima čine citoskelet ljudskih stanica.[5] Oni se sastoje od obligatnih heterodimera koji se sastoje od keratina tipa I (kiseli) i tipa II (neutralni ili bazični) te se slažu u tetramere koji polimeriziraju da bi formirali protofilamente od 2 do 3 nm.[6] Daljnja polimerizacija protofilamenta čini međusobno isprepletene protofibrile potpunih intermedijarnih filamenata. Keratin sadrži N-terminalnu domenu, zaduženu za regulaciju rasporeda filamenata i interakcije s ostalim staničnim komponentama. Također sadrži i C-terminalnu domenu koja igra uloge u interakcijama između intermedijarnih filamenata i post-translacijskim modifikacijama.
Keratini su glavna komponenta epitelnog citoskeleta. Različiti tipovi keratina nalaze se u različitim slojevima epidermisa, a iznimno su bitni u vanjskom sloju kože (stratum corneum), gdje mrtve keratizirane stanice čine kožnu barijeru. Kod interfolikularnog epidermisa, KRT14-KRT15 je glavni ekspresionirani tip I-tip II keratin, dok je u suprabazalnim slojevima glavni keratinski par KRT10-KRT1.[7] Osim toga, keratini oblažu vanjštinu organa i žlijezda, te su glavna komponenta tvorevina kao što su nokti i kosa.
Glavna uloga keratina je strukturna potpora i stanična adhezija pomoću kojih se održava pravilna mehanička čvrstoća i elastičnost epitelnih slojeva. Keratin je povezan s desmosomalnim i hemidesmosomalnim proteinima te tvori keratinoznu mrežu kroz cijeli citosol stanice.[8] Uz stukturnu ulogu također služi za održavanje pravilne količine vode te tvori funkcionalnu barijeru za zaštitu od mehaničkog stresa.
Keratinski intermedijarni filamenti povezani su s aktivacijom primitivnog urođenog imunosnog sustava, što se očitava kroz djelomična otvaranja čvrtih spojnica, smanjenje barijerne funkcije, sekreciju anti-bakterijskih proteina te nakupljanje makrofaga i drugih bitnih citokina imunosnog sustava. Promjene u ekspresiji citokina također su u asocijaciji s gubitkom ekspresije citokina ili keratinskim mutacijama koje su povezane s određenim bolestima. Uz manjak keratina, događa se promjena u transkriptomu keratinocita pa tako određene keratinske deficijencije mogu oponašati gensku ekspresiju određenih bolesti. Na primjer, deficijencija K1 keratina dovodi do ekspresije genskog obrasca koji uvjetuje stvaranje psorijaze i ekcema.[9]
Keratin ima tkivno specifičnu ulogu u borbi protiv apoptoze kod jetre, posteljice i kožnog epitelija. Kod keratinskog deficijenta dolazi do srednjogestacijskog mortaliteta zbog apoptoze u trofoblastu.[9] Ova karakteristika bitna je u istraživanjima utjecaja spojeva koji induciraju fibrozu na jetru kod miševa koji imaju keratinski deficijent ili mutaciju u keratinskim tipovima.
Fosforilacija keratina inducira topljivost, održavajući ravnotežu između nitastih i topljivih keratina koja je iznimno bitna za očuvanje gipkosti citoskeleta. Keratin se ponaša kao „fosfatna spužva“, a kofaktori u procesu fosforilacije su regulacijski proteini 14-3-3. Fosforilacija keratina aktivno dopridonosi mehanizmu obrane od različitih tipova stresa, a ima i bitan utjecaj u borbi protiv nastanka određenih bolesti i tumora.[10]
Kod ljudi, poznato je 54 vrste keratina koje su izražene u određenim parovima ovisno o diferencijaciji tipa tkiva. Primjerice, primarni keratini kao što su K8/K18 u jednostavnim epitelnim tkivima i K5/K14 u slojevitim epitelnim tkivima redovito se sintetiziraju od strane epitelnih stanica.[11] Sekundarni keratini, poput K7/K19 u jednostavnim epitelnim tkivima ili K15 i K6/K16 u slojevitim epitelnim tkivima, mogu se također proizvoditi uz ili umjesto primarnih keratina. Ova raznolikost keratina izražena je u različitim epitelnim tkivima i vrstama, što ukazuje na njihovu sposobnost prilagodbe strukturnim zahtjevima različitih tkiva u tijelu.
Ekstrakcija keratina iz tkiva obično uključuje uporabu redukcijskih agenasa poput tioglikolata, ditiotretiola ili merkaptoetanola, koji razbijaju disulfidne veze.[11] Produkt korištenja redukcijskog sredstva je protein koji sadrži cistein te se naziva „keratein“.[2] Ukoliko se koristi oksidacijsko sredstvo (npr. vodikov peroksid),[12] derivati cisteinske kiseline se nazivaju „keratoze“. Najčešće korištene tehnike za analiziranje keratina uključuju SDS-PAGE,[13] masenu spektrometriju,[14] rendgensku difrakciju[15] i kristalografiju te infracrvenu spektroskopiju s fourierovom transformacijom.[16]
Mutacije gena za keratine povezane su s nekoliko kožnih bolesti te poremećaja kose i sluznice. Kožni poremećaji uključuju buloznu epidermolizu, palmoplantarno keratodermu, epidermolitičku ihtiozu i pachyonychia congenita.[5] Ove bolesti rezultat su strukturne nestabilnosti epitelnih stanica. Mutacije u trihocitnim keratinima, keratinima koji se izražavaju u stanicama epidermalnih dodataka kao što su kosa, nokti i koža, dovode do bolesti poput monilethrixa i ektodermalne displazije. Osim toga, keratini igraju ključnu ulogu u karcinogenezi, gdje abnormalnosti i mutacije u genima mogu doprinijeti razvoju kožnih karcinoma narušavanjem normalne strukture i funkcije epitelnih stanica.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.