Loading AI tools
שיגור תרופות הוא שיטה או תהליך טכנולוגי בו תרכובות תרופתיות מכוונות לפעול באתר מטרה מוגדר בגוף של בני-אדם או בבעלי חיים, כדי שהתרופה תפעל ככל הניתן על אתר המטרה, ולא תתבזבז או תגרום תופעות לוואי באתרים בגוף להם התרופה אינה מיועדת. לעיתים, שיגור תרופות משמש אף להפעלת התרופה ביעד בתנאים מוגדרים, כמו זמן מסוים או שילוב עם תרופות אחרות. פיתוח שיטה זו היא דוגמה לביו-קונברג'נס.
שיגור תרופות נעשה לעיתים בעזרת מערכות בקנה מידה ננומטרי, כגון: ליפוזומים, מיצלות, וירוזומים, ננו ספירות, ננו-קפסולות, דנדרימרים וננו-סיבים.
ישנן תרופות המיועדות לפעול על איבר מטרה מוגדר בגוף. מתן תרופות אלו דרך הפה או בהזרקה תוך ורידית, תפזר את התרופה לכל רקמות הגוף, כך שרק חלק קטן מהתרופה מגיע לאיבר המטרה. התרופה שמגיעה לאיברים אחרים מתבזבזת, במקרה הטוב, וגורמת לתופעות לוואי במקרה הגרוע.
השיטה של שיגור תרופה דואגת לכוון את התרופה אל אתר המטרה שלה. כאשר התרופה רגישה לפירוק במגע עם רקמות של הגוף בדרכו אל היעד, התרופה מלווה בנשא המונע את פעולתו עד השגת תנאים מסוימים של: חומציות, טמפרטורה, המצאות או העדר של חומרים כימיים או ביולוגיים מסוימים וכן המצאות או העדר של תנאים פיזיקליים שונים כגון: שדה מגנטי בעצמה מוגדרת, שדה חשמלי בגודל מוגדר, גלי קול בתדר מוגדר או גלים אלקטרומגנטיים (כגון גלי רדיו RF בתדר מסוים), דבר המאפשר שליטה בהפעלת התרופה מחוץ לגוף באמצעות השראת התנאים להפעלת התרופה. הנשא הפשוט ביותר הוא מעטפת העוטפת את התרופה ומונעת ממנו להגיע למגע עם רקמות הגוף. בהגיע התרופה אל אתר המטרה, המעטפת מפורקת ומאפשרת לתרופה לבוא במגע עם רקמות אתר המטרה ולפעול את פעולתה.
לשיגור תרופות מגוון יתרונות: השפעת התרופה יעילה וממושכת יותר כך שמתאפשרת הפחתה במינון נטילת התרופה על ידי המטופל ובנוסף ישנה הפחתה בתופעות הלוואי.
חיסרון השיטה הוא עלות ייצור גבוהה הגורמת לרווח כלכלי נמוך לחברות התרופות. בעקבות כך חברות התרופות מעדיפות שלא לייצר תרופה במגוון רחב של מינונים על מנת לחסוך בעלויות וכתוצאה מכך נפגעת אפשרות התאמת מינון התרופה לחולה.
ביישום השיטה יש לקחת בחשבון את הקריטריונים הבאים: מסלול העברת התרופה ליעדה, האתר שאליו מכוונת התרופה, התנאים באתר המטרה, מאפייני התרופה, תופעות הלוואי שלה והמחלה.
הובלת התרופה המשוגרת אל אתר המטרה נעשית בשיטות שונות המסווגות כאקטיביות או פסיביות.
הובלה פסיבית
בהובלה פסיבית, הגעת התרופה אל היעד מתבססת על תכונות של אתרי מטרה סרטניים שבאופן טבעי קולטים מקרו-מולקולות, על פי אפקט חדירות ואצירה מוגברת של גידולים סרטניים. בהתאם לכך, התרופה משוחררת עם הנשא לזרם הדם של המטופל ועם הזמן אחוז נכבד שלה מצטבר באתר היעד.
הובלה אקטיבית
בהובלה אקטיבית, נעשה שימוש בסמן המולבש על התרופה או הנשא ומובל לאתר המטרה.
אחת השיטות לשיגור התרופה אל המטרה היא שימוש בליגנדים, כגון נוגדנים, שיקשרו באופן ספציפי לרקמות של אתר המטרה.
נשא תרופות מיטבי הוא בעל המאפיינים הבאים: חסר רעילות, מתכלה או מתפנה מהגוף[1] ואינו גורם לתגובה חיסונית כנגדו[2].
קיימים מספר סוגים של נשאי תרופות:
ליפוזום
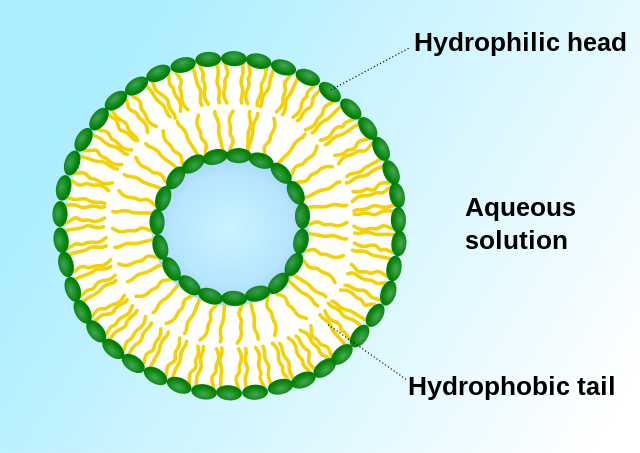
הליפוזום הוא הנשא הנפוץ ביותר לשיגור תרופות[3][4]. זהו נשא המיוצר בצורה מלאכותית ומורכב משכבה שומנית כפולה של פוספוליפידים הנסגרים מעגלית ויוצרים צורה כדורית. הליפוזום יכול לאחסן את התרופה במעטפת ההידרופוביות או באזור הפנימי ההידרופילי כתלות בתכונות התרופה המועברת[1]. בנוסף, על פני השטח של הליפוזום ניתן להצמיד ליגנדים כגון נוגדנים שיקשרו באופן ספציפי לרקמות הפגועות, אליהן מיועדת התרופה[5]. בדרך זו ניתן להעביר תרופות בזרם הדם ומתאפשר בידוד של התרופה מהרקמות הבריאות. כאשר הליפוזום יגיע לאתר המטרה הוא יתאחה עם הממברנה של התא ויעביר את תוכנו באופן ספציפי אל הציטופלזמה של תא המטרה.
מיצלות
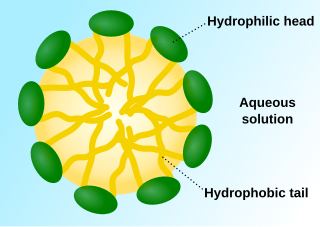
מיצלה היא צבר של מולקולות אמפיפטיות, הנוצר בתוך תערובת קולואיד. המיצלות מיוצרות על ידי הרכבה עצמית של פולימרים אמפיפיליים[6] המכילים תתי יחידות הידרופיליות והידרופוביות בסביבה מימית[7]. המיצלות משמשות להעברת תרופות בעלות מסיסות נמוכה בתמיסה המימית של הגוף על ידי לכידתן בליבה ההידרופוביות. יתר על כן, הראשים ההידרופיליים יכולים ליצור קשרי מימן עם הסביבה המיימית וליצור מעטפת צפופה מסביב לליבה של המיצלה. כתוצאה מכך התוכן של הליבה ההידרופובית מוגן מפני הידרוליזה ופירוק אנזימטי. בנוסף, ההרכב הכימי של המיצלות, המשקל מולקולרי הכללי, ויחסי האורך של הפולימרים, ניתנים לשינוי בקלות, דבר המאפשר בקרה על הגודל והמורפולוגיה של המיצלות[6].
וירוזומים
 ערך מורחב – וירוזום
ערך מורחב – וירוזום
וירוזום הוא מעטפת חלבונית ושומנית של נגיף החסרה את החומר התורשתי של הנגיף וקוטרה הוא כמה עשרות ננומטרים. הווירוזום מוכשר לחדור את ממברנת התא בהתאם ליכולתו של הנגיף ממנו נוצר[8]. תכונות אלו של הווירוזום מקנות לו יכולת לשמש כנשא תרופות בדומה לליפוזומים. ניתן ליצור במעבדה וירוזומים על ידי המסה והפרדת המעטפת משאר חלקי הנגיף הכוללים את החומר תורשתי וחלבונים נוספים. הפרדה זו נחוצה לצורך ביטול יכולת ההתרבות של הנגיף ומילוי הווירוזום בתוכן התרופתי הרצוי[9]. וירוזום המיוצר מנגיף השפעת הוא הנשא הנפוץ ביותר הודות לחלבונים נגיפיים ייחודיים הנמצאים על גבי המעטפת שלו, כגון החלבון המהגלוטינין(אנ') ונוירואמינידאז(אנ'). חלבונים אלו תורמים ליציבות ואחידות המעטפת של הנגיף והוירוזום. החלבון המהגלוטינין מסייע לנגיף בתהליך ההדבקה ובתהליך האיחוי (אנדוציטוזה), המנוצלים בווירוזום לצורך שיגור התרופה לתוך תא המטרה. כתוצאה מכך וירוזומים שנוצרו מנגיף האינפלואנזה בעלי יתרון משמעותי על פני וירוזומים ונשאים אחרים[10].
ננו-קפסולות
 ערך מורחב – ננו-קפסולה
ערך מורחב – ננו-קפסולה
ננו-קפסולה היא ננו-חלקיק בעל מעטפת חיצונית (העשויה בדרך כלל מחומר פולימרי) וחלל פנימי, כאשר החלל הפנימי עשוי להכיל תרופה. המטרות העיקריות של נשא זה הן ייעול אינטראקציות כימיות, מניעת תהליכי חמצון התרופה הלכודה ושחרור מבוקר שלה[4]. היום ניתן לייצר ננו-קפסולות במגוון ממדים, צורות ותפקידים שונים. ניתן לייצר קפסולות בעלות תכונות ביוכימיות, אלקטרומגנטיות ואופטיות רצויות המאפשרות שחרור מנות קצובות של התרופה. כמו כן, ניתן לייצר קפסולות המותאמות ליישומים מורכבים יותר, כגון שחרור תכולת הננו-קפסולות כתגובה לשינויים סביבתיים- כימיים או כתגובה לשינוי בריכוז מולקולה מסוימת. דוגמה לשינוי סביבתי היא שימוש במולקולה הרגישה לשינויים בחומציות או בפוטנציאל הנוצרים עקב ההיפוקסיה שמייצר הגידול הסרטני כדי לגרום לשחרור התרופה מהקפסולה.☃☃ ↵דרך נוספת לשחרור מבוקר הוא בעזרת קשירת רצפטורים ספציפיים כנגד תאים סרטניים או תאי מטרה אחרים על פני השטח של הננו-קפסולות. בנוסף לכך, שימוש בטכנולוגיה זו מאפשרת שיגור תרופות שאינן יציבות או אינן מסיסות במים ולכן העברתם לרקמות ואיברים רצויים בלתי אפשרית בשיטות מתן התרופות המסורתיות. תודות לתכונות הייחודיות של הננו-קפסולות השימוש בהן מאפשר ירידה משמעותית במינון התרופה והפחתה בתופעות הלוואי. ↵ננו ספירות - הן מקרה פרטי של ננוקפסולות. ננו-ספירה היא חלקיק ננומטרי כדורי וחלול. את הננו-ספירה ניתן לייצר ממגוון גדול של חומרים כגון: חלבונים, סוכרים, חומצות גרעין, מתכות, חומרים אורגניים ואי אורגניים ועוד. כתוצאה מכך לננו-ספירה מגוון רחב של יישומים ביניהם שיגור תרופות. יצירת החלקיקים הננו-ספירים מאפשרת להקטין את צפיפות החומר ולהגדיל את שטח הפנים שלו. המבנה הננו-ספירי מאפשר מספר דרכים לנשיאת התרופה; לעיתים החלקיק חלול ומעטפתו החיצונית היא התרופה או לחלופין ניתן לכלוא את התרופה בתוך החלקיק כאשר המעטפת מורכבת מחומר אחר. למעטפת חשיבות רבה כיוון שמעבר להיותה גוף החלקיק, ניתן להעניק לה תכונות שיקלו על שיגור התרופה והכוונתה ליעד המתאים. לדוגמה: ניתן לייצר את המעטפת מסוכר המהווה מזון לחיידקים אליהם מיועדת אנטיביוטיקה הכלואה בחלל החלקיק. כך החיידקים יתרכזו סביב החלקיק ויחשפו את התרופה תוך פירוק הסוכר[11] . יתרונות נוספים שניתן להעניק על ידי שליטה במבנה המעטפת הם: שליטה בקצב שחרור התרופה על ידי ייצור מעטפת עבה יותר, או הגנה על התרופה מפני מערכת החיסון על ידי כליאת התרופה בתוך מעטפת אינרטית.
דנדרימרים

הדנדרימרים מאופיינים במבנה תלת־ממדי מרושת, סימטרי וכדורי המקנה להם מגוון רחב של שימושים. דנדרימרים הם סוג חדש של פולימרים שנוצרו במקור מסינתזה פשוטה של חזרות רבות על מונומר (תת היחידה). בדנדרימרים תהליך הפילמור של תתי היחידות אינו קווי באוריינטציה של קשר ראש לזנב, אלא מעגלי במרחב בשל מספר הקבוצות פונקציונליות הקיימות על כל מונומר. לדנדרימרים תכונות ייחודיות כגון: הסתעפויות רבות, משקל מולקולרי מוגדר וחלל פנימי בין ענפי הדנדרימר, בדרך כלל בעל אופי הידרופובי. ניתן לשלוט על גודל הדנדרימר לפי מספר הפילמורים המעגליים. תכונות אלו הפכו את הדנדרימרים ליעד מושך עבור פיתוח יישומים ביולוגיים ולשיגור תרופות בפרט. ניתן להעניק לדנדרימרים תכונות רצויות על ידי חיבור קבוצות פונקציונליות על פני שטח המולקולה או בחללים שנוצרים בין הענפים. בדרך זו ניתן לתכנן את המולקולה בהתאם למטרה הטיפולית שלשמה נועדה: לכוונה ליעד הרצוי בגוף, לשלוט באופן שחרור התרופה ולדאוג לאחסון מתאים של התרופה בחלל המולקולה. לדוגמה: ניתן להפוך את הדנדרימרים למסיסים במים על ידי עטיפת המולקולה בקבוצות הידרופיליות. את התרופה ניתן לחבר לסביבה החיצונית של הדנדרימר עצמו, לקבוצות הפונקציונליות או לאחסנה בחלל הפנימי של הדנדרימר[12][13]. האפשרות האחרונה הציבה את הדנדרימרים בחזית המחקר למציאת נשא מתאים לתרופות אנטי סרטניות. אולם המחקר עדיין בראשית דרכו ויש לשכלל את השיטה על מנת למצוא פתרונות מתאימים.
ננו-סיבים
 ערך מורחב – ננו-סיב
ערך מורחב – ננו-סיב
ננו-סיבים הם סיבים חלולים בעלי קוטר קטן ממיקרומטר אחד. סיבים אלה מיוצרים באמצעות טוויה אלקטרונית. בטכנולוגיה זו מייצרים ננו-סיבים על ידי משיכה חשמלית ללא מגע מכני וממגוון חומרים שונים, כגון פולימרים[14]. יחס גבוה בין שטח פנים לנפח מקנה תכונות מיוחדות לננו-סיבים ומאפשר אינטראקציה מהירה של החומר עם הסביבה. לדוגמה, ננו-סיב אחד יכול לבוא במגע עם אלפי תאים. לננו-סיבים מגוון יישומים בתחומים רבים וביניהם יישומים בתחום הרפואה כולל שיגור תרופות[15]. השימוש בננו-סיבים כנשאי תרופות מתבצע במספר דרכים וביניהם קשירת התרופה לפולימר או הכנסת התרופה לחלל הפנימי של הסיב. שחרור התרופה מהננו-סיבים באתר המטרה מתאפשר במספר דרכים: הפרשה או דיפוזיה מתוך הסיב או פירוק עצמי של הסיב באתר המטרה.
פולימרים סינתטיים
קשירת פולימרים ביולוגיים (כגון פפטידים, פפטידים אמפיפיליים או חלבונים) לפולימרים סינתטיים מייצרת מבנים מורכבים בממדים ננומטריים המשמשים כמערכות לשיגור תרופות. במבנה זה הפולימר הביולוגי מהווה את התרופה, והפולימר הסינתטי מהווה את הנשא. הקישור בין הפולימרים נוצר באמצעות קשר קוולנטי או במקרים אחרים בשיטת הרכבה עצמית (self-assembly). המבנים, בהם התרופה קשורה לפולימר סינתטי מפחיתים את הרעילות של התרופה, מונעים תגובה חיסונית כנגדה ומגבירים את מסיסותה. באותה הדרך ניתן לקשור לפולימרים סינתטיים מקטעי דנ"א הנושאים עליהם גנים שונים וכך ליצור מערכות לשיגור גנים ללא שימוש בנשאים נגיפיים[16].
לשימוש במערכות של שיגור תרופות פוטנציאל רפואי גדול בעולם הננוטכנולוגיה כגון: טיפולים אנטי סרטניים, ריפוי גני, רדיותרפיה, חיסונים, ומעבר תרכובות טיפוליות במחסום דם-מוח. אולם האתגר הגדול שהמחקר יידרש להתמודד עמו הוא בתחום הננו טוקסיקולוגיה. הידע הנצבר בתחום זה יתרום למציאת פתרונות לרעילותם האפשרית ולפירוקם של הנשאים או פנוים מהגוף על מנת לצמצם את תופעות הלוואי[6].
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.