שאלות נפוצות
ציר זמן
צ'אט
פרספקטיבה
הנדסת רקמות
תחום מחקר בין-תחומי ברפואה, ביולוגיה והנדסה מוויקיפדיה, האנציקלופדיה החופשית
Remove ads
Remove ads
הנדסת רקמות מוגדרת כשילוב טכניקות בין תאים חיים, הנדסה וחומרים על מנת לשפר או להחליף פונקציות ביולוגיות. זהו תחום מחקר בין-תחומי המשלב רפואה, ביולוגיה והנדסה ביו-רפואית.
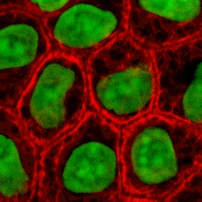
הנדסת רקמות מאפשרת יצירת רקמת תאים חיה מחוץ לגוף מתרביות תאים, שתאפשר כנראה בעתיד החלפת איברים חולים או פצועים באיברים בריאים ללא צורך בתרומת איברים.
בזמן שרוב ההגדרות של הנדסת רקמות מכסות שימושים רבים, בפועל השימוש במונח מתייחס לרוב ליישומים שמטרתם לתקן או להחליף חלקים או רקמות שלמות (לדוגמה, עצמות, סחוס, כלי דם, שלפוחית השתן, עור). לרוב, הרקמות דורשות מאפיינים מכניים ומבניים ספציפיים על מנת לתפקד כראוי.
המונח גם משמש למאמצים המושקעים ביצירה של פונקציות ביוכימיות באמצעות תאים הנמצאים בתוך סביבה מלאכותית (לדוגמה לבלב או כבד מלאכותיים). לפעמים משתמשים במונח "רפואה רגנרטיבית" להגדיר הנדסת רקמות, אף על פי שרפואה רגנרטיבית שמה יותר דגש על השימוש בתאי גזע ביצירת הרקמות.
Remove ads
רקע
ההגדרה הנפוצה עבור הנדסת רקמות כפי שנקבעה על ידי לאנגר[1] ווקנטי[2] היא "תחום בין-דיסיפלנרי אשר מיישם עקרונות מתחומי ההנדסה ומדעי החיים במטרה לפתח תחליפים ביולוגים על מנת לחדש, לתחזק או לשפר רקמות או איברים שלמים"[3]. הנדסת רקמות הוגדרה בנוסף כ-"הבנת העקרונות של גדילת רקמות ויישומם על מנת לייצר רקמה חילופית לצרכים קליניים".[4]
התקדמות משמעותית בתחום הנדסת הרקמות הניבה חלופות ואסטרטגיות השתלה חדשניות לרקמות פגועות. התקדמות מדעית בתחומי מחקר כגון הביו-חומרים, תאי גזע, פקטורי גדילה והתמיינות וביו-ריאקטורים יצרו הזדמנויות מיוחדות ליצירת רקמות במעבדה באמצעות שילוב של מטריקסים חוץ תאיים מהונדסים ("scaffolds"), תאים ומולקולות ביו-אקטיביות. אחד האתגרים הגדולים ביותר שהנדסת הרקמות עומדת בפניו הוא הצורך ביצירת רקמות עם פונקציונליות מורכבת יותר כמו גם שמירה על יציבות ביו-מכנית על מנת שיהיה ניתן להעביר את הרקמות הללו להשתלות קליניות. ההצלחה המתמשכת בהנדסת הרקמות במטרה ליצור תחלופה אמיתית לאיברים אנושיים מחייבת את המשך השיתוף בין תחומי ההנדסה השונים והמחקר הבסיסי בהבנת ברקמות, מטריקסים, פקטורי גדילה, תאי גזע וביולוגיה התפתחותית כמו גם מדע החומרים וביו-אינפורמטיקה.
Remove ads
שימוש בתאים כיחידות בניה
סכם
פרספקטיבה
הנדסת רקמות משתמשת בתאים חיים ליצור או ריפוי רקמות. דוגמאות לכך ניתן לראות שבשימוש בפיברובלסטים כתחליף או לתיקון עור ריפוי סחוס נעשה באמצעות כונדרוציטים (תאי רקמת בסחוס) ועוד. התאים הפכו לשימושיים כאשר מדענים מ-Geron Corp מצאו דרך להאריך טלומרים ב-1998 ועל ידי כך הפיקו קווי תאים שיכלו להתחלק מספר רב כמעט אינסופי של פעמים. לפני זה, תרביות רקמה של תאי יונקים (שאינם סרטניים), אשר נלקחו מחיות או אנשים, יכלו להתחלק רק מספר מוגבל של פעמים.
הפקת התאים
מרקמות גוף נוזליות לדוגמת דם, ניתן להפיק כמות מסיבית של תאים באמצעות צנטריפוגה או ב-Apheresis (מכשיר מיוחד המאפשר הוצאת רכיבים ספציפיים מדם החולה והחזרת הנוזלים והתאים שלא השתמשו בהם אל הגוף בחזרה). מרקמות מוצקות, הפקת התאים קשה יותר. בדרך כלל הרקמה נטחנת ואז מעוכלת באמצעות תוספת אנזימים כמו טריפסין או קולגנז על מנת להיפטר מהמטריקס החוץ תאי (ECM) אשר נשאר דבוק אל התאים. בסוף התהליך התאים צפים בצורה חופשית בתוך נוזלי הרקמה וניתן להפיק אותם באמצעות צנטריפוגה.
השימוש בטריפסין הוא מאוד תלוי טמפרטורה. טמפרטורות גבוהות יותר מעכלות את המטריקס מהר יותר אבל יוצרות יותר נזק לתאים. קולגנז הוא פחות תלוי טמפרטורה ופוגע בתאים פחות, אבל התהליך ממושך יותר והראגנט עצמו יותר יקר.
מקורות התאים
תאים לרוב מקוטלגים על פי המקור שלהם:
- אוטולוגים (Autologous) - מקור התאים הוא מאותו אינבדואל שעליו הם יושתלו בסוף בחזרה. לתאים אוטולגים יש את בעיות הדחייה והעברת פתוגנים הנמוכות ביותר. עם זאת, בכמה מקרים הדבר אינו אפשרי. לדוגמה, במקרה של מחלות גנטיות, תאים אוטולוגים לא יכולים להוות מקור אפשרי מכיוון שהם נושאים את אותו המטען הגנטי. בנוסף, במקרים של פציינטים חולים מאוד או מבוגרים יכול להיות שהפקה התאים לא תהיה אפשרית בגלל בעיית כמות או איכות. הפקת תאים מחייבת חדירה פולשנית אל תוך גוף הפציינט באמצעים כירוגים אשר עלולה להוביל לזיהום או לכאב כרוני. תאים אוטולוגים חייבם להיות בתרבית לפני שניתן יהיה להשתמש בהם, לרוב על מנת שיוכלו להתרבות. דבר זה עלול להוות בעיה מכיוון שהכנסת התאים לתרבית עלולה לקחת זמן.
- לאחרונה נעשו מחקרים אשר משתמשים בתאי גזע ממקור מזנכימלי - ממח עצם או שומן. התאים הללו יכול להתמיין למגוון סוגי רקמות אשר כוללים רקמת עצם, סחוס, שומן ועצב. ניתן לבודד מספר גדול של תאים משומן בקלות ומהירות יחסית, דבר המגדיל את פוטנציאל השימוש בהם.
- אלוגניים (Allogeneic) - מקור של תאים אלו הם מתורם שהוא מאותו המין של המושתל. בזמן שיש כמה הגבלות אתיות לגבי חקר תאים אנושיים in vitro, השימוש בפיברובלסטים דרמליים, שנלקחו מעורלה, הודגם כבטוח מבחינה אימונולוגית ולכן הוא מהווה מקור אפשרי להנדסת רקמות של העור
- קסנוגים (Xenogenic) - תאים אלו נלקחים מתורם שאינו מאותו מין של המושתל. במיוחד עשו שימוש אינטנסיבי בתאים מסוג זה בניסויים שמטרתם בנייה של שתלים קרדיווסקולרים.
- סינגניים (Syngenic) או איזו-גנטיים (Isogenic) - אלו תאים שמבודדים מתורם שזהה מבחינה גנטית אל הנתרם. לדוגמה, תאומים זהים, שיבוטים או קווי חיות מעבדה שנוצרו במיוחד לצורך זה (באמצעות זיווגי קרובים)
מספר הגדרות נוספות:
- תאים פרימרים (Primary) אלו תאים אשר באים מאורגניזם (אינם משומרים או מוקפאים בצורה כלשהי לפני השימוש).
- תאים שניוניים (Secondary) הם תאים שבאו מבנק תאים ( לרוב מוקפאים לפני השימוש).
- תאי גזע (Stem Cells) -תאים אלו הם תאים לא ממוינים בעלי יכול להתחלק בתרבית ולתת מגוון סוגי רקמות ותאים ספציפיים (תאי לב, עצם וכו'). תאי גזע יכולים להיות מחולקים על פי המקור שלהם: בוגרים ועובריים. תאי גזע בוגרים הם לרוב מולטיפוטנטים (multipotent) ועובריים הם פלוריפוטנטים (pluripotent). למרות שיש ויכוח אתי לגבי השימוש בתאי גזע עובריים, בעולם המדעי הפרדיגמה אומרת שניתן יהיה להשתמש בתאי גזע לתיקון רקמות פגועות או שיהיה ניתן להשתמש בהם ליצירת איברים חדשים.
Remove ads
פיגומים
התאים לרוב משותלים או "נזרעים" אל מבנה מלאכותי המסוגל לתמוך ביצירת רקמה תלת־ממדית. המבנים הללו, אשר לרוב מכונים פיגומים (Scaffolds) הם לרוב קריטיים מחוץ ובתוך החיה. הם מאפשרים לדמות את הסביבה בתוך הגוף החי (in vivo) ומאפשרים גם לתאים ליצור את המיקרו סביבה האידיאלית מבחינתם.
הפיגומים בדרך כלל משרתים לפחות אחת מהמטרות הללו:
- מאפשר לתאים להיצמד ו/או לבצע הגירה
- משמש ככלי להובלת התאים ופקטורים ביוכימיים ושמירתם.
- מאפשר דיפוזיה של נוטריינטים חיוניים לתאים וחומרים אותם התאים מייצרים.
- מפעיל השפעות מכניות וביולוגיות על מנת לשנות את התנהגות התאים.
על מנת להשיג את המטרה של בניית הרקמה, לפיגומים חייבים לענות על מספר דרישות. חירור גבוהה וגודל חורים מתאים הם הכרחיים על מנת להקל על זריעת התאים והתפשטותם במבנה, כמו גם על דיפוזיה של גזים ונוטריינטים. התכלות ביולוגית (biodegradability) היא פאקטור חיוני מכיוון שהפיגומים אמורים להתמוסס בסופו של דבר ולהיטמע ברקמות המקיפות אותם בלי הצורך בהסרתם באמצעות ניתוח. הקצב בו הפירוק מתרחש צריך להיות במידת האפשר מקביל לקצב יצירת הרקמה. בזמן שהתאים מייצרים את המטריקס החוץ תאי בעצמם, הפיגום אמור לאפשר שלמות מבנית בתוך הגוף ולבסוף להתפרק ולהשאיר את הרקמה המחודשת שתספק את הפונקציה הביולוגית והתמיכה המכנית. יצירת הפיגום מחומר נוזלי היא חיונית לשימושים קליניים. מחקר שהתפרסם לאחרונה על הדפסת איברים מראה כמה חיונית היא שליטה טובה על הסביבה התלת־ממדית על מנת להבטיח הדירות של הניסויים ולאפשר תוצאות טובות יותר.[5]
חומרים
סכם
פרספקטיבה
סוגי חומרים רבים נחקרו ביניהם טבעיים, סינתטיים, מתכלים וקבועים. רוב החומרים הללו היו מוכרים בשימוש קליני עוד הופעת תחום המחקר של הנדסת הרקמות. נעשה בהם שימוש לדוגמה בחוטים לתפרים מתכלים. דוגמאות לחומרים אלו הם קולגן וכמה סוגי פוליאסטרים.
חומרים ביולוגיים הונדסו על מנת לקבל מאפיינים פונקציונליים אידיאלים: יכולת הזרקה, יצור סינתטי, תאימות ביולוגית, אינרטיות חיסונית, שקיפות, סיבים ננומטרים, ריכוז נמוך קצב ספיגה ועוד.
חברת PuraMatrix לדוגמה שמקורה במעבדות MIT מייצרת עתה בצורה מסחרית סוגי פיגומים המותאמים קלינית להנדסת רקמות.
שימוש נפוץ בחומר סינתטי הוא (PLA(polylactic acid - חומצה פולילקטית. זהו חומר סינתטי אשר מתכלה בתוך גוף האדם ויוצר חומצה לקטית. כימיקל שמיוצר באופן טבעי בגוף ומוסלק ממנו בקלות.
חומרים דומים נוספים הם (polyglycolic acid (PGA חומצה פוליגליקולית ו- polycaprolactone
(PCL): איכות ההתכלות שלהם דומה לזה של ה-PLA אבל הם מאפשרים קצב התפרקות מהיר או איטי יותר בהתאם לצורך.
פיגומים הם יכולים להיבנות כאמור מחומרים טבעיים, ולמעשה נגזרות שונות של חומרים חוץ תאיים נחקרו על מנת להעריך את היכולת שלהם לתמוך בגדילת תאים. חומרים על בסיס חלבונים כמו קולוגן ופיברין ופוליסכרידים פוליסכרידים כמו גליקואמינוגליקנים ו-chitosan, כולם הראו תאימות במגע עם תאים, אולם יש עדיין מספר בעיות בנושאים כגון תגובתיות חיסונית שהם עלולים לעורר.
קבוצת פונקציונליות בפיגומים יכולים לשמש על מנת להעביר מולקולות קטנות כגון תרופות לרקמות ספציפיות.
עוד סוג של פיגום שנמצא במחקר מופק מרקמות של בעלי חיים אשר עוברות תהליך של ניקוי מתאים (decellularise) ומשאירות שלד של חומר חוץ תאי אשר יכול לשמש כפיגום לזריעת תאים.
Remove ads
לקריאה נוספת
- Yoshito Ikada, Tissue Engingeering: Fundamentals and Applications, acadamic press, 1997
קישורים חיצוניים
ארגונים
- המרכז להנדסת רקמות קלינית, המרכז לקידום הנדסת רקמות של מדינת אוהיו (המרכז הלאומי לרפואה רגנרטיבית)
- המרכז לקידום הנדסת רקמות של פיטסבורג
- החברה הבינלאומית להנדסת רקמות ורפואה רגנרטיבית
- החברה להנדסת תאים ורקמות
- הנדסת רקמות, באתר אנציקלופדיה בריטניקה (באנגלית)
 הנדסת רקמות, דף שער בספרייה הלאומית
הנדסת רקמות, דף שער בספרייה הלאומית
מאגרים ומשאבים
Remove ads
הערות שוליים
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
