From Wikipedia, the free encyclopedia
Un prión[1] é unha proteína infecciosa, autorreplicante, responsábel de diferentes enfermidades no gando e no home.[2]
| Prión | |
|---|---|
| Clasificación e recursos externos | |
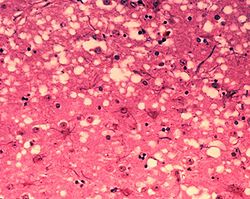 Os "buratos" microscópicos son característicos nas seccións de tecidos afectados por prións, que causan que o tecido desenvolva unha arquitectura "esponxosa". Isto causa a deterioración dese "esponxoso" tecido no cerebro. | |
| ICD-10 | A81 |
| ICD-9 | 046 |
| OMIM | 607948 |
| DiseasesDB | 8515 |
| MedlinePlus | 000077 000624 |
| eMedicine | med/2324 emerg/618 radio/411 |
| MeSH | D014376 |
Se cre que pode requirir tratamento, por favor, consúltello ao médico. | |
O termo prión vén da expresión inglesa pr-[oteinaceus] -i-[nfectious particle] -on (partícula infecciosa de natureza proteica), á que se engade o elemento -on, -ón, sufixo usado na linguaxe científica para formar nomes de partículas.[2][3]
As primeiras referencias ás enfermidades esponxiformes transmisíbeis remóntanse ao século XVIII, cando varios gandeiros europeos describiron unha enfermidade neurodexenerativa letal que afectaba ás ovellas e ás cabras, mal ao que se denominou tremesía. O cerebro destes animais presentaba un aspecto de esponxa, de onde provén o termo "esponxiforme". A principios do século XX describíronse os primeiros casos de encefalopatía esponxiforme no ser humano, e a doenza bautizouse co nome de enfermidade de Creutzfeldt-Jakob. Posteriormente demostrouse que estas enfermidades eran transmisíbeis. o axente patóxeno, o prión, foi descuberto en 1982 por Stanley B. Prusiner, que demostrou que se trataba de partículas puramente proteicas sen ácido nucleico. En 1997 foille outorgado o Premio Nobel de Fisioloxía ou Medicina.[4]
Prusiner someteu aos prións a distintos tratamentos para alterar as proteínas ou os ácidos nucleicos, intentando alterar a súa capacidade infecciosa. Observou que perdían infectividade cando se trataban con fenol (axente desnaturalizante das proteínas pero non dos ácidos nucleicos), aínda que eran resistentes a algúns dos procesos de degradación proteica (como os enzimas proteases). Porén, se os sometía á acción de enzimas que atacaban especificamente aos ácidos nucleicos (nucleases para ADN e ARN), a radiación UV ou á modificación con hidroxilamina, as partículas non perdían a súa infectividade. Estes estudos indicaron que os prións eran partículas patóxenas de natureza proteica e sen ácido nucleico. Prusiner conseguiu, máis adiante, infectar co prión da tremesía (PrPSc), que causa o prurito lumbar en ovellas, a ratos, conseguindo deste xeito un modo para reproducir, obter e estudar os prións posteriormente e máis a fondo.
Estas partículas están formadas en gran parte por glicoproteínas (proteínas asociadas a un glícido ou azucre) de masa molecular moi pequena, e non conteñen material xenético (ADN ou ARN) pero, pese a iso, son capaces de replicárense inducindo a transformación das proteínas normais do organismo infectado por elas en copias de si mesmas.
Son, pois, formas acelulares aínda máis pequenas e simples que os virus e que outras formas non celulares descubertas recentemente, como os viroides, que constitúen un grupo totalmente novo de axentes infecciosos, descoñecéndose aínda o mecanismo mediante o que conseguen que as proteínas do organismo hospedeiro se transformen en novos prións.
Os prións son os responsábeis de doenzas tales como a enfermidade de Creutzfeldt-Jakob, o mal das ovellas tolas ou a encefalopatía esponxiforme bovina (coñecida popularmente como o mal das vacas tolas), entre outras, todas elas caracterizadas por unha progresiva destrución neuronal e dexeneración progresiva do sistema nervioso central, proceso que frecuentemente remata coa vacuolización do córtex cerebral, que adopta o aspecto dunha masa esponxosa, e que conduce á alteracións nerviosas e, en pouco tempo, á morte.[5][6]
Non está totalmente demostrado que estas enfermidades sexan transmisíbeis ao home por comer tecido nervioso de animais enfermos.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.