Inteína
From Wikipedia, the free encyclopedia
Remove ads
Unha inteína é un segmento dunha proteína que se pode escindir por si mesma da cadea proteica e volve a unir as porcións restantes (as exteínas) por medio dun enlace peptídico. O concepto de inteína/exteína nas proteínas é en gran medida análogo ao concepto intrón/exón nos xenes, polo que as inteínas foron chamadas os "intróns das proteínas".[1]

O empalme ou splicing de proteínas mediado por inteínas ten lugar despois da tradución da proteína nos ribosomas a partir do seu ARNm, polo que é un fenómeno postraducional. Esta proteína precursora inicial saída do ribosoma contén tres segmentos: unha N-exteína seguida da inteína e despois unha C-exteína (N e C fan referencia á proximidade da exteína aos extremos N e C-terminais da proteína). Despois de que ten lugar o splicing, o resultado tamén se chama exteína (proteína definitiva sen a inteína).
As inteínas conteñen xeralmente dous dominios, un para o autosplicing, e outro que é un dominio endonuclease para a propagación. Os elementos para o autosplicing están nas porcións N- e C-exteínas, e a endonuclease está na inteína e intervén na propagación da inteína no xenoma. O dominio endonuclease non sempre está presente.[2]
Remove ads
Historia
A primeira inteína descubriuse en 1988 por medio da comparación de secuencias xénicas entre a ATPase vacuolar de Neurospora crassa[3] e de cenoria [4] (sen inteína) e o xene homólogo do lévedo Saccharomyces cerevisiae (con inteína) que foi primeiro descrito como un posible transportador de ións calcio.[5] En 1990 Hirata et al.[6] demostraron que a secuencia extra do xene do lévedo fora transcrito ao ARNm e só era eliminado na proteína despois da súa tradución. Desde entón, as inteías atopáronse nos tres dominios de seres vivos (eucariotas, bacterias e arqueas) e tamén en virus.
Moitas das inteínas atopadas tamén conteñen un dominio endonuclease que exerce unha función na propagación da inteína [2]. De feito, moitos xenes teñen segmentos codificantes de inteínas non relacionados inseridos en diferentes posicións. Por estas e outras razóns, as inteínas (ou máis apropiadamente, os segmentos xénicos que codifican as inteínas) son ás veces chamados elementos xenéticos egoístas ou elementos xenéticos parasitos [7].
Nas bases de datos que conteñen todas as inteínas coñecidas (Inbase), hai 113 delas que están presentes nos eucariotas e teñen lonxitudes mínimas de 138 aminoácidos e máximas de 844. A primeira inteína atopada estaba codificada no xene VMA de Saccharomyces cerevisiae. Despois encontráronse noutros fungos (ascomicetos, basidiomicetos, cigomicetos e quitridios) e en diversas proteínas. Unha proteína remotamente emparentada coas proteínas que conteñen inteínas coñecidas, pero estreitamente emparentada coas proteínas hedgehog dos metazoos, tiña a secuencia de inteína de Glomeromycota. Moitas das inteínas recentemente descritas conteñen endonucleases e algunhas delas aparentemente son activas [8]. A abundancia de inteínas nos fungos indica que se produciu unha transferencia lateral de xenes que conteñen inteínas. Nas bacterias e arqueas, coñécense, respectivamente, 289 e 182 inteínas ata agora (ano 2002). Non é sorprendente que a maioría das inteínas de bacterias e arqueas estean inseridas en proteínas metabólicas dos ácidos nucleicos, igual que nos fungos.[8].
Remove ads
Mecanismo
O mecanismo para realizar o splicing é un proceso natural análogo da técnica que produce proteínas de tamaño medio chamada ligazón química nativa, que foi desenvolvida ao mesmo tempo que se descubrían as inteínas.[9][10]
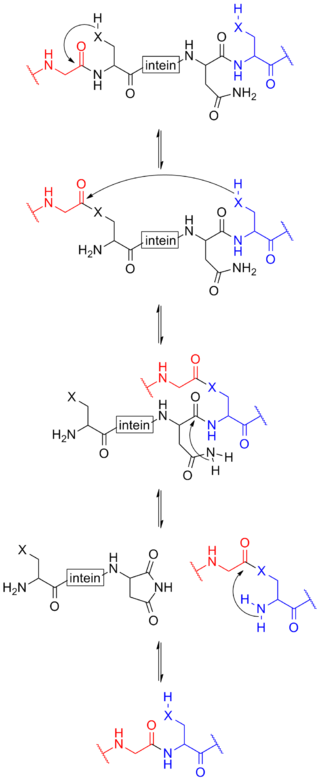
O proceso comeza cun cambio de posición N-O ou N-S cando a cadea lateral do primeiro residuo (unha serina, treonina, ou cisteína) da porción da inteína da proteína precursora fai un ataque nucleofílico ao enlace peptídico do residuo inmediatamente anterior (que é o residuo final da N-exteína) para formar un intermediato éster (ou tioéster) lineal. Ocorre unha transesterificación cando a cadea lateral do primeiro residuo da C-exteína ataca o (tio)éster acabado de formar para liberar o extremo N-terminal da inteína. Isto orixina un intermediario ramificado no cal están unidas a N-exteína e a C-exteína, aínda que non por enlace peptídico. O último residuo da inteína é sempre unha asparaxina, e o átomo de nitróxeno da amida desta cadea lateral corta o enlace peptídico entre a inteína e a C-exteína, orixinando un segmento de inteína totalmente libre cunha imida cíclica terminal. Finalmente, o grupo amino libre da C-exteína ataca agora o (tio)éster que une as N- e C-exteínas. Un cambio de posición O-N ou S-N produce un enlace peptídico e a proteína ligada funcional.[11]
Remove ads
Inteínas en biotecnoloxía
As inteínas son moi eficientes no splicing de proteínas, e teñen importantes aplicacións en biotecnoloxía. Identificáronse máis de 200 inteínas; con tamaños que van de 100 a 800 aminoácidos. Utilizáronse técnicas de enxeñaría xenética coas inteínas para darlle aplicacións especiais como a semisíntese de proteínas [12] e a marcaxe selectiva de elementos proteicos, que é útil para estudos de resonancia magnética nuclear de proteínas grandes.[13]
A inhibición farmacéutica da escisión das inteínas pode ser unha ferramenta útil para o desenvolvemento de fármacos; a proteína que contén a inteína non poderá levar a cabo a súa función normal se a inteína non se escinde, xa que a súa estrutura quedará distorsionada.
Suxeriuse que as inteínas poderían ser útiles para conseguir a expresión alotópica de certas proteínas moi hidrófobas codificadas normalmente polo xenoma mitocondrial, por exemplo na terapia xénica [14]. O carácter hidrofóbico destas proteínas é un obstáculo para a súa importación ás mitocondrias. Xa que logo, a inserción dunha inteína non hidrofóbica pode permitir que teña lugar esta importación. A escisión das inteínas despois da súa importación restauraría despois a forma normal da proteína.
O uso de etiquetas de afinidade para purificar proteínas recombinantes foi moi utilizado, xa que permite a acumulación de proteínas recombinantes con poucas impurezas, pero a etiqueta de afinidade debe ser eliminada por proteases no paso final. O paso extra da proteólise crea o problema da especificidade da protease para eliminar a etiqueta de afinidade da proteína recombinante. Tamén debe eliminarse o seu produto de dixestión. Este problema pode ser evitado fusionando a etiqueta de afinidade a unha inteína que se pode autoescindir nun medio controlado. A primeira xeración de vectores de expresión deste tipo usaba unha inteína de VMA (Sce VMA) de Saccharomyces cerevisiae modificada. Chong et al. (1997) utilizaron o dominio de unión á quitina de Bacillus circulans como etiqueta de afinidade e fusionaron esa etiqueta na inteína Sce VMA modificada. A inteína modificada experimenta unha reacción de autoclivaxe no seu enlace peptídico N-terminal por 1,4-ditiotreitol (DTT), β-mercaptoetanol (β-ME) ou cistina a baixa temperatura e nun amplo rango de pH. Despois da expresión da proteína recombinante, o homoxenado celular pásase por unha columna que contén quitina. Isto permite que o dominio de unión á quitina da proteína quimérica se una á columna. Ademais, cando se baixa a temperatura e as moléculas descritas antes pasan pola columna, a proteína quimérica sofre autosplicing e só se elúe a proteína diana. Esta nova técnica elimina o paso da proteólise e a Sce VMA modificada queda na columna unida á quitina polo dominio de unión á quitina [15].
Recentemente, as inteínas empezaron a utilizarse para purificar proteínas baseándose en péptidos autoagregados. Os polipéptidos similares á elastina (ELPs) son unha útil ferramenta biotecnolóxica. Fusionados con proteínas diana, tenden a formar agregados dentro das células [16]. Isto elimina o paso cromatográfico necesario para a purificación das proteínas. Os polipéptidos similares á elastina utilizáronse na proteína de fusión da inteína, para que os agregados puidesen ser illados sen cromatografía (por centrifugación) e despois a inteína e a etiqueta puidesen ser clivadas dunha maneira controlada para liberar a proteína diana na solución. Este illamento de proteínas pode facerse usando un fluxo continuou, que rende gran cantidade de proteína, facendo que o proceso sexa máis eficiente economicamente cós métodos convencionais [16]. Outros grupos de investigadores utilizaron etiquetas autoagregantes máis pequenas para illar a proteína diana. Utilizáronse os pequenos péptidos anfipáticos 18A e ELK16 para formar proteína agregante autoclivante [17].
Remove ads
Nomenclatura das inteínas
A primeira parte do nome dunha inteína está baseada nunha abreviación da nomenclatura binomial do nome científico da especie na que foi atopada, e o segundo está baseado no nome do xene correspondente da exteína. Por exemplo, a inteína encontrada en Thermoplasma acidophilum e asociada coa subunidade A da ATPase vacuolar (VMA) denomínase "Tac VMA".
Normalmente, como neste exemplo, só se usan tres letras para especificar o organismo, pero isto pode variar. Poden engadirse máis letras para indicar a cepa. Se está codificada máis dunha inteína no xene correspondente, dáselle a cada unha un sufixo numérico empezando polo extremo 5' do xene e acabando no 3' ou, outras veces, segundo a orde en que foron identificadas (por exemplo, "Msm dnaB-1").
Ao segmento do xene que codifica a inteína dáselle xeralmente o mesmo nome ca á inteína, pero para evitar confusión o nome da inteína normalmente vai en maiúscula (por exemplo, Pfu RIR1-1), entanto que o nome do segmento xénico correspondente vai en cursiva (por exemplo, Pfu rir1-1).[2]
Miniinteínas e inteínas grandes
As inteínas grandes son as que constan dun dominio de splicing (situado na N- e C-exteínas) e un dominio endonuclease. As miniinteínas carecen do dominio endonuclease.
Moitas inteínas conteñen un dominio de xene de endonuclease (homing endonuclease gene, HEG) ademais dos dominios de splicing. Este dominio é responsable da propagación da inteína ao cortar o ADN dun alelo sen inteína no cromosoma homólogo, o que desencadea a actuación do sistema de reparación do ADN de roturas de dobre febra, que reparará a rotura, e así copia o ADN codificante da inteína no alelo que antes non a tiña. Porén, o dominio HEG non é necesario para o splicing da inteína, e pode perderse, formando unha miniinteína ou inteína mínima. Varios estudos demostraron a natureza modular das inteínas ao engadir e eliminar os dominios HEG e determinar a actividade dos novos que se forman.[2]
Inteínas divididas
Ás veces, as inteínas da proteína precursora proceden de dous xenes. Neste caso, a inteína dise que é unha inteína dividida ou separada (split intein). Por exemplo, en cianobacterias, a subunidade catalítica α DnaE da ADN polimerase III, está codificada por dous xenes separados, dnaE-n e dnaE-c. O produto xénico dnaE-n consiste nunha secuencia N-exteína seguida dunha secuencia de inteína de 123 aminoácidos, e, por outra parte, o produto xénico dnaE-c consiste nunha secuencia de inteína de 36 aminoácidos seguida da secuencia da C-exteína.[2]
Remove ads
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads