Experimento de Rutherford
From Wikipedia, the free encyclopedia
O experimento de Rutherford, tamén chamado experimento da lámina de ouro, foi realizado por Hans Geiger e Ernest Marsden en 1909, e publicado en 1911,[1] baixo a dirección de Ernest Rutherford nos Laboratorios de Física da Universidade de Manchester. Os resultados obtidos e o posterior análise tiveron como consecuencia a negación do modelo atómico de Thomson (modelo atómico do pudding con pasas) e a proposta dun modelo nuclear para o átomo.

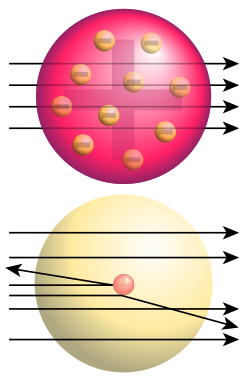
Abaixo: Resultados observados: Unha pequena parte das partículas eran desviadas, demostrando a existencia dun minúsculo volume de carga positiva
Descrición
O experimento consistiu en mandar un raio de partículas alfa sobre unha fina lámina de ouro e observar cómo dita lámina afectaba á traxectoria de ditos raios.
As partículas alfa se obtiñan da desintegración dunha substancia radioactiva, o polonio. Para obter un fino raio colocou o polonio nunha caixa de chumbo, o chumbo detén todas as partículas, menos as que saen por un pequeno burato practicado na caixa. Perpendicular á traxectoria do raio no que interpoñíase a lámina de ouro. E, para a detección da traxectoria das partículas, empregouse unha pantalla con sulfuro de zinc que produce pequenos destelos cada vez que unha partícula alfa choca con el.
Segundo o modelo de Thomson, as partículas alfa atravesarían a lámina metálica sen desviarse demasiado da súa traxectoria:
- A carga positiva e os electróns do átomo encontrábanse dispersos de forma homoxénea en todo o volume do átomo. Como as partículas alfa posúen unha gran masa (8.000 veces maior que a do electrón) e gran velocidade (uns 20.000 km/s), a forzas eléctricas serían moi débiles e insuficientes para conseguir desviar as partículas alfa.
- Ademais, para atravesar a lámina de metal, estas partículas encontraríanse con moitos átomos, que irían compensando as desviacións cara ás diferentes direccións.
Pero observouse que un pequeno porcentaxe de partículas desviabanse cara a fonte de polonio, aproximadamente unha de cada 8.000 partículas ao utilizar unha finísima lámina de ouro cuns 200 átomos de espesor. En palabras de Rutherford ese resultado era "tan sorprendente como se lle disparases balas de canón a unha folla de papel e rebotasen cara ti".
Rutherford conclueu que o feito de que a maioría das partículas atravesaran a folla metálica, indica que gran parte do átomo está baleiro, que a desviación das partículas alfa indica que o deflector e as partículas posúen carga positiva, pois a desviación sempre é dispersa. E o rebote das partículas alfa indica un encontro directo cunha zona fortemente positiva do átomo e á vez moi densa.
O modelo atómico de Rutherford mantiña o planteamento de Thomson, de que os átomos posúen electróns, mais a súa explicación sostiña que todo átomo estaba formado por un núcleo e unha codia. O núcleo debía ter carga positiva, un radio moi pequeno e nel concentrábase case toda a masa do átomo. A codia estaría formada por unha nube de electróns que orbitan arredor do núcleo.
Segundo Rutherford, as órbitas dos electróns non estaban moi ben definidas e formaban unha estrutura complexa arredor do núcleo, dándolle un tamaño e forma indefinida. Tamén calculou que o radio átomico, segundo os resultados do experimento, era dez mil veces maior que o radio do núcleo mesmo, o que implicaba un grande espazo baleiro no átomo.
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
