From Wikipedia, the free encyclopedia
As beta-lactamases (β-lactamases), tamén chamadas gran parte delas penicilinases, son encimas (EC 3.5.2.6) producidos por algunhas bacterias, que proporcionan resistencia a diversos antibióticos do tipo dos antibióticos β-lactámicos, como as penicilinas, cefalosporinas, cefamicinas e carbapenems (ertapenem), aínda que os carbapenems son relativamente resistentes á beta-lactamase. A beta-lactamase proporciona resistencia a antibióticos ao romper a estrutura da molécula do antibiótico. Estes antibióticos teñen todos un elemento común na súa estrutura molecular: un anel de catro átomos chamado β-lactama ou anel β-lactámico. Por medio de hidrólise, o encima lactamase rompe e abre o anel β-lactámico, desactivando as propiedades antibacterianas da molécula.
| Beta-lactamase | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 Estrutura dunha beta-lactamase de Streptomyces albus | |||||||||||
| Identificadores | |||||||||||
| Símbolo | Dominio de β-lactamase | ||||||||||
| Pfam | PF00144 | ||||||||||
| Pfam clan | CL0013 | ||||||||||
| InterPro | IPR001466 | ||||||||||
| PROSITE | PS00146 | ||||||||||
| SCOPe | 56601 / SUPFAM | ||||||||||
| |||||||||||
| β-lactamase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
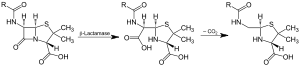 | |||||||||
| Acción da β-lactamase e descarboxilación do intermediario | |||||||||
| Identificadores | |||||||||
| Número EC | 3.5.2.6 | ||||||||
| Número CAS | 9073-60-3 | ||||||||
| Bases de datos | |||||||||
| IntEnz | vista de IntEnz | ||||||||
| BRENDA | entrada de BRENDA | ||||||||
| ExPASy | vista de NiceZyme | ||||||||
| KEGG | entrada de KEGG | ||||||||
| MetaCyc | vía metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| Gene Ontology | AmiGO / EGO | ||||||||
| |||||||||


Os antibióticos beta-lactámicos utilízanse xeralmente para tratar un amplo espectro de bacterias grampositivas e gramnegativas.
As beta-lactamases producidas por organismos gramnegativos normalmente segréganse ao exterior, especialmente cando os antibióticos están presentes no ambiente.[1]
A estrutura da β-lactamase de Streptomyces é a dada en 1BSG.
A penicilinase é un tipo específico de β-lactamase, que mostra especificidade pola penicilinas e tamén hidroliza o anel de β-lactama. Os pesos moleculares de varias penicilinases adoitan estar preto dos 50 kDa.
A penicilinase foi a primeira β-lactamase que se identificou: Foi illada por Abraham e Chain en 1940 da bacteria gramnegativa Escherichia coli incluso antes de que se empezase a usar clinicamente a penicilina,[2] pero a produción de penicilinase espallouse rapidamente polas bacterias que previamente non a producían en absoluto ou que só raramente a producían. Desenvolvéronse beta-lactámicos resistentes á penicilinase como a meticilina, pero agora estase espallando a resistencia incluso a estes.
Entre as bacterias gramnegativas a aparición de resistencias a cefalosporinas de espectro expandido é o máis preocupante. Apareceu inicialmente nun número limitado de especies bacterianas (Enterobacter cloacae, Citrobacter freundii, Serratia marcescens e Pseudomonas aeruginosa) que podían mutar e hiperproducir a súa β-lactamase de clase C cromosómica. Uns poucos anos despois, apareceron resistencias en especies bacterianas que non producían naturalmente encimas AmpC (Klebsiella pneumoniae, Salmonella spp., Proteus mirabilis) debido á produción de ESBL de tipo TEM ou SHV. Caracteristicamente, esa resistencia afecta a compostos oxiimino (por exemplo ceftizoxima, cefotaxima, ceftriaxona e ceftazidima, e tamén o oxiimino-monobactam aztreonam), pero non a 7-alfa-metoxi-cefalosporinas (cefamicinas; noutras palabras, cefoxitina e cefotetan); foi bloqueado por inhibidores como o clavulanato, sulbactam ou tazobactam, e non implica os carbapenems e temocilina. As β-lactamases AmpC mediadas polo cromosoma representan unha nova ameaza, xa que confiren resistencia a 7-alfa-metoxi-cefalosporinas (cefamicinas) como cefoxitina ou cefotetan, non son afectados por inhibidores da β-lactamase comercialmente dispoñibles, e poden, en cepas con perda de porinas da membrana externa, proporcionar resistencia a carbapenems.[3]
Os membros da familia expresan comunmente β-lactamases codificadas en plásmidos (por exemplo, TEM-1, TEM-2 e SHV-1), que confiren resistencia ás penicilinas pero non a cefalosporinas de espectro estendido. A mediados da década de 1980 (o primeiro xa en 1979), detectouse un novo grupo de encimas, as β-lactamases de espectro estendido (ESBL, do inglés Extended-spectrum β-lactamases).[4] A prevalencia de bacterias produtoras de ESBL foron incrementándose gradualmente en hospitais de coidados intensivos.[5] As ESBL son beta-lactamases que hidrolizan cefalosporinas de espectro estendido cunha cadea lateral oxiimino. Estas cefalosporinas inclúen cefotaxime, ceftriaxona e ceftazidime, así como o oxiimino-monobactam aztreonam. Así as ESBL confiren multirresistencia a estes antibióticos e as oxiimino-beta lactamas relacionadas. En circunstancias típicas, derivan dos xenes do TEM-1, TEM-2 ou SHV-1 por mutacións que alteran a configuración de aminoácidos arredor do sitio activo destas β-lactamases. Un máis amplo conxunto de antibióticos β-lactámicos son susceptibles á hidrólise por estes encimas. Recentemente describíronse un crecente número de ESBL non da liñaxe TEM ou SHV.[6] Os ESBL están codificados frecuentemente en plásmidos. Os plásmidos responsables da produción da ESBL frecuentemente portan xenes que codifican a resistencia a outras clases de fármacos (por exemplo, aminoglicósidos). Por tanto, as opcións antibióticas no tratamento de organismos produtores de ESBL son extremadamente limitadas. Os carbapenems son o tratamento de elección de graves infeccións debido a organismos produtores de ESBL, aínda que se informou recentemente de illamentos resistentes ao carbapenem (principalmente resistentes ao ertapenem).
A beta-lactamase máis recente en bacterias gramnegativas é a TEM-1. Ata o 90% da resistencia á ampicilina en Escherichia coli débese á produción de TEM-1.[7] Tamén é responsable da resistencia á ampicilina e penicilina crecentemente observada en Haemophilus influenzae e Neisseria gonorrhoeae. Aínda que as beta-lactamases de tipo TEM se encontran principalmente en E. coli e Klebsiella pneumoniae, tamén se encontran noutras especies de bacterias gramnegtivas cada vez máis frecuentemene. As substitucións de aminoácidos responsables do fenotipo de beta-lactamase de espectro estendido (ESBL) agrúpanse arredor do sitio activo do encima e cambian a súa configuración, o que permite que accedan a substratos oxiimino-beta-lactámicos. A apertura do sitio activo a substratos beta-lactámicos tamén potencia normalmente a susceptibilidade do encima a inhibidores da β-lactamase, como o ácido clavulánico. As substitucións dun só aminoácido nas posicións 104, 164, 238 e 240 producen o fenotipo ESBL, pero as ESBL co espectro máis amplo xeralmente teñen máis dunha substitución de aminoácidos. Baseándose nas diferentes combinacións de cambios, actualmente lévanse descrito 140 encimas de tipo TEM. Nun estudo feito nos Estados Unidos, os TEM-10, TEM-12 e TEM-26 estaban entre os máis comúns.[8][9][10]
As SHV-1 comparten un 68% da súa secuencia de aminoácidos coas TEM-1 e ten unha estrutura globalmente similar. A beta-lactamase SHV-1 encóntrase principalmente en K. pneumoniae e é responsable dun 20% da resistencia á meticilina mediada por plásmidos nesta especie. As ESBL desta familia tamén presentan cambios de aminoácidos no seu sitio activo, xeralmente nas posicións 238 ou 238 e 240. Coñécense máis de 60 variedades de SHV. O SHV-5 e o SHV-12 están entre os máis comúns.[8]
Estes encimas foron nomeados pola súa maior actividade contra o cefotaxime que outros substratos oxiimino-beta-lactámicos (por exemplo, ceftazidime, ceftriaxone ou cefepime). En lugar de orixinarse por mutación, representan exemplos de adquisición de plásmidos con xenes de beta-lactamase atopados normalmente no cromosoma de especies de Kluyvera, un grupo raramente patóxeno de organismos comensais. Estes encimas non están moi estreitamente relacionados coas beta-lactamases TEM ou SHV porque mostran só un 40% de identidade con estes dous tipos comúns de beta-lactamases. Coñécense actualmente máis de 80 encimas CTX-M. Malia o seu nome, uns cantos deles son máis activos sobre a ceftazidime que a cefotaxime. Encóntranse principalmente en cepas de Salmonella enterica serovar Typhimurium e E. coli, pero tamén foron descritas noutras especies de Enterobacteriaceae e son o tipo de ESBL predominante nalgunhas partes de Suramérica (tamén se detectaron no leste de Europa). As CTX-M-14, CTX-M-3 e CTX-M-2 son as máis espalladas. A CTX-M-15 era en 2006 o tipo máis espallado en E. coli no Reino Unido.[11] Un exemplo de beta-lactamase CTX-M-15, xunto con ISEcp1, viuse que recentemente se traspuxo no cromosoma de Klebsiella pneumoniae ATCC BAA-2146.[12]
As beta-lactamases OXA foron desde hai tempo recoñecidas como a variedade menos común pero tamén mediada por plásmidos que podía hidrolizar oxacilina e penicilinas relacionadas antiestafilocócicas. Estas beta-lactamases difiren dos encimas TEM e SHV en que pertencen á clase molecular D e ao grupo funcional 2d. As beta-lactamses de tipo OXA dan resistencia á ampicilina e cefalotina e están caracterizadas pola súa alta actividade hidrolítica contra a oxacilina e a cloxacilina e por seren pouco inhibidas polo ácido clavulánico. As substitucións de aminoácidos en encimas OXA poden tamén dar un fenotipo ESBL. Mentres que a maioría dos ESBL se atoparon en E. coli, K. pneumoniae e outras enterobacteriáceas, os ESBL de tipo OXA atopáronse principalmente en P. aeruginosa. Os ESBL de tipo OXA encontráronse principalmente en illamentos de Pseudomonas aeruginosa de Turquía e Francia. A familia de beta-lactamase OXA creouse orixinalmente como grupo máis fenotípico que xenotípico para unhas poucas beta-lactamases que tiñan un perfil de hidrólise específico. En consecuencia, hai só un 20% de homoloxía de secuencia entre algúns dos membros desta familia. Porén, algunhas adicións recentes a esta familia mostran certo grao de homoloxía cun membro ou máis dos existentes da familia das beta-lactamases OXA. Algunhas confiren resistencia predominantemente ao ceftazidime, pero a OXA-17 confire maior resistencia ao cefotaxime e cefepime do que resiste ao ceftazidime.
Describíronse outros ESBL mediados por plásmidos, como as beta-lactamases PER, VEB, GES, e IBC, pero non son comúns e atopáronse principalmente en P. aeruginosa e nun número limitado de localizacións xeográficas. As PER-1 en illamentos de Turquía, Francia e Italia; as VEB-1 e VEB-2 en cepas do sueste asiático; e as GES-1, GES-2 e IBC-2 en illamentos de Suráfrica, Francia e Grecia. A PER-1 é tamén común en especies multirresistentes de Acinetobacter en Corea e Turquía. Algúns destes encimas atópanse igualmente en Enterobacteriaceae, mentres que outros ESBL pouco comúns (como BES-1, IBC-1, SFO-1 e TLA-1) atopáronse só en Enterobacteriaceae.
Aínda que os organismos produtores de ESBL foron previamente asociados con hospitais e a asistencia institucional, estes organismos atópanse agora cada vez máis na poboación xeral. Os E. coli CTX-M-15-positivos son unha causa de infeccións urinarias adquiridas na comunidade no Reino Unido,[11] e tenden a ser resistentes a todos os antibióticos β-lactámicos orais, e tamén quinolonas e sulfonamidas. Entre as opcións de tratamento están a nitrofurantoína, fosfomicina, mecilinam e cloranfenicol. En casos desesperados, pode utilizarse unha inxección ao día de ertapenem ou xentamicina.
Aínda que as β-lactamases resistentes a inhibidor non son ESBL, a miúdo trátanse xunto coas ESBL porque tamén derivan de encimas de tipo TEM e SHV clásicos. A estes encimas déuselles inicialmente a designación de β-lactamases IRT (de inhibitor-resistant TEM, TEM resistentes a inhibidor); porén, todos foron despois renomeados con designacións TEM numéricas. Hai polo menos 19 β-lactamases TEM resistentes a inhibidor. Encóntranse principalmente en illamentos clínicos de Escherichia coli, pero tamén en cepas de Klebsiella pneumoniae, Klebsiella oxytoca, Proteus mirabilis e Citrobacter freundii. Aínda que as variantes de TEM resistentes a inhibidor son resistentes á inhibición por ácido clavulánico e sulbactam, mostrando, por tanto, resistencia clínica á combinación de beta-lactama—inhibidor de beta-lactamase de amoxicilina-clavulanato (co-amoxiclav), ticarcilina-clavulanato (co-ticarclav), e ampicilina/sulbactam. Actualmente xa non forma parte da epidemioloxía europea primaria, senón que se encontra nas partes norte de América.[9]
As β-lactamases tipo AmpC íllanse comumente de bacterias gramnegativas resistentes á cefalosporina de espectro estendido. As β-lactamases AmpC (tamén denominadas clase C ou grupo 1) están codificadas tipicamente no cromosoma de moitas bacterias gramnegativas como especies de Citrobacter, Serratia e Enterobacter nas que a súa expresión é xeralmente inducible; pode tamén aparecer en Escherichia coli pero non é xeralmente inducible, aínda que pode ser hiperexpresada. As β-lactamases tipo AmpC poden tamén estar codificadas en plásmidos.[3] As β-lactamases AmpC, a diferenza das ESBL, hidrolizan cefalosporinas de espectro amplo e estendido (cefamicinas e tamén oxiimino-β-lactamas) pero non son inhibidas por inhibidores de β-lactamase como o ácido clavulánico.
Os carbapenems son coñecidos pola súa estabilidade ante as β-lactamases AmpC e β-lactamases de espectro estendido. As carbapenemases son un diversos grupo de β-lactamases que son activas non só contra as oxiimino-cefalosporinas e cefamicinas, senón tamén contra os carbapenems. O aztreonam é estable ás metalo-β-lactamases, pero moitos microorganismos produtores de IMP e VIM son resistentes, o que se debe a outros mecanismos. As carbapenemases críase anteriormente que derivaban só das clases A, B e D, pero posteriormente describiuse tamén unha clase C de carbapenemases.
As carbapenemases de tipo IMP mediadas por plásmidos, das cales se coñecen 17 variedades, foron descubertas no Xapón na década de 1990 tanto en organismos gramnegativos entéricos coma en especies de Pseudomonas e Acinetobacter. Os encimas espalláronse lentamente a outros países de Asia oriental, e detectáronse en Europa en 1997, e foron atopados tamén no Canadá e o Brasil.
Unha segunda familia en crecemento de carbapenemases é a familia VIM (Verona integron-encoded metallo-β-lactamase, (metalo-β-lactamase codificada en integrón Verona), que se encontrou en Italia en 1999 e agora comprende xa 10 membros, que teñen unha ampla distribución xeográfica en Europa, Suramérica e Asia Oriental e tamén se detectaron nos Estados Unidos. A VIM-1 descubriuse en P. aeruginosa en Italia en 1996; desde entón, a VIM-2 atopouse repetidamente en Europa e Asia Oriental, que agora é a variante predominante; as VIM-3 e -4 son variantes menores das VIM-2 e -1, respectivamente. Os encimas VIM aparecen principalmente en P. aeruginosa, tamén en Pseudomonas putida e, moi raramente, en Enterobacteriaceae.
A diversidade de secuencias de aminoácidos é de ata o 10% na familia VIM, 15% na familia IMP e 70% entre as VIM e as IMP. Os encimas de ambas as familias son, non obstante, similares. Ambas as dúas están asociadas a integrón, ás veces en plásmidos. Ambas hidrolizan todas as β-lactamas excepto os monobactams, e eluden todos os inhibidores de β-lactamases. Os encimas VIM están entre os MBL máis amplamente distribuídos, e informouse de máis de 40 variantes de VIM. Os estudos bioquímicos e biofísicos revelaron que as variantes VIM teñen só pequenas variacións nos seus parámetros cinéticos pero con diferenzas substanciais nas súas estabilidades térmicas e perfís de inhibición.[13]
As β-lactamases do grupo OXA aparecen principalmente en especies de Acinetobacter e divídense en dous clústeres. As carbapenemases OXA hidrolizan carbapenems moi lentamente in vitro, e os altos CIM (concentración mínima inhibitoria) vistos para algúns hóspedes Acinetobacter (>64 mg/L) poden reflectir mecanismos secundarios. Están ás veces aumentados en illamentos clínicos por mecanismos de resistencia adicionais, como a impermeabilidade ou efluxo. As carbapenemases OXA tamén adoitan ter unha eficacia hidrolítica reducida cara ás penicilinas e cefalosporinas.[14]
Uns poucos encimas da clase A, os máis coñecidos dos cales son os encimas KPC mediados por plásmidos, son tamén carbapenemases efectivas. Coñécense dez variantes, numeradas da KPC-2 á KPC-11, e distínguense por unha ou dúas substitucións de aminoácidos (a KPC-1 foi resecuenciada en 2008 e viuse que era un 100% homóloga coas secuencias publicadas da KPC-2). A KPC-1 atopouse en Carolina do Norte, a KPC-2 en Baltimore e a KPC-3 en Nova York. Teñen só un 45% de homoloxía cos encimas SME e NMC/IMI e, a diferenza deles, poden ser codificados por plásmidos autotransmisibles.
En febreiro de 2009 a carbapenemase de Klebsiella pneumoniae clase A (KPC) son globalmente as carbapenemases máis comúns, e foron detectadas primeiro en 1996 en Carolina do Norte, EUA.[15] Unha publicación de 2010 indicou que as enterobacteriáceas produtoras de KPC estaban facéndose comúns nos Estados Unidos.[16]
A primeira carbapenemase da clase C foi descrita en 2006 e foi illada dunha cepa virulenta de Enterobacter aerogenes.[17] Está codificada nun plásmido, pYMG-1, e é, por tanto, transmisible a outras cepas bacterianas.[18]
Outros encimas que dan resistencia son: SME (Serratia marcescens Enzymes, ou encimas de Serratia marcescens), IMI (IMIpenem-hydrolysing β-lactamase, ou β-lactamase que hidroliza o Imipenem), NMC (non metalo-carbapenemase) e CcrA. En xeral, estes encimas teñen importancia clínica.
En canto ao CcrA (CfiA), o seu xene aparece en aproximadamente do 1 ao 3% de illamentos de Bacillus fragilis, pero poucas producen o encima, xa que a expresión require a migración apropiada dunha secuencia de inserción. A CcrA era coñecida xa antes de que fose introducido o imipenem, e os organismos produtores mostraron pouco incremento posterior.
As metallo-β-lactamase Nova Delhi (NDM-1) describíronse orixinalmente en Nova Delhi en 2009, este xene está agora espallado en Escherichia coli e Klebsiella pneumoniae da India e Paquistán. En 2010 as bacterias que levaban o xene da NDM-1 foran introducidas noutros países (incluíndo os Estados Unidos e o Reino Unido), moi probablemente debido ao gran número de turistas que viaxan polo mundo, que poden contaxiarse coa cepa no seu ambiente, xa que as cepas que conteñen o xene NDM-1 atopáronse en mostras ambientais na India.[19] A NDM ten varias variantes, que comparten diferentes propiedades.[20]
En xeral, sospéitase que un illamento é un produtor de ESBL cando mostra susceptibilidade in vitro á segunda xeración de cefalosporinas (cefoxitina, cefotetan) pero resitencia á terceira xerción de cefalosporinas e ao aztreonam. Ademais, debería sospeitarse destas cepas cando o tratamento con estes axentes para infeccións gramnegativas falla malia que se observase susceptibilidade in vitro. A resistencia asociada a aminoglicósidos e trimetoprim-sulfametoxazol, e tamén a alta frecuencia de coexistencia de resistencia á fluoroquinolona, crea moitos problemas. Os inhibidores da beta-lactamase como o clavulanato, sulbactam e tazobactam in vitro inhiben a maioría dos ESBL, pero a efectividade clínca das combinacións de beta lactama/inhibidor de beta lactamase non poden considerarse fiables para a terapia. As cefamicinas (cefoxitin e cefotetan) non son hidrolizadas pola maioría das ESBL, mais son hidrolizadas por β-lactamases de tipo AmpC asociadas. Ademais, as combinacións de β-lactama/inhibidor de β-lactamase non poden ser efectivas contra organismos que producen β-lactamase de tipo AmpC. Ás veces estas cepas diminúen a expresión doutras proteínas de membrana externa, fecéndoas resistentes á cefamicina. Os estudos in vivo obtiveron resultados variados contra K. pneumoniae produtora de ESBL. (Cefepime, unha cefalosporina de cuarta xeración, demostrou in vitro estabilidade en presenza de moitas cepas ESBL/AmpC.) Actualmente, os carbapenems son, en xeral, considerados os axentes preferidos para o tratamento de infeccións debidas a organismos produtores de ESBL. Os carbapenems son resistentes á hidrólise mediada por ESBL e mostran unha excelente actividade in vitro contra cepas de Enterobacteriaceae que expresan ESBLs.[21]
As cepas que producen só ESBL son susceptibles ás cefamicinas e carbapenems in vitro e mostran pouco ou ningún efecto de inóculo con estes axentes.
Para os organismos que producen ESBL de tipo TEM e SHV, a sensibilidade aparente in vitro ao cefepime e ao piperacilina/tazobactam é común, pero ambos os fármacos mostran un efecto de inóculo, cunha susceptibilidade diminuída a medida que o inóculo se incrementa de 105 a 107 organismos.
As cepas con algúns ESBL de tipo CTX-M e OXA son resistentes ao cefepime en probas, a pesar do uso dun inóculo estándar.
Aínda que as variantes TEM resistentes a inhibidor son resistentes á inhibición por ácido clavulánico e sulbactam, mostrando así resistencia clínica ás combinacións beta-lactama—inhibidor de beta-actamase de amoxicilina-clavulanato (Co-amoxiclav), ticarcilina-clavulanato e ampicilina/sulbactam, seguen sendo susceptibles á inhibición por tazobactam e á combinación de piperacilina/tazobactam.
As cepas produtoras de AmpC son tipicamente resistentes a oxiimino-beta lactamas e ás cefamicinas e son susceptibles aos carbapenems; porén, a expresión de porinas diminuída pode facer que esa cepa sexa tamén resistente ao carbapenem.
As cepas con carbpenemases de tipo IMP-, VIM- e OXA usualmente seguen sendo susceptibles. A resistencia a antibióticos non beta-lactámicos é común en cepas produtoras de calquera destes encimas, e tales opcións alternativas para os non beta-lactámicos deben ser determinados por probas de susceptibilidade directa. A resistencia a fluoroquinolonas e aminoglicósidos é especialmente alta.
Para infeccións causadas por especies de Escherichia coli ou Klebsiella produtoras de ESBL, o tratamento con imipenem ou meropenem foi asociado cos mellores resultados en canto á supervivencia e eliminación bacteriolóxica. O cefepime e a piperacilina/tazobactam tiveron menos éxito. A ceftriaxona, cefotaxime e ceftazidime fracasan incluso máis a miúdo, malia a susceptibilidade do microorganismo ao antibiótico in vitro. En varios informes documentouse o fallo da terapia con cefamicina como resultado da resistencia debido á perda de porinas. Algúns pacientes responderon á terapia con aminoglicósidos ou quinolona, pero, nunha comparación recente da ciprofloxacina e imipenem en bacteremias nas que estaba implicada unha K. pneumoniae produtora de ESBL, o imipenem produciu os mellolres resultados.
Houbo poucos estudos clínicos para definir a terapia óptima para infeccións causadas por cepas de Pseudomonas aeruginosa produtoras de ESBL.
A actividade encimática de beta-lactamase pode ser detectada usando nitrocefina, un substrato de cefalosporina cromoxénico que fai cambiar de cor do amarelo ao vermello pola hidrólise mediada por beta-lactamase.[22]
As beta-lactamases son encimas bacterianos bastante antigos. As beta-lactamases da clase B (as metalo-beta-lactamases) divídense en tres subclases: B1, B2 e B3. As subclases B1 e B2 teorízase que evolucionaron hai uns mil millóns de anos e a subclase B3 crese que evolucionou antes da diverxencia das eubacterias grampositivas e gramnegativas hai uns dous mil millóns de anos.[23]
Os outros tres grupos son os encimas de serina que mostran pouca homoloxía entre eles. Os estudos estruturais mostraron que os grupos A e D son taxons irmáns e que o grupo C diverxeu antes dos A e D.[24] Estes encimas baseados na serina, como as beta-lactamases do grupo B, son de orixe antiga e teorízase que evolucionaron hai uns dous mil millóns de anos.[25]
O grupo OXA (da clase D) en particular, teorízase que evolucionou nos cromosomas bacterianos e trasladouse despois aos plásmidos polo menos en dúas ocasións.[26]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.