Balsa lipídica
área da membrana plasmática da célula From Wikipedia, the free encyclopedia
Remove ads
Remove ads
Unha balsa lipídica é unha pequena área ou microdominio da membrana plasmática da célula de natureza glicolipoproteica na que se combinan glicoesfingolípidos e receptores proteicos de membrana.[1][2][3] Estes microdominios especializados de membrana compartimentalizan os procesos celulares ao serviren como centros organizadores para a ensamblaxe de moléculas de sinalización, influíren na fluidez da membrana e no tráfico de proteínas de membrana, e na regulación da neurotransmisión e o tráfico de receptores.[3][4] As balsas lipídicas están máis ordenadas e os seus compoñentes máis fortemente unidos entre si que a bicapa que os rodea, pero flotan libremente na bicapa da membrana.[5] Aínda que son máis comúns na membrana plasmática, as balsas lipídicas tamén se atoparon en membranas doutras partes da célula, como nas do aparato de Golgi e lisosomas.
Remove ads
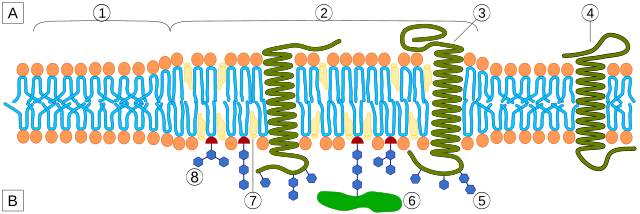
Propiedades das balsas lipídicas
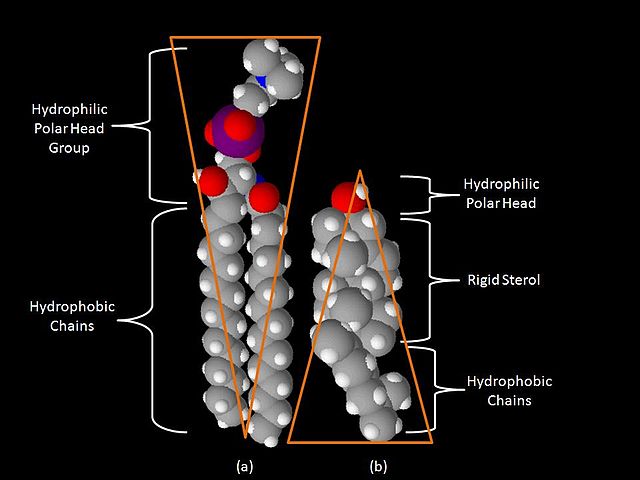
Unha diferenza clave entre as balsas lipídicas e as membranas plasmáticas das que derivan é a súa composición en lípidos. As balsas lipídicas xeralmente conteñen do triplo ao quíntuplo da cantidade de colesterol que normalmente se encontra nunha bicapa lipídica.[6] Ademais, as balsas lipídicas están enriquecidas en esfingolípidos como a esfingomielina, que está tipicamente elevada nun 50% en comparación coa membrana plasmática. Para compensar os niveis elevados de esfingolípidos, os niveis de fosfatidilcolina están diminuídos, o que orixina uns niveis similares de lípidos que conteñen colina entre as balsas e a membrana plasmática que as rodea. O colesterol interacciona preferentemente, pero non exclusivamente, cos esfingolípidos debido á súa estrutura e á saturación das súas cadeas hidrocarbonadas. Aínda que non todos os fosfolípidos da balsa están completamente saturados, as cadeas hidrofóbicas dos lípidos das balsas están máis saturadas e estreitamente empaquetadas que a bicapa circundante.[4] O colesterol é a "cola" dinámica que "pega" e mantén unida a balsa, ocupando os espazos entre os esfingolípidos e outros lípidos anfipáticos (que teñen unha grupo ou cabeza polar hidrofílica, e unha rexión hidrofóbica non polar).[3] Debido á natureza ríxida do grupo esterol, o colesterol particiónase preferentemente nas balsas lipídicas, onde as cadeas acilo dos lípidos tenden a ser máis ríxidas e estar nun estado menos fluído.[4][7][7]
Rietveld & Simons relacionaron as balsas lipídicas de membranas modelo coa inmiscibilidade de fases líquidas ordenadas (fase Lo) e desordenadas (fase Ld ou Lα).[8] A causa desta inmiscibilidade é incerta, pero a inmiscibilidade crese que minimiza a enerxía libre entre as dúas fases. Hai unha diferenza no grosor das balsas lipídicas e o da membrana que as rodea, que ten como resultado unha falta de coincidencia na hidrofobicidade no límite entre as dúas fases. Esta falta de coincidencia na altura da fase incrementa a tensión, o que pode producir a formación de plataformas de balsas máis circulares e grandes para minimizar o custo enerxético de manter as balsas como unha fase separada. Outros eventos espontáneos, como a curvatura da membrana e a fusión de pequenas balsas en balsas meirandes, pode tamén minimizar a tensión.[4]
Debido á súa composición e resistencia a deterxentes, as balsas lipídicas tamén se chaman complexos ricos en glicolípidos insolubles en deterxentes (GEMs) ou DIGs[9] ou Membranas Resistentes a Deterxentes (DRMs). Hipotetizouse que esta propiedade podería servir para extraelas da membrana. Porén, a validez da metodoloxía da resistencia a derterxentes das membranas foi posta en cuestión recentemente debido ás ambigüidades nos lípidos e proteínas recuperados e a observación de que poden tamén causar a formación de áreas sólidas onde previamente non as había.[10]
Remove ads
Tipos comúns de balsas lipídicas
Propuxéronse dous tipos de balsas lipídicas: balsas lipídicas planas (tamén chamadas non caveolares ou glicolipídicas) e caveolas. As balsas planas son continuas co plano da membrana plasmática (non invaxinadas) e carecen de características morfolóxicas distintivas. As caveolas, por outra parte, son invaxinacións arredondadas da membrana plasmática que conteñen proteínas caveolinas e son as estruturas máis facilmente observables entre as balsas lipídicas. As caveolinas exprésanse abondosamente no cerebro, microvasos do sistema nervioso, células endoteliais, astrocitos, oligodendrocitos, células de Schwann, e neuronas dos ganglios dorsais e hipocampo. As balsas planas conteñen a proteína flotilina e encóntranse en neuronas nas que as caveolas están ausentes. Ambos os tipos teñen unha composición lipídica similar (rica en colesterol e esfingolípidos). A flotilina e as caveolinas teñen a capacidade de recrutar moléculas de sinalización ás balsas, xogando así un importante papel na transdución de sinais neurotransmisora. Propúxose que estes microdominios organizan espacialmente as moléculas de sinalización para promoveren interaccións cineticamente favorables necesarias para a transdución de sinais. Inversamente, estes microdominios poden tamén separar as moléculas de sinalización, inhibindo as interaccións e atenuando as respostas de sinalización.[11]
Remove ads
Balsas lipídicas e transdución de sinais
A transdución de sinais nas células é a conversión dun tipo de sinal ou estímulo noutro. O sinal ou estímulo pode chegar a un receptor de membrana, que transmite directamente o sinal ao interior da célula, pero hai transducións de sinais máis complexas que implican o acoplamento de interaccións ligando-receptor con moitos eventos intracelulares, como a fosforilación por tirosina quinases ou serina/treonina quinases.[12] A especificidade e fidelidade da transdución de sinais é esencial para que as células respondan eficientemente aos cambios no seu ambiente. Isto conséguese en parte pola localización diferencial de proteínas que participan nas vías de sinalización. Na membrana plasmática, unha forma de compartimentalización é a utilización de balsas lipídicas.[13]
Unha forma de considerar o funcionamento das balsas lipídicas é que as pequenas balsas lipídicas poden concentrarse formando plataformas despois da activación pola unión dun ligando de receptores individuais.[14] Se a activación do receptor ten lugar nunha balsa lipídica, o complexo de sinalización está protexido dos encimas que non pertencen á balsa como as fosfatases de membrana. En conxunto, a unión a balsas serve para recrutar proteínas nun novo microambiente para que o estado de fosforilación poida ser modificado por quinases locais e fosfatases, o que orixinará a sinalización de augas abaixo da vía.[15] As balsas lipídicas están implicadas en moitos procesos de sinalización, como a sinalización por inmunoglobulina E (alerxias)[16][17][18], a sinalización do receptor para o antíxeno da célula T (TCR)[13][19][20][21][22] , ou do receptor para o antíxeno da célula B (BCR),[23] a do receptor de EGF, a do receptor da insulina etc.
As balsas lipídicas como plataformas para a entrada de virus
Os virus son parasitos intracelulares obrigados e teñen que establecer interaccións específicas con receptores celulares expresados na membrana plasmática para poder entrar nas células. As probas acumuladas apoian que os virus entran nas células utilizando microdominios de memrbana específicos, incluíndo balsas lipídicas.
Virus sen envoltura
Os modelos mellor estudados da entrada de virus sen envoltura relacionada con balsas lipídicas son o do virus simio 40 (SV40, un Papovaviridae) e o do ecovirus tipo 1 (EV1, un Picornaviridae).[24][25]
O SV40 utiliza dous receptores diferentes para unirse á superficie celular: o gangliósido GM1 localizado en balsas lipídicas e moléculas do complexo maior de histocompatibilidade (MHC) de clase I.[24][25] A unión do SV40 con moléculas MHC-I causa o agrupamento e redistribución do receptor. O SV40 pode recrutar máis caveolas procedentes do citoplasma ou tamén novas caveolas formadas no sitio de entrada.[25] Unha fervenza de eventos de sinalización inducidos pola unión do virus orixina unha endocitose mediada por caveolas nuns 20 minutos.[25] Nalgúns tipos de células o virus contido en vesículas non revestidas formadas directamente nas balsas lipídicas pode entrar na célula e pasar aos caveosomas (orgánulos citoplasmáticos vesiculares preexistentes) cando as vesículas se fusionan con eles.[25][26]
O EV1 utiliza a integrina α2β1 como receptor celular.[24] Poden unirse moitos heterodímeros de integrina a puntos adxacentes da cápside do virus.[25] De xeito similar ao que ocorre co SV40, a unión coa superficie das células provoca o agrupamento e recolocación de moléculas de integrina das balsas lipídicas en estruturas similares a caveolas.[25] A depleción do colesterol nas balsas lipídicas inhibe a infección por EV1.[24]
Hai tamén virus que usan a endocitose mediada por balsas non caveolar, como o ecovirus 11 (EV11, un picornavirus). Porén, os mecanismos detallados non se coñecen ben.[25]
Virus con envoltura
O virus da gripe únese ao receptor celular ácido siálico, o cal se une a un glicoconxugado na superficie da célula, para iniciar así a endocitose. Despois de ser transportado a endosomas tardíos, un cambio de conformación da hemaglutinina (HA) dependente de pHs baixos induce a fusión, e libéranse complexos ribonucleoproteicos virais polo fluxo protónico do canle iónica viral da proteína M2, que require a unión co colesterol. O virus Semliki Forest (SFV) e o virus Sindbis (SIN) necesitan que haxa colesterol e esfingolípidos nas balsas lipídicas da membrana diana para a fusión a membranas mediada por glicoproteína da envoltura e a súa entrada.[27] O virus T-linfotrópico humano tipo I (HTLV-1) entra na célula por medio do transportador de glicosa 1 (GLUT-1); o virus Ebola e o Marburg utilizan o receptor-α de folato (FRα), o cal é unha proteína ancorada a GPI (glicosilfosfatidilinositol); o virus da hepatite B recoñece o receptor do complemento tipo 2 humano (CR2, coñecido como CD21); O herpesvirus humano 6 (HHV-6) únese ao CD46 da superficie da célula hóspede humana; todos estes receptores virais están localizados en balsas lipídicas ou son recolocados nas balsas despois da infección.
O virus da inmunodeficiencia humana (VIH) debe penetrar primeiro unha barreira de células epiteliais, que non expresan receptores CD4 e de quimiocinas, para establecer unha infección produtiva. Un receptor alternativo para a glicoproteína da envoltura do VIH-1 situado nas células epiteliais é o glicoesfingolípido galactosil-ceramida (GalCer), cuxa concentración está enriquecida nas balsas lipídicas.[28][29]
Remove ads
Visualización de balsas lipídicas
Unha das principais razóns da controversia sobre as balsas lipídicas derívase do difícil que é estudar as balsas lipídicas nas células vivas, as cales non están en equilibrio termodinámico.[11] As balsas lipídicas son pequenos microdominios cun tamaño entre 10–200 nm.[4] Debido a que o seu tamaño está debaixo do límite clásico de difracción dun microscopio óptico, as balsas lipídicas son difíciles de visualizar directamente. Actualmente, estúdanse membranas sintéticas, aínda que hai moitos inconvenientes no estudo destas membranas. Primeiro, as membranas sintéticas teñen unha menor concentración de proteínas comparadas coas biomembranas. Ademais, é difícil modelizar as interaccións entre as membranas e o citoesqueleto que están presentes nas biomembranas. Outras dificultades son a falta de asimetría natural e a incapacidade de estudar as membranas en condicións de non equilibrio.[4][30] A pesar de todo, a microscopia de fluorescencia utilízase amplamente neste campo. Por exemplo, úsanse moito os fluoróforos conxugados á subunidade B da toxina colérica, que se unen ao compoñente das balsas o gangliósido GM1. Tamén se usan tinguiduras de membrana lipofílicas as cales se particionan entre as balsas e o resto da membrana, ou cambian as súas propiedades fluorescentes en resposta á fase da membrana. O Laurdan é un dos principais exemplos desas tinguiduras. As balsas poden tamén ser etiquetadas pola expresión xenética de proteínas de fusión fluorescentes como Lck-GFP.
A manipulación do colesterol é unha das técnicas máis amplamente utilizada no estudo das balsas lipídicas. O secuestro (usando filipina, nistatina ou anfotericina), a depleción, a eliminación (usando metil-B-ciclodextrina) e a inhibición da síntese do colesterol (usando inhibidores da HMG-CoA redutase) son xeitos de manipular o colesterol nos estudos das balsas. Estes estudos permiten a observación dos efectos que ten sobre a sinalización neurotransmisora a redución dos niveis de colesterol.[11]
Sharma e colaboradores utilizaron unha combinación de imaxes de alta resolución e modelos matemáticos para concluír que as proteínas das balsas están organizadas en nanoclusters de alta densidade cun raio entre 5–20 nm. Utilizando medidas de transferencia de enerxía de resonancia de fluorescencia (homo-FRET ou anisotropía de fluorescencia), Sharma et al. informaron que unha fracción (20–40%) das proteínas con áncora GPI está organizada en agrupacións de alta densidade cun raio de 4–5 nm, cada unha constituída por unhas poucas moléculas e diferentes proteínas con áncora GPI.[31] Para evitar os problemas derivados do pequeno tamaño e natureza dinámica, está gañando importancia o rastreo de moléculas e partículas únicas utilizando cámaras CCD sensibles arrefriadas e a microscopia de reflexión interna total (TIRF). Isto permite extraer información da difusión de partículas nas membranas e revelar a presenza de barreiras, sitios de confinamento e currais nas membranas.[32]
Outras técnicas ópticas tamén usadas son: correlación de fluorescencia e espectroscopía de correación cruzada (FCS/FCCS), que poden utilizarse para obter información da mobilidade do fluoróforo na membrana, a transferencia de enerxía de resonancia de fluorescencia (FRET), que pode detectar cando os fluoróforos están moi próximos, e técnicas de pinza óptica, que poden dar información sobre a viscosidade da membrana.[11]
Tamén se usan a microscopia de forza atómica (AFM), a microscopia de condutancia de ións de varrido (SICM), a interferometría de polarización dual, a resonancia magnética nuclear (NMR), aínda que a microsopia de fluorescencia segue sendo a técnica dominante. No futuro espérase que a microscopia de super-resolución como a Depleción de Emisión Estimulada (STED)[33] ou outras formas de microscopia de iluminación estruturada poidan superar os problemas que impón o límite de difracción.
Outras técnicas utilizadas na análise bioquímica das balsas lipídicas son a ELISA, western blot, e FACS.[34][35][1]
Remove ads
Controversia sobre as balsas lipídicas
O papel das balsas lipídicas na sinalización celular, trafico celular, e estrutura das membranas aínda non está inequivocamente determinada malia os moitos experimentos nos que se utilizaron diversos métodos, polo que a súa propia existencia é controvertida.[36]
Os que formulan argumentos en contra da existencia das balsas lipídicas indican os seguintes:
- Debería existir unha tensión entre as fases Lα e Lo. Esta foi observada en membranas modelo, pero non se observa facilmente en sistemas celulares.
- Non hai consenso sobre o tamaño das balsas lipídicas, e os informes achegados dan diversos valores situados no intervalo entre 1 e 1.000 nanómetros.
- A escala de tempo na que existen as balsas lipídicas non se coñece. Se as balsas lipídicas existen, poderían formarse só nunha escala de tempo que fose irrelevante para os procesos biolóxicos.
- A totalidade da membrana pode atoparse na fase Lo.
Unha primeira refutación a este último punto suxire que a fase Lo das balsas está empaquetada moi estreitamente debido á formación de enlaces de hidróxeno intermoleculares entre esfingolípidos e o colesterol, que non se observan noutros lugares.[37]
Un segundo argumento cuestiona a efectividade do deseño experimental cando se alteran as balsas lipídicas. Pike e Miller discuten os inconvenientes potenciais que ten o uso da depleción de colesterol para determinar a función das balsas lipídicas.[38] Estes autores indican que a maioría dos investigadores están utilizando métodos agudos de depleción do colesterol, o cal altera as balsas, pero tamén altera outros lípidos como o PI(4,5)P2. O PI(4,5)P2 xoga un amplo papel na regulación do citoesqueleto da célula,[39] e a alteración do PI(4,5)P2 causa moitos resultados similares aos da depleción do colesterol, incluíndo a difusión lateral de proteínas na membrana.[40] Como os métodos utilizados alteran tanto as balsas coma o PI(4,5)P2, Kwik et al. conclúen que a perda dunha función celular determinada despois da depleción do colesterol non pode necesariamente ser atribuída só á alteración da balsa lipídica, xa que se poden ver afectados outros procesos independentes das balsas. Finalmente, aínda que se cre que as balsas lipídicas están conectadas dalgún modo con proteínas, Edidin argumenta que as proteínas atraen aos lípidos da balsa por interaccións das proteínas coas cadeas acilo dos lípidos, e non ao contrario.[41]
Remove ads
Historia
Ata 1982 aceptábase xeneralizadamente que os fosfolípidos e as proteínas de membrana estaban distribuídas aleatoriamente nas membranas celulares, de acordo co modelo de mosaico fluído de Singer e Nicolson, publicado en 1972.[4][42] Porén, a existencia de microdominios de membrana postulárona Stier e Sackman e Klausner e Karnovsky xa na década de 1970 utilizando enfoques biofísicos.[43][44] Stier e Sackmann e Israelachvili et al atribuíron estes dominios ás propiedades físicas e organización das mesturas lipídicas.[45] En 1974, os efectos da temperatura sobre o comportamento das membranas levou a propoñer que nas membranas había "agrupamentos de lípidos", e en 1975 os datos suxerían que estes agrupamentos ou clusters podían ser rexións "quasicristalinas" situadas dentro do conxunto de moléculas de lípidos cristalinos líquidos máis libremente dispersos. En 1978, estudos de difracción de raios X serviron para desenvolver máis a idea dos "clusters", definindo os microdominios como "lípidos nun estado máis ordenado". Karnovsky e colegas formalizaron o concepto de dominios lipídicos nas membranas en 1982. Os estudos de Karnovsky mostraron unha heteroxeneidade nas vidas medias do 1,6-difenil-1,3,5-hexatrieno, o cal indicaba que había múltiples fases no ambiente lipídico da membrana.[4] Un tipo de microdominio está constituído por colesterol e esfingolípidos, e fórmase porque se produce unha segregación destes lípidos en fases separadas, o que foi demostrado por Biltonen e Thompson e os seus colegas.[46] Estes microdominios ("balsas") viuse que existían tamén nas membranas celulares.[47] Máis tarde, Kai Simons do Laboratorio Europeo de Bioloxía Molecular (EMBL) en Alemaña e Gerrit van Meer da Universidade de Utrecht, en Holanda volveron a atraer o interese sobre estes microdominios de membrana presentes nas células, enriquecidos con colesterol, glicolípidos, e esfingolípidos.[48] Chamaron a estes microdominios balsas lipídicas. O concepto orixinal das balsas foi utilizado como unha explicación do transporte de colesterol desde a rede trans Golgi á membrana plasmática. A idea foi desenvolvida máis formalmente en 1997 por Simons e Ikonen.[49] Nun simposio de 2006 sobre balsas lipídicas e función celular, as balsas lipídicas foron definidas como "pequenos dominios (10-200 nm), heteroxéneos, moi dinámicos, enriquecidos en esterol e esfingolípidos que compartimentalizan os procesos celulares. As pequenas balsas poden ás veces quedar estabilizadas e formar plataformas máis grandes por medio de interaccións proteína-proteína". Nos anos recentes, os estudos sobre balsas lipídicas tratan de aclarar moitos dos asuntos clave que causan controversia neste campo, como o tamaño e a duración das balsas.
Remove ads
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
