Ácido maleico
composto químico From Wikipedia, the free encyclopedia
Remove ads
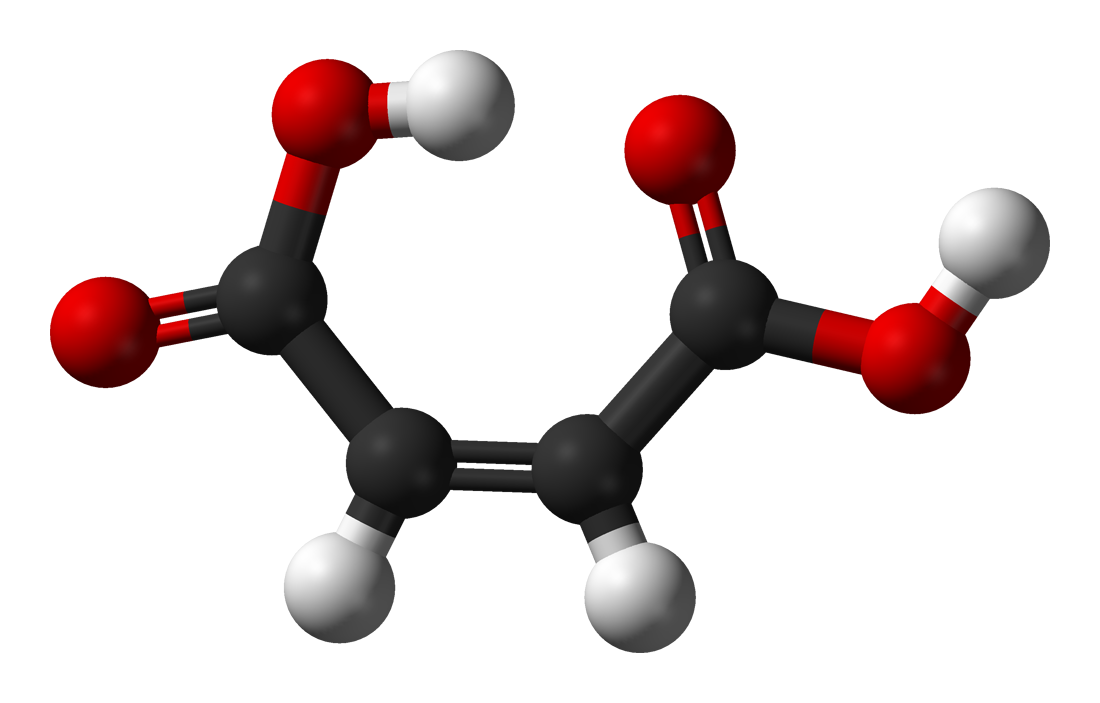
O ácido maleico ou ácido cis-butenodioico é un composto orgánico que é un ácido dicarboxílico, unha molécula con dous grupos carboxilo. A súa fórmula química é HO2CCHCHCO2H. O ácido maleico é o isómero cis do ácido butenodioico, mentres que o ácido fumárico é o seu isómero trans. Utilízase principalmente como precursor do ácido fumárico, e comparado co seu composto parental anhídrido maleico, o ácido maleico ten poucas aplicacións.
Remove ads
Remove ads
Propiedades físicas
O ácido maleico é unha molécula menos estable que o ácido fumárico.[2] A diferenza en calor de combustión é de 22,7 kJ·mol−1. A calor de combustión é de -1355 kJ/mol.[4] O ácido maleico é máis soluble en auga que o ácido fumárico. O punto de fusión (descomposición) do ácido maleico (135 °C) é tamén moito menor que o do ácido fumárico (287 °C). Estas dúas propiedades do ácido maleico poden explicarse polo establecemento de pontes de hidróxeno intramoleculares[5] que ten lugar no ácido maleico en detrimento de interaccións intermolecular, o que non é posibles no ácido fumárico por razóns xeométricas.
Remove ads
Produción e aplicacións industriais
Na industria, o ácido maleico derívase da hidrólise do anhídrido maleico, e este último prodúcese a partir da oxidación do benceno ou butano.[6]
O ácido maleico é unha materia prima industrial para a produción de ácido glioxílico por ozonólise.[7]
O ácido maleico pode utilizarse para formar sales de adición ácidas con fármacos para facelos máis estables, como o indacaterol maleato.
O ácido maleico utilízase tamén como un promotor de adhesión para diferentes substratos, como o nailon e os metais cubertos de zinc, como o aceiro galvanizado, en adhesivos baseados no metil metacrilato.
Isomerización do ácido fumárico
O principal uso industrial do ácido maleico é a súa conversión en ácido fumárico. Esta conversión é unha isomerización, e é catalizada por diversos reactivos, como ácidos minerais e tiourea. A gran diferenza de solubilidade en auga co ácido fumárico fai que a purificación deste sexa doada.
O ácido maleico e o fumárico non se interconverten espontaneamente porque a rotación arredor dun dobre enlace carbono-carbono non é enerxeticamente favorable. Porén, a conversión do isómero cis no trans é posible por fotólise en presenza dunha pequena cantidade de bromo.[8] A luz converte o bromo elemental nun radical bromuro, que ataca o alqueno nunha reacción de adición a un radical bromo-alcano; e agora xa é posible a rotación no enlace simple. Os radicais bromuro recombínanse e fórmase o ácido fumárico. Noutro método (usado como demostración de clase), o ácido maleico é transformado en ácido fumárico ao quentar ácido maleico nunha solución de ácido clorhídrico. A adición reversible (de H+) causa a libre rotación en torno ao enlace C-C central e a formación do máis estable e menos soluble ácido fumárico.
Remove ads
Outras reaccións
Aínda que non se realiza comercialmente, o ácido maleico pode converterse en anhídrido maleico por deshidratación, e en ácido málico por hidratación, e en ácido succínico por hidroxenación (etanol / paladio sobre carbono).[9] Reacciona con tionil cloruro ou pentacloruro de fósforo para dar o cloruro de ácido maleico (non é posible illar o cloruro mono ácido). O ácido maleico, ao ser electrófilo, participa como dienófilo en moitas reaccións de Diels-Alder.
Maleatos
O ión maleato é a forma ionizada do ácido maleico (non confundir con malato). O ión maleato é útil en bioquímica como inhibidor das reaccións das transaminases. Os ésteres do ácido maleico tamén se chaman maleatos, como por exemplo o dimetil maleato.
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads