Tartre (eau)
dépôt calcaire issu de la précipitation des minéraux contenus dans l’eau sous l’effet de la chaleur De Wikipédia, l'encyclopédie libre
Le tartre est un dépôt calcaire issu de la précipitation des minéraux contenus dans l’eau sous l’effet de la chaleur, fréquemment retrouvé dans les canalisations.
Il ne doit pas être confondu avec le tartre dentaire dont la composition est différente.
Formation des tartres
Résumé
Contexte
Dans certaines conditions (en présence d'une augmentation de la température, de catalyseurs, de noyaux de cristallisation, de certaines bactéries), ces minéraux peuvent précipiter, cristalliser ou être utilisés par des biofilms bactériens (bioconcrétion).
Par exemple, des sels minéraux qui restent sous la forme d'ions dans de l'eau froide, précipitent sous forme de carbonate de calcium.
Quand cela arrive dans une bouilloire, machine à laver le linge, ou un chauffe-eau, le tartre réduit leurs performances.
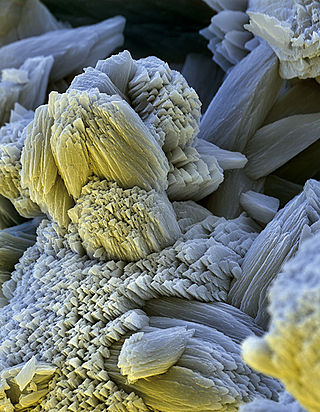
Le tartre est essentiellement composé de carbonate de calcium, plus ou moins coloré par des oxydes métalliques, matières organiques, etc. Il existe une multitude de cristallisations du carbonate de calcium. On distingue deux ensembles :
- calcite : cristaux compacts et irréguliers avec un pouvoir élevé d'accrochage ;
- aragonite : cristaux de carbonate de calcium de forme géométrique régulière (aiguilles par exemple), avec un faible pouvoir d'accrochage.
Certains matériaux (inox, Téflon, etc.) ralentissent la formation de tartre.
Dans les canalisations
Résumé
Contexte
Par extension, on désigne également sous le nom de « tartre » l'ensemble des sels de calcium se déposant dans des canalisations. Il peut s'agir de :
- carbonate de calcium ;
- oxalate de calcium ;
- phosphate de calcium ;
- silicates.
Le tartre se manifeste sous forme de dépôts blancs qui se déposent sur les résistances, parois, canalisations, etc. On dit de cette eau qu'elle est « calcaire ».
Si dans l'absolu, il n'y a aucun danger pour la santé à boire une eau très calcaire, le tartre abîme, entre autres, les appareils :
- le calcaire se dépose sur la résistance des machines à laver et entraîne une surconsommation de 30 % des produits lessiviels ;
- réduction du diamètre des canalisations dû à l'entartrage. Un millimètre de calcaire déposé dans un tuyau de vingt millimètres de diamètre correspond à 15 % de rendement perdu ;
- l'entartrage de la chaudière agit comme un isolant empêchant le transfert thermique et l'efficacité de l'échange. C'est la cause d'une surconsommation d'énergie ;
- l'eau calcaire entraîne une surconsommation de sel régénérant et de liquide de rinçage d'un lave-vaisselle ;
- entartre les équipements électroménagers (cafetière, bouilloire, etc.) et réduit leur durée de vie ;
- entartrage des radiateurs, la réduction du diamètre des canalisations. Ceci entraîne une perte d'échange, le grippage des robinets et thermostats.
Les dépôts de tartre augmentent le risque de proliférations bactériennes, surtout lorsque les eaux stagnent à une température élevée.
Comment retirer le tartre des canalisations
Il existe principalement deux solutions pour prévenir l'apparition du tartre, les adoucisseurs d'eau à sel et les adoucisseur d'eau sans sel :
- les adoucisseurs à sel remplacent le magnésium et le calcium de l'eau par du sodium, ce qui a pour effet de supprimer la formation du tartre. Cependant l'eau devient très chargée en sodium et n'est pas conseillée d'être bue[1] ;
- les adoucisseurs sans sel fonctionnent par cristallisation, permettant de transformer la calcite en aragonite limitant fortement les dépôts de tartre. Cette méthode est plus douce et permet d'avoir une eau excellente à boire.
D'autres procédés « plus brutaux » existent. En effet, le tartre étant constitué de cristaux de carbonate de calcium, et comme les ions carbonate sont une base faible de Brønsted, il est sensible aux acides. Par conséquent, on peut prévenir l'apparition du tartre en acidifiant l'eau, et s'il s'est déjà formé, on peut l'enlever en le traitant à l'acide ; c'est le principe des détartrants du commerce, composés de divers acides, en général des acides faibles comme l'acide acétique ou l'acide lactique. L'important ici est de diminuer le pH et de l'amener suffisamment bas pour que l'équilibre soit déplacé vers le sens de la formation d'ions hydrogénocarbonate ou d'acide carbonique. Dans les canalisations domestiques, il faut faire attention au caractère irritant et corrosif de ces acides mais aussi il faut veiller à ne pas mélanger ces acides avec de l'eau de Javel sous peine de formation de dichlore gazeux hautement toxique.

Par exemple, le détartrant à base d'acide lactique doit être versé dans les canalisations après l'avoir dilué dans un volume d'eau.
Avec [H+] = 1,3 × 10−4 mol/L à 25 °C[2], pH = 3,88. Il permet d'engendrer les réactions suivantes :
- CaCO3 + 2 CH3CH(OH)COOH → Ca2+ + H2CO3 + 2 CH3CH(OH)COO−
- H2CO3 → H2O + CO2.
Ainsi l'action de l'acide lactique sur le tartre produit une combinaison de gaz carbonique et de lactate de calcium qui, lui, est soluble (et consommable, aux concentrations auxquelles il est utilisé).
Références
Voir aussi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.


