Top Qs
Chronologie
Chat
Contexte
Syndrome de dysgénésie testiculaire
De Wikipédia, l'encyclopédie libre
Remove ads
Le syndrome de dysgénésie testiculaire ou TDS (abréviation de l'expression Testicular dysgenesis syndrome pour les anglophones) est un syndrome associant chez les sujets masculins au moins deux des anomalies de développement du système reproducteur masculin suivantes :
À la naissance, puis toute la vie (sauf opération chirurgicale) :
- pénis mal formé (avec notamment hypospadias et/ou ) ;
- pénis anormalement petit ;
- testicule non descendu (cryptorchidie, généralement opéré chirurgicalement dans l'enfance) ;
et à partir de l'adolescence :
- moindre qualité du sperme ;
- moindre quantité de spermatozoïdes produits par millilitre de sperme ;
- nombre anormal (à très élevé) de spermatozoïdes mal-formés ;
- sous-fécondité (ou infertilité) masculine ;
avec éventuel cancer du testicule. Si ces symptômes semblent pouvoir être rapportés à une modification (inhibition) de la production de testostérone à un moment critique de la vie fœtale qui est celui du lancement du « programme » de « masculinisation » de l'embryon (dont le programme naturel de base est orienté vers la production d'un organisme féminin).
Le concept a été introduit pour la première fois par le chercheur danois N.E. Skakkebæk dans un article de recherche écrit en collaboration avec le département de croissance et de reproduction de l'université de Copenhague[1]. Les équipes danoise et anglaise qui ont décrit ce syndrome ont, après plusieurs années d'études, proposé comme explication unique l'exposition in utero à un perturbateur endocrinien ou à de très faibles doses d'un cocktail de différents produits chimiques ayant un effet œstrogénique (mimes-hormonaux) perturbant le développement du système reproducteur masculin. L'article suggère que l'origine et la cause sous-jacente du TDS peuvent être détectées dès la vie fœtale, où des facteurs environnementaux et génomiques pourraient affecter le développement du système reproducteur masculin[2].
On parle de « Dysgénésie gonadique complète 46,XY » (maladie rare) quand il y a absence totale de développement gonadique, « qui se traduit par la présence d'organes génitaux externes et internes féminins malgré un caryotype 46,XY »[3] ; et de « Dysgénésie gonadique mixte 45,X/46,XY » (autre maladie rare) en cas d'anomalie numérique des chromosomes sexuels résultant d'un mosaïcisme du chromosome Y et associée à des anomalies du développement gonadique et à des signes du syndrome de Turner avec alors un tableau clinique pouvant aller d'une masculinisation partielle, avec ambiguïté génitale à la naissance jusqu'au phénotype complètement masculin ou complètement féminin. Le patient peut aussi dans ce cas, parfois, présenter une persistance des structures müllériennes, ce qui ajoute à la complexité du syndrome (les structures müllériennes sont des structures embryonnaires qui chez l'embryon féminin se développent pour former les trompes de Fallope, l’utérus, et la partie supérieure du vagin, et qui chez l'embryon masculin régresse durant l'embryogenèse sous l’influence de l’hormone anti-müllérienne (AMH) produite par les cellules de Sertoli des testicules de l'embryon).
Si cette hormone ou ses récepteurs sont déficients, les structures müllériennes peuvent persister chez un individu de caryotype masculin (46,XY), ce qui peut entraîner des anomalies telles que la présence d’un utérus, des trompes de Fallope et une partie supérieure du vagin chez un garçon2)[4]. « Le signe le plus fréquent de la dysgénésie gonadique mixte 45,X/46,XY (DGM 45,X/46,XY) est le développement asymétrique des testicules, avec souvent d'un côté une dysgénésie testiculaire, et de l'autre côté une gonade réduite à une bandelette fibreuse. L'asymétrie peut aussi toucher les organes génitaux externes et internes »[5]. Dans certains cas l'ambiguité génitale ou sexuelle et très prononcée, la question de l'assignation sexuelle est alors posée.
Remove ads
Histoire
Résumé
Contexte


La toxicologie environnementale de la reproduction masculine est un champ d'investigation multidisciplinaire qui a émergé dans les années 1980, alors qu'on observait dans le monde, un accroissement de la délétion de la spermatogenèse (dont en France)[6] et du nombre de cancer du testicule chez les jeunes, ainsi que de certaines malformations des organes génitaux externes à la naissance (au moins doublement global du nombre de cas d'hypospadias et de cryptorchidie en 40 ans, avec des variations temporelles et géographiques marquées) (non-descente d'un ou des deux testicules dans le scrotum)[7]. Le nom de ce syndrome a initialement été proposé par deux chercheurs, le danois Niels Skakkebaek[note 1] et l'anglais Richard Sharpe[note 2] dans des articles qu'ils ont publié dans deux publications scientifiques spécialisées ; Human Reproduction et Toxicology Letters.
À la suite de leurs recherches, et en particulier grâce à l'étude des nombreuses études ou bilans de dons de sperme collectés des années 1940 à nos jours, ces chercheurs avaient constaté qu'un faisceau d'indices puis de preuves (observations cliniques et multiples grandes études épidémiologiques) confirmaient dans les années 1990 une augmentation synchronisée (temporelle et géographique) :
- de l'incidence de l'infertilité masculine et de l'hypofertilité ;
- de l'incidence du cancer testiculaire et de malformations génitales ;
- de l'exposition des embryons et des femmes (enceintes et avant leur grossesse) à de nombreuses substances qui sont perturbateurs endocriniens avérés ou qui sont soupçonnées d'êtres des xœno-œstrogènes.
Des facteurs de prédisposition génétique sont également possibles et probables, mais dans les années 2000, le caractère épidémique du syndrome et sa relative localisation géographique, ainsi que l'existence de fréquentes combinaisons de plus d'un problème chez un seul individu, suggèrent très fortement l'existence d'une cause environnementale[8].
Dans presque tous les cas, le problème de fertilité peut être rapportée à un mauvais développement du testicule in utero à un moment-clé du développement de l'embryon masculin : celui de la première sécrétion de testostérone, qui doit modifier le programme général de l'embryon pour l'orienter vers la masculinisation de l'organisme, et tout particulièrement des organes génitaux masculins.
Quand ces conditions sont réunies dans un seul individu, ce phénotype est nommé syndrome de dysgénésie testiculaire (SDT pour les francophones, TDS pour les anglophones).
Remove ads
Causes
Résumé
Contexte
Cette dysgénésie a des composantes génétiques, mais aussi environnementales et de style de vie. L'augmentation rapide de son incidence chez les nouveaux né de sexe masculin constatée depuis plusieurs décennies[9] indique qu'il est sous une forte influence environnementale.
Les origines fœtales du TDS sont renforcées par la forte incidence des troubles du TDS observés simultanément chez un même individu. [citation nécessaire] Associé à une mutation du facteur 3 de type insuline (INSL3)[10].
Aspects génétiques
De nombreux gènes ont été impliqués dans les dysgénésies testiculaires. Des études d'association pangénomique (GWAS) ont régulièrement identifié de nouvelles variantes génétiques jouant un rôle dans le développement anormal des testicules. Certaines d'entre elles sont spécifiques à certains troubles, et d'autres font partie d'un « réseau de facteurs de risque » qui relie le Cancer des cellules germinales testiculaires (CCGT), l'hypospadias, la cryptorchidie l'oligospermie et des anomalies de conformation des spermatozoïdes[1],[7].
La majorité de ces gènes sont impliqués dans le développement foetal des gonades, qui se fait sous le contrôle hormonal. Les mutations des gènes des récepteurs aux androgènes sont fortement impliquées ; ces mutations sont impliquées dans le développement du pénis, la descente des testicules et le développement des testicules[1]. Le cancer des cellules germinales testiculaires (TGCC) présente une forte disposition génétique, les variantes génétiques les plus importantes étant celles liées à la formation des gonades et à la fonction des cellules germinales[11],[12].
Selon Orphanet : « le conseil génétique doit être proposé aux parents ayant reçu un diagnostic prénatal de mosaïcisme 45,X/46,XY, mais celui-ci est complexe compte tenu du large spectre phénotypique associé à cette anomalie »
Remove ads
Épidémiologie, causes environnementales
Résumé
Contexte
Il ne s'agit aucunement d'une maladie contagieuse, mais d'un syndrome qui présente des caractéristiques épidémiques et écoépidémiques, parce qu'en régulière augmentation depuis 50 ans environ et associé à des variations géographiques (les grandes villes sont beaucoup moins touchées que les campagnes agricoles aux États-Unis).
Il est démontré que l'exposition d'un fœtus mâle à des substances qui perturbent les systèmes hormonaux, en particulier des produits chimiques qui inhibent l'action des androgènes (hormones sexuelles masculinisantes) pendant le développement du système reproducteur, provoque de nombreux troubles caractéristiques du SDT. Il s'agit notamment des œstrogènes et des anti-androgènes environnementaux présents dans les eau et aliments notamment contaminées par des hormones synthétiques et des pesticides ou résidus de pesticides utilisés dans l'agriculture et qui sont des leurres hormonaux[13]. Dans des cas historiques, des médicaments administrés aux femmes enceintes, comme le diéthylstilbestrol (DES), ont provoqué de nombreuses caractéristiques du TSDT chez les fœtus exposés à ce produit chimique pendant la gestation[14]. L'impact des produits chimiques environnementaux est bien documenté dans les modèles animaux[1]. Si une substance affecte la différenciation des cellules de Sertoli et des cellules de Leydig (une caractéristique courante des troubles du SDT) à un stade précoce du développement, la croissance des cellules germinales et la production de testostérone seront altérées[11]. Ces processus sont essentiels à la descente des testicules durant le développement embryonnaire, et au développement des organes génitaux ; ce pourquoi les anomalies génitales comme la cryptorchidie ou l'hypospadias sont présentes dès la naissance, alors que les problèmes de fertilité et de Cancer des cellules germinales testiculaires (CCGT), apparaissent plus tard, de l'adolescence à l'âge adulte.
La gravité ou le nombre de troubles dysgénésiques peuvent donc dépendre du moment de l'exposition environnementale[1]. En 2017, Sander van den Driesche et al. ont confirmé et mis en exergue l'importance des « fenêtres d'exposition » qui existent durant la vie fœtale[15]. Et les SDT induits chez des animaux de laboratoire par l'exposition à certains phtalates ont conduit l'Agence européenne des substances chimiques (ECHA) à proposer de nouvelles mesures de gestion des risques pour ces molécules[7].
Les facteurs environnementaux peuvent aussi activer des mécanismes épigénétiques source d'anomalies congénitales. Une susceptibilité génétique augmentée par des facteurs environnementaux est probablement la cause principale du SDT. Parmi les éléments du mode de vie semblant parfois être en cause figure :
- le tabagisme maternel (liens ténus avec SDT, mais le tabagisme affecte la croissance du fœtus, et un faible poids à la naissance est associé à un risque accru de de tous les troubles englobés par le SDT.
- l'obésité maternelle, entraînant un diabète gestationnel, s'est également avérée être un facteur de risque de développement altéré des testicules et de symptômes du SDT chez les fils.
Remove ads
Pathogenèse

La dysgénésie testiculaire peut avoir diverses causes primaires, pouvant conduire à des anomalies de la fonction des cellules de Sertoli et/ou de Leydig. Cela conduit à la fois à un développement altéré des cellules germinales et à des changements hormonaux lors de la différenciation sexuelle masculine.
Par exemple, une production insuffisante de testostérone peut entraîner une masculinisation incomplète, tandis qu'une expression réduite du facteur 3 analogue à l'insuline peut entraîner une descente incomplète des testicules.[12] Les troubles en aval de ces anomalies peuvent inclure à la fois des malformations génitales (par exemple, l'hypospadias et la cryptorchidie) et des troubles de la reproduction retardés (par exemple, le cancer des testicules et la mauvaise qualité du sperme) qui comprennent le SDT[16].
Remove ads
Diagnostic
Résumé
Contexte


Hypospadias
L'hypospadias est un emplacement anormal de l'extrémité de l'urètre qui débouche avant l'extrémité distale (normale) du pénis. Le diagnostic est généralement posé à la naissance à partir d'une confirmation visuelle des caractéristiques caractéristiques. En plus d'une localisation inhabituelle de l'urètre, le prépuce est généralement également incomplet. Le prépuce anormal « encapuchonné » est ce qui attire souvent l'attention sur la maladie, mais peut survenir indépendamment de l'hypospadias.
Cryptorchidie
Dans la cryptorchidie, le diagnostic est établi à partir d'un examen physique : il manque dans le sac scrotal du bébé un, voire deux, des deux testicules[17]. 70 % des testicules cryptorchides sont palpables et ne peuvent pas être tirés dans le scrotum ou se rétractent rapidement dans une position plus haute après avoir été tirés vers le bas. Dans 30 % des cas, les testicules ne peuvent pas être perçus à la palpation, ce qui indique une localisation intra-abdominale.
La cryptorchidie est souvent associée à :
- des antécédents familiaux de la maladie ;
- un faible poids à la naissance ;
- la prématurité.
Mauvaise qualité du sperme
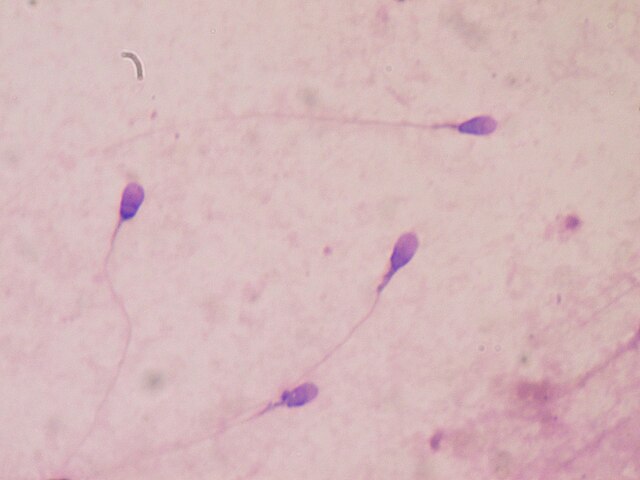
La mauvaise qualité du sperme se mesure non seulement par le nombre de spermatozoïdes produits par un homme, mais aussi par l'efficacité de ces derniers à féconder un ovule. La motilité et la forme des spermatozoïdes sont importantes pour ce rôle. Un homme dont la qualité du sperme est médiocre présentera souvent des problèmes de fertilité, ce qui se traduit par un couple essayant de concevoir depuis plus d'un an sans succès[18]. Le diagnostic peut être établi à partir d'une analyse du sperme, en prélevant un échantillon du sperme de l'homme et en effectuant des tests pour compter le nombre et la qualité de chaque spermatozoïde.
Cancer des testicules
La manifestation la plus courante du cancer des testicules est une masse dure et indolore qui peut être ressentie sur l'un des testicules. Le cancer du testicule est soit détecté par un médecin lors d'un examen de routine, soit par le patient lui-même[19]. Les facteurs de risque du cancer du testicule comprennent :
- Cryptorchidie
- Antécédents familiaux
- Antécédents de cancer du testicule
Le diagnostic est confirmé de différentes manières. Une échographie peut être utilisée pour établir un diagnostic avec une précision de 90 à 95 %. Des analyses sanguines peuvent également être effectuées pour rechercher des marqueurs tumoraux élevés, ce qui permet également d'analyser la réponse du patient au traitement. 80 % des cas de cancer des testicules concernent la tranche d'âge de 20 à 34 ans[20]
Diagnostic(s) différentiel(s)
Le diagnostic différentiel doit écarter d'autres dysgénésies (dysgénésie ovariennes hypergonadotropes (DG à 46,XX) mais aussi toutes les formes syndromiques de DG à 46,XY (dont notamment le syndrome de Frasier, la dysplasie campomélique et l'ADS à 46,XY avec insuffisance surrénalienne).
Remove ads
Traitements, Prise en charge
Selon l'étiologie, le diagnostic génétique et la gravité des malformations, la prise en charge peut aller de l'accompagnement psychologique du patient et de sa famille dans un centre spécialisé dans les troubles du développement sexue, jusqu'à l'intervention chirurgicale (par exemple, une ablation du tissu gonadique strié peut être nécessaire pour éviter une évolution vers le cancer) en passant par le traitement d'éventuelles comorbidité (malformations associées le plus souvent)[3],[5].
Une substitution hormonale est recommandée au moment de la puberté[3].
L'infertilité est l'un des sujets de la prise en charge. Dans le cas de la Dysgénésie gonadique complète 46,XY, un utérus est présent (à la suite d'un taux insuffisant d'hormone anti-müllérienne) et parfois une grossesse est possible par don d'ovocyte[5].
Remove ads
Lacunes de connaissances
Les données disponibles concernent essentiellement de grands pays riches, les seuls où des études statistiquement représentatives ont été faites. Mais si les pesticides et certains plastifiants ou certains toxiques (mercure par exemple) comptent bien parmi les premières causes du SDT, il est possible et probable que le problème existe ou se développe aussi dans les pays pauvres ou en développement qui utilisent de plus en plus de pesticides et de produits chimiques parfois interdits dans les pays dits « développés ». Certains auteurs (dont Skakkebæk) estiment qu'il pourrait y avoir des mécanismes communs (perturbations hormonales) avec un autre syndrome émergent : le syndrome métabolique (les mêmes substances peuvent contribuer au développement du syndrome métabolique en perturbant le métabolisme des glucides et des lipides). Le syndrome métabolique est caractérisé par un tour de taille important (dû à un excès de tissu adipeux abdominal), une hypertension, une glycémie à jeun anormale et/ou une résistance à l'insuline et une dyslipidémie).
Remove ads
Le monde animal, aussi touché
Résumé
Contexte
Skakkebæk et Sharpe ont rapidement noté des similitudes entre le type de malformations (macroscopiques et microscopiques, au niveau cellulaire) et d'anomalies fonctionnelles de l'appareil reproducteur observée chez l'animal (de laboratoire, mais aussi chez certains animaux sauvages exposés à des pesticides, dont l'ours blanc, les caïmans ou certaines tortues qui ont été étudiés de ce point de vue) et une exposition maternelle (in utero ou in ovo) à des produits chimiques imitant les œstrogènes, et spécialement à des anti-androgènes.
D'autres études (sur le modèle animal, rat de laboratoire en général) ont montré que l'exposition à un cocktail de produits dont chacun pris individuellement est inoculé à une dose très inférieure à son seuil d'efficacité ou de toxicité, a un impact parfois très significatif.
Différents animaux, à un même niveau d'exposition ne développent pas les mêmes symptômes, voire ne présentent aucune anomalie apparente. Ceci laisse supposer certaines vulnérabilités et prédispositions génétiques.
Les PE pourraient être une des causes de disparition de nombreuses espèces animales, mais hormis pour quelques espèces-phare, où ils semblent effectivement un des facteurs de recul ou d'extinction, peu d'études sont disponibles.
Remove ads
Voir aussi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
