Silicate
De Wikipédia, l'encyclopédie libre
Un silicate est un sel combinant le dioxyde de silicium SiO2 à d'autres oxydes métalliques. Les minéraux ayant une composition de silicate sont également qualifiés de silicates et constituent une famille de minéraux extrêmement importante. En minéralogie, les polymorphes de la silice sont classés parmi les silicates.

Les silicates constituent 97 % pds de la croûte terrestre, et plus de 90 % pds de la lithosphère. Il en existe de nombreuses familles :
- silicates ferromagnésiens (chlorites, serpentines, amphiboles, pyroxènes, péridots ou olivines, grenats) ;
- aluminosilicates, dans lesquels l’aluminium remplace partiellement le silicium (feldspaths riches en silice, zéolites, micas) ;
- silicates d’alumine (tourmaline, grenats).
Structure des silicates
Résumé
Contexte



[SiO32−]n (chaîne)
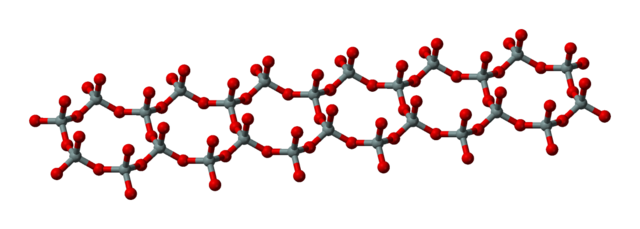

Les silicates sont des minéraux dont le squelette est essentiellement formé par des tétraèdres de silicium et d'oxygène (SiO4) additionnés d’aluminium, magnésium, fer, calcium, potassium, sodium et autres éléments. Dans quelques rares cas le silicium n'est pas tétraédrique (coordinence 4) mais octaédrique (coordinence 6) comme dans la stishovite SiO2 ou la thaumasite Ca3Si(OH)6(CO3)(SO4) • 12 H2O.
Structures de petites dimensions
Dans le cas le plus simple, celui des nésosilicates (orthosilicates), les tétraèdres sont présents dans la structure sous forme d'anions (SiO4)4−.
Les tétraèdres SiO4 peuvent mettre en commun un certain nombre d'atomes d'oxygène par les sommets[2] pour former d'autres structures également de petites dimensions.
On distingue ainsi les disilicates (sorosilicates) caractérisés par la présence de l'anion (Si2O7)6− et les cyclosilicates comportant des anions cycliques qui résultent de l'enchaînement de trois, quatre ou six groupes SiO3.
Les anions sont associés à des cations qui assurent la neutralité électrique de l'ensemble.
Structures polymères
Les tétraèdres SiO4 peuvent s'associer pour former des structures de taille très grande (structures polymères). Ces structures sont caractérisées par de longs enchaînements covalents -Si-O-Si-O-Si-O- qui peuvent être unidimensionnels ou former des réseaux bi- ou tri-dimensionnels.
Les structures polymères se présentent ainsi sous la forme de macro-anions à extension indéfinie, linéaires comme dans les pyroxènes, en chaînes doubles (rubans) dans les amphiboles, en feuillets dans les phyllosilicates, tridimensionnels dans les aluminosilicates tels que les feldspaths, ou sous la forme d'une structure macromoléculaire tridimensionnelle dans la silice qui peut être cristalline ou amorphe.
Ci-contre (et ci-dessous) les modèles moléculaires de macroanions et de la silice cristallisée (atomes Si en gris et O en rouge). Les formules des structures sont écrites selon la notation propre aux polymères :
- [ motif ]n : n (très grand) = nombre de motifs.
Les macroanions, comme les anions, sont associés à des cations qui assurent la neutralité électrique de l'ensemble.
Dans la macromolécule de silice cristallisée, le motif de répétition est un tétraèdre qui se répète dans les trois directions de l'espace. Les quatre atomes d'oxygène O aux sommets d'un tétraèdre SiO4 sont mis en commun avec d'autres tétraèdres SiO4. Un atome O est partagé entre deux tétraèdres, il compte donc pour 1⁄2 O dans un tétraèdre. Le motif de répétition s'écrit alors SiO4/2, soit SiO2[3]. La formule de la silice s'écrit donc [SiO2]n[4].
- Tétraèdre SiO4
- Structure d'une silice cristallisée (quartz β)
L'indice n est généralement omis dans l'écriture [SiO2]n, et la formule s'écrit simplement SiO2.
Remarque
Les formules des structures peuvent également être représentées avec la charge du macroanion et non celle du motif, par exemple [SiO3]n2n− au lieu de [SiO32−]n[5].
Formules des silicates polymères
Les macroanions s'associent à des cations minéraux pour former des polymères minéraux[6].
Les proportions des entités ioniques reflètent la neutralité électrique de la matière.
Exemples
Les macroanions linéaires [SiO32−]n s'associent à des cations tels que les ions Li+, Mg2+, Ca2+, Al3+, pour former des pyroxènes :
- avec les ions Mg2+ ils forment l'enstatite de formule [MgSiO3]n[6]
- avec les ions Ca2+ et Mg2+ ils forment le diopside de formule [CaMg(SiO3)2]n
- avec les ions Li+ et Al3+ ils forment le spodumène de formule [LiAl(SiO3)2]n
Ces formules sont généralement simplifiées en omettant l'indice n :
- MgSiO3
- CaMg(SiO3)2
- LiAl(SiO3)2[5].
Remarque
La disposition des tétraèdres dans un macroanion linéaire est alternativement d'un côté et de l'autre de la ligne médiane :
Si l'on tient compte de cette disposition, le motif de répétition associe maintenant deux tétraèdres consécutifs. Sa formule est [Si2O6]4− ([7]).
Les formules des polymères précédents deviennent :
En omettant l'indice n, les formules s'écrivent :
- Mg2Si2O6
- CaMgSi2O6
- LiAlSi2O6
Classification des silicates
Résumé
Contexte
Classification chimique
Les silicates peuvent être considérés comme des sels des acides siliciques. Ces sels associent un ou plusieurs cations métalliques à un oxanion du silicium. En fonction du rapport Si/O on distingue notamment :
- les orthosilicates (anion : SiO44−), sels de l'acide orthosilicique H4SiO4 ;
- les pyrosilicates (anion : Si2O76−), sels de l'acide pyrosilicique H6Si2O7 ;
- les métasilicates (anion : SiO32−), sels de l'acide métasilicique H2SiO3 ;
- les disilicates (anion : Si2O52−), sels de l'acide disilicique H2Si2O5.
La classification chimique recoupe partiellement la classification structurale. Notamment, les orthosilicates sont en général des nésosilicates, les métasilicates des inosilicates et les pyrosilicates des sorosilicates.
Classification minéralogique et structurale
Les géologues ont longtemps considéré les silicates du globe terrestre comme des sels d'acide silicique issus de la dissolution du dioxyde de silicium. Ils les envisagent désormais comme des édifices chimiques résultant de l'association d'oxygène et de silicium (voire d'aluminium dans le cas des aluminosilicates), formant des tétraèdres (Si, Al)O4 reliés entre eux soit par un ou plusieurs atomes d'oxygène, soit par des cations (ceux-ci, tels Mg, Fe, Al se trouvent aux centres d'octaèdres quasi réguliers)[8].
Les silicates peuvent être classés selon plusieurs critères, mais les deux classifications les plus employées en minéralogie sont basées sur l’enchaînement des tétraèdres :
- la classification topochimique (classification de Machatski-Bragg) est basée sur l’enchaînement des tétraèdres, dans lesquels le silicium et l’aluminium peuvent donner lieu à une substitution isomorphe ; les tétraèdres où seul l’aluminium est présent sont qualifiés d'hétéro-tétraèdres ;
- la classification topologique (classification de Zoltai) est basée sur l’enchaînement des tétraèdres centrés sur n’importe quel cation.
Les sous-catégories définies par ces deux critères sont les mêmes et, dans la plupart des cas, le résultat final est aussi le même. Toutefois, dans le cas d’aluminosilicates dont la structure comporte des tétraèdres centrés sur des cations autres que le silicium et l’aluminium, les deux classifications divergent.
Les principaux groupes de silicates sont :
- les nésosilicates (ou orthosilicates) : les tétraèdres n'ont aucun sommet commun, mais seulement avec d’autres polyèdres ; les anions appartiennent tous aux tétraèdres. Exemples : zircon, olivines, grenats ;
- nésosubsilicates : comme pour les nésosilicates, les tétraèdres n'ont pas de sommet commun, mais ici la structure comporte en plus des anions qui n’appartiennent pas à des tétraèdres. Exemples : disthène, andalousite, sillimanite, staurotide, topaze, titanite (sphène) ;
- les sorosilicates : deux tétraèdres partagent un sommet et forment un groupe [Si2O7]6−. Exemples : épidotes, mélilite, thortveitite, hémimorphite ;
- les cyclosilicates : la structure est composée d’anneaux isolés de 3, 4 ou 6 tétraèdres. Exemples : tourmaline, béryl, cordiérite, dioptase ;
- les inosilicates : les tétraèdres sont associés en chaînes ou en rubans. Exemples : pyroxènes, amphiboles, pyroxénoïdes, amphiboloïdes ;
- les phyllosilicates : les tétraèdres partagent trois sommets sur quatre et forment un feuillet bidimensionnel. Exemples : chlorites, micas, talc, pyrophyllite, serpentine, kaolinite ;
- les tectosilicates : les tétraèdres ont tous leurs sommets communs. Exemples : quartz, tridymite, cristobalite, feldspaths, feldspathoïdes, zéolites, scapolites.
Les principales différences entre la classification topochimique de Machatski-Bragg et celle topologique de Zoltai sont données dans le tableau suivant.
| Minéral | Formule | Classification topochimique (Machatski-Bragg) | Classification topologique (Zoltai) | Hétéro-tétraèdre(s) |
|---|---|---|---|---|
| Pétalite | [4]Li[4]Al[4]SiO4 | phyllo | tecto | Al, Li |
| α-eucryptite | [4]Li[4]Al[4]SiO4 | neso | tecto | Al, Li |
| Phénacite | [4]Be2[4]SiO4 | neso | tecto | Be |
| Willemite | [4]Zn2[4]SiO4 | neso | tecto | Zn |
| Béryl | [6]Al2[4]Be3[4]Si6O18 | cyclo | tecto | Be |
| Cordiérite | [6]Mg2[4]Al3[4](AlSi5)O18 | cyclo | tecto | Al |
| Hémimorphite | [4]Zn4[4]Si2O7(OH)2 • H2O | soro | tecto | Zn |
| Mélilite | [8]CaNa[4]Al[4]Si2O7 | soro | phyllo | Al |
| Sillimanite | [6]Al[4]Al[4]SiO5 | neso | soro | Al |
Les silicates en astronomie
Certaines étoiles entourées de matière circumstellaire « froide » — en deçà de la température de sublimation des silicates, aux alentours de 1 500 K — présentent des grains de poussière constitués de silicates. Leur présence est révélée par des raies spectrales larges caractéristiques des silicates, dans les bandes spectrales infrarouges N et Q, à 10 et 20 µm respectivement.
Le profil spectral de ces raies, qui dépend du type de silicate, de la géométrie des grains de poussière et de la présence additionnelle d’autres composés (exemple : la glace à moins de 300 K), donne des indications sur les conditions physico-chimiques des environnements étudiés.
La présence de silicates est fréquemment attestée autour des étoiles jeunes et des étoiles évoluées, notamment dans les disques d’accrétion et les enveloppes circumstellaires. En particulier, les silicates sont les principaux constituants des planètes telluriques du Système solaire : Vénus, la Terre, Mars et, dans une un peu moindre mesure, Mercure.
Importance biogéochimique et modélisations
Résumé
Contexte
On sait que le climat agit sur l'altération des roches, et qu'il existe aussi des boucles de rétroaction faisant que les composés d'altérations modifient le cycle du CO2 et du carbone dans l'océan, et par suite l'évolution du climat[9],[10].
Le lessivage des roches riches en silicates a considérablement augmenté en raison des pratiques humaines d'agriculture, de sylviculture et d'aménagement des sols, d'incendie/écobuage et plus généralement de transformation écologiques des paysages.
De même les phénomènes de pluies acides et d'acidification des eaux douces exacerbent localement la dissolution de roches et sols. Ces phénomènes contribuent à dégrader les sols en amont, mais ils contribuent aussi en aval à la formation de roches carbonatées dans les océans, et donc au transfert de CO2 de l'atmosphère à la lithosphère (« puits de carbone » dans ce cas). L'altération des roches contribue au cycle du carbone[11],[12],[13],[14],[10], dans le contexte du dérèglement climatique a justifié la production d'une cartographie planétaire lithologique (world lithological map) pour 6 grands types de roche par latitude, continents, et bassin de drainage océanique et pour 49 grands bassins fluviaux terrestres. Ce travail de cartographie a été couplé aux modèles disponibles sur le cycle du CO2 pour évaluer la quantité de CO2 atmosphérique consommé par les roches durant leur processus d'altération et pour évaluer l'alcalinité apportée par les cours d'eau à l'océan. On a montré que l'altération des roches a dans le passé considérablement varié selon les phases glaciaires et interglaciaires des paléoclimats[15]. Parmi les roches silicatés, les schistes (shales) et les basaltes[16] semblent jouer une grande influence sur la quantité de CO2 pompée par le processus d'altération du substratum rocheux[9].
Notes et références
Bibliographie
Voir aussi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.



