Polyarthrite rhumatoïde
maladie dégénérative inflammatoire chronique De Wikipédia, l'encyclopédie libre
La polyarthrite rhumatoïde (PR) est une maladie dégénérative inflammatoire chronique, caractérisée par une atteinte articulaire souvent bilatérale et symétrique, évoluant par poussées vers la déformation et la destruction des articulations atteintes.
Polyarthrite rhumatoïde
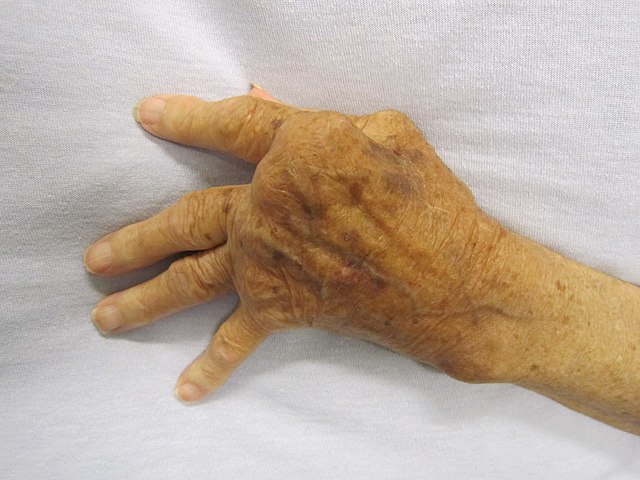
Main sévèrement affectée par la polyarthrite rhumatoïde. Ce niveau de déformation et de gonflement n'apparaît normalement pas avec les traitements actuels.
| Symptômes | Douleur musculo-squelettique secondaire chronique (d) |
|---|
| Médicament | Ibuprofène, chloroquine, valdecoxib, méthotrexate, flurbiprofène, pénicillamine, (RS)-kétoprofène, ciclosporine, oxaprozine, indométacine, diclofénac, (RS)-fénoprofène (en), sulindac, aurothioglucose, adalimumab, azathioprine, tolmetin (en), (RS)-etodolac (en), diflunisal, hydroxychloroquine, auranofin, naproxène, étanercept, piroxicam, thalidomide, sulfasalazine, célécoxib, nabumetone, anakinra, captopril, leflunomide, énalapril, or, acide acétylsalicylique, tolmetin (en), (RS)-etodolac (en), piroxicam, sulindac, frentizole (d), (RS)-fénoprofène (en), hydroxychloroquine, (RS)-kétoprofène, nabumetone, flurbiprofène et méthylprednisolone |
|---|---|
| Spécialité | Rhumatologie et immunologie |
| CISP-2 | L88 |
|---|---|
| CIM-10 | M05-M06 |
| CIM-9 | 714 |
| OMIM | 180300 |
| DiseasesDB | 11506 |
| MedlinePlus | 000431 |
| eMedicine |
331715 article/305417 article/401271 article/335186 |
| MeSH | D001172 |
| Patient UK | Rheumatoid-arthritis |
Le diagnostic peut en être malaisé en début d'évolution, faute de signe clinique spécifique et de constance des signes biologiques et à cause du retard d'apparition des érosions articulaires radiologiques ou de leur lente évolution.
La polyarthrite rhumatoïde est une maladie auto-immune qui semble avoir des origines parfois génétiques et parfois environnementales (ou les deux).
Son origine géographique et historique est discutée : elle n'est pas d'origine récente et elle parait présente dès l'Antiquité dans toutes les régions du monde, mais avec une fréquence et une gravité variables au cours de l'histoire
Synonymes
- Polyarthrite chronique évolutive (PCE) (F. Costes et J. Forestier, 1929), polyarthrite rhumatismale, arthrite rhumatoïde, arthrodynie (Cullen), goutte asthénique primitive (Landré-Beauvais), polyarthrite chronique déformante ou p. c. inflammatoire ou p. c. rhumatismale (De Sèze et Ryckewaert) ou p. c. symétrique progressive (Bezançon et M. P. Weil), rhumatisme chronique déformant (Teissier et Roque) ou rh. ch. progressif généralisé ou rh. ch. progressif infectieux (Weissenbach et Françon) ou rh. articulaire chronique progressif (Charcot, 1853)
- En anglais : rheumatoid arthritis
Histoire
Résumé
Contexte
Reconnaissance clinique et dénominations
La multitude des synonymes historiques illustre le chaos et la confusion du statut de la polyarthrite rhumatoïde (PR), au cours du temps, dans l'ensemble des maladies articulaires[1].
La première description moderne de PR, isolant une entité spécifique, est celle du français Augustin Jacob Landré-Beauvais (1772-1840). Dans sa thèse de médecine (Paris, 3 août 1800), il présente une série de neuf cas, tous féminins, d'une nouvelle forme de goutte qu'il appelle « goutte asthénique primitive ». Le cas n°8 fait l'objet d'une autopsie (étude anatomo-pathologique des articulations atteintes). La précision clinique, corroborée avec l'examen pathologique, font qu'il est unanimement reconnu que Landré-Beauvais a bien décrit une maladie finalement appelée polyarthrite rhumatoïde[2],[3].
D'autres avant lui (comme Thomas Sydenham en 1676 et William Heberden en 1770) avaient décrit des maladies similaires qui pourraient représenter différentes formes de PR, mais sans dépasser le stade du plausible d'un point de vue moderne[1],[3].
La thèse de Landré-Beauvais n'est pas immédiatement reconnue, que ce soit en France ou dans les autres pays[2].
France
En 1813, Auguste François Chomel parle de « goutte rhumatismale » pour désigner des rhumatismes chroniques autres que la goutte[2].
En 1853, Jean Martin Charcot distingue la goutte asthénique primitive de Landré-Beauvais des autres « rhumatismes articulaires chroniques », mais plus tard, par souci d'unicité, dans ses conférences à la Salpêtrière entre 1882 et 1889, il la maintient dans la même classe (avec les arthroses). Il la renomme « rhumatisme articulaire chronique progressif », dénomination officielle de la PR en France jusqu'en 1931[2].
En 1931, Jacques Forestier (avec Florent Coste[4] et Jean Lacapère[5]) ose secouer l'autorité de Charcot par la dénomination « polyarthrite chronique évolutive » (PCE) pour la détacher plus nettement des autres rhumatismes. Ce terme est utilisé par les rhumatologues français jusque vers la fin des années 1960[2].
À partir des années 1970, les Français se plient aux règles internationales qui, depuis 1957, proposent le terme de « rheumatoïd arthritis », en adoptant progressivement l'expression « polyarthrite rhumatoïde »[2].
Autres pays
En 1858, l'anglais Sir Alfred Baring Garrod (en) (1819-1907) constate le grand nombre de synonymes en français, anglais, allemand et latin pour une maladie qui n'est ni la goutte, ni un rhumatisme chronique. Il propose le terme de rheumatoïd arthritis : « Par cette expression, je souhaiterais impliquer une condition inflammatoire des articulations, non pas différente du rhumatisme en quelques uns de ses caractères, mais différent de lui matériellement ». Le souhait de Garrod ne se réalisera qu'un siècle plus tard[1],[2].
Aux États-Unis, au Royaume-Uni et en Allemagne, de nombreux auteurs créent de nouvelles dénominations et systèmes de classifications (sans lendemain) jusqu'au milieu du XXe siècle[1],[2].
En 1922, le ministère britannique de la santé adopte le terme officiel de « rheumatoïd arthritis », aux États-Unis les rhumatologues américains font de même en 1941. La Ligue Internationale contre le Rhumatisme[6] entérine cette dénomination en 1957[1],[3].
La polyarthrite rhumatoïde avant le XIXe siècle
D'un point de vue historique, il existe une grande diversité d'opinions et de théories sur l'origine de la PR et sa présence dans l'histoire. Ces incertitudes sont liées au fait que les causes de la maladie sont mal comprises et au caractère changeant des critères du diagnostic selon les avancées biotechnologiques[3].
Hypothèses
Pour les auteurs du XIXe siècle (Alfred Garrod, Jean-Martin Charcot…), il s'agissait d'une maladie nouvelle, d'apparition récente. Leurs arguments étaient la quasi-absence de description dans la littérature médicale avant 1800, une maladie d'abord rare au début mais qui devient commune au cours de leur siècle. Pour les auteurs plus modernes, on pourrait y voir une influence de facteurs environnementaux (révolution industrielle), une meilleure prise en charge hospitalière des malades chroniques, l'augmentation de la durée de vie (la maladie apparaissant surtout avec l'âge)[7],[8].
Des auteurs du XXe siècle défendent l'hypothèse d'une origine américaine de la PR, à l'instar de la syphilis. Leurs arguments sont l'absence de la maladie sur les squelettes européens d'avant le XVIIIe siècle, et sa grande fréquence dans les nécropoles précolombiennes. L'origine géographique et historique de la PR se situerait dans une zone centrée sur l'Alabama, de l'antiquité précolombienne, où elle serait restée longtemps localisée, avant de diffuser mondialement à partir du XVIIIe siècle, la PR étant attribuée à un agent pathogène encore inconnu[7],[9].
Il existe une théorie selon laquelle la PR aurait évolué à partir de la spondylarthrite ankylosante qui serait sa forme ancestrale (cette maladie étant présente naturellement chez les primates)[10],[11]. Les arguments sont la grande fréquence de la spondylarthrite ankylosante en paléopathologie, mais cette théorie a été invalidée par des études génétiques à partir des années 1970[9],[12].
Au début du XXIe siècle, l'hypothèse la plus retenue est que la PR n'est pas une maladie d'origine récente, et qu'elle était présente dès l'antiquité dans toutes les régions du monde, mais avec une distribution géographique différente de celle des temps modernes. Sa fréquence et sa gravité, dans des populations génétiquement prédisposées, se modifient au cours de l'histoire en fonction de facteurs environnementaux (alimentation, allergènes, agents infectieux, tabagisme…)[7],[9].
Ces discussions s'appuient sur trois catégories de données : les textes médicaux ou littéraires susceptibles d'avoir décrit la maladie, les représentations picturales de mains déformées, et les données paléopathologiques (études de momies et squelettes).
Littérature
Il n'existe pas de description convaincante de PR avant le XVIIIe siècle. Les mentions plausibles les plus anciennes se trouveraient en Asie dans le Charaka Samhita datant du début de l'ère chrétienne et en Occident chez Scribonius Largus au Ier siècle apr. J.-C.[7],[9].
L'empereur byzantin Constantin IX (1000-1055) serait le premier cas de personnalité historique atteinte de la maladie, décrite par le chroniqueur Michel Psellos dans sa Chronographia : une maladie qui dura douze ans, douleurs articulaires avec déformations progressives des mains et des pieds et handicap croissant, jusqu'à sa mort[13],[14].

Au XIIIe siècle, dans de proprietatibus rerum de Barthélémy l'Anglais, on trouve une description de plusieurs maladies articulaires, dont l'une pourrait évoquer une PR[3] ; de même au XVIe siècle dans Summa y Recopilación de Cirugía de Alonso López de Hinojosos (es), les auteurs de cette période ne mentionnent pas l'apparition d'une nouvelle maladie articulaire[7].
Toutes ces mentions sont des cas possibles, mais faute d'informations modernes (critères biologiques et sérologiques), on ne peut pas exclure d'autres maladies comme la goutte ou une autre maladie articulaire déformante par érosion osseuse[3].
Peinture
Des auteurs ont proposé qu'il y aurait des représentations de PR (mains déformées) dans des œuvres de l'école flamande (1400-1700). Par exemple, chez Jan Gossaert (portraits des donateurs), chez Jacob Jordaens (La Famille du peintre), ou chez Rubens : Les trois Grâces (celle de gauche) et son dernier autoportrait (vers 1639)[9],[15],[16].
Pour les rhumatologues qui font ces diagnostics « on ne voit pas ce qu'on ne connait pas, mais on reconnait ce qu'on voit en pratique quotidienne »[16]. D'autres se montrent plus réservés, en tenant compte de l'histoire de l'art où la peinture ne relève pas tant d'un réalisme que d'un maniérisme où chaque artiste manifeste son choix stylistique personnel[9],[15].
Paléopathologie
Les études paléopathologiques suggérant un diagnostic de PR sont rares (autour de la quinzaine). Cela tient au fait que les os des mains et des pieds sont souvent manquants car ils se conservent moins bien que les os longs, d'autant plus qu'un des critères de PR est la symétrie des lésions (côté droit et gauche du corps). Les évaluations doivent être faites de façon collaborative entre anthropologues qui savent distinguer une « pseudopathologie » (lésions par environnement post-mortem, comme la pression mécanique ou l'action chimique du sol) et rhumatologues (qui évaluent le caractère plus ou moins plausible de PR). Une approche unilatérale peut être défectueuse[3],[7].

C'est particulièrement le cas des premières publications (fin XIXe siècle et début XXe siècle) décrivant des PR possibles chez des momies égyptiennes à partir de 1897[3], mais qui depuis, sont jugées peu fiables. Dans la deuxième moitié du XXe siècle anthropologues et rhumatologues cherchent à s'accorder sur des critères communs sans toujours y parvenir (là où les uns disent « polyarthrite rhumatoïde », d'autres disent « maladie articulaire érosive, compatible avec une PR »). En Europe, on compte au moins cinq cas de PR possible d'avant 1492 au Royaume-Uni et en France (époque romaine et médiévale)[7],[9]
En Sicile, un cas daté de 300 av.J.C est considéré par l'auteur comme un cas intermédiaire appuyant la théorie de l'évolution de la PR à partir de la spondylarthrite ankylosante[17], ce qui a été vivement critiqué[11].
Aux États-Unis, des centaines de squelettes (datés de 6500 à 450 av.J.C) de la vallée du Tennessee, étudiés par Bruce M. Rothschild, présentent des caractères de PR. Au Mexique, une série de 21 cas possibles a été retrouvée dans les collections de squelettes précolombiens du Musée national d'anthropologie de Mexico[7].
En 2024, le ministère égyptien du tourisme et des antiquités révèle la découverte, dans une sépulture du site d'Assouan, d'un squelette de jeune femme présentant une polyarthrite rhumatoïde, prouvant ainsi l'existence de cette maladie en Égypte antique[18].
Épidémiologie
Résumé
Contexte
La polyarthrite rhumatoïde est l'une des maladies auto-immunes les plus fréquentes, se présentant comme un rhumatisme inflammatoire de l'adulte[19].
Sa prévalence mondiale est de l'ordre de 0,5 à 1 % de la population[19]. Elle est variable suivant les pays, avec un taux moindre en Europe du Sud par rapport à l'Europe du Nord et une tendance à la diminution avec le temps[20] et une augmentation avec l'âge des patients. Aux États-Unis et en Europe du nord, la prévalence est de l'ordre de 40 pour cent mille personnes[21].
Elle peut être plus fréquente dans certaines populations, comme les amérindiens d'Amérique du nord[19].
En France, elle est située à 0,4 % de la population totale[22] (0,51 % chez les femmes et 0,09 % chez les hommes)[23].
Il existe une nette prédominance féminine avec 4 à 5 femmes pour 1 homme atteint en dessous de 50 ans, mais cette différence semble s'atténuer avec l'âge avec un sex-ratio de 2 au-delà de 60 à 70 ans[24]. Ce qui s'expliquerait en partie par une influence hormonale (œstrogènes)[19].
Le pic de fréquence se situe autour de la quarantaine ; cependant, la maladie peut débuter à tout âge, y compris chez l'enfant (cf. arthrites juvéniles idiopathiques) touchant principalement les filles vers l'âge de dix ans[25].
Il existe certains facteurs de risque environnementaux, en particulier le tabagisme et des agents infectieux (virus d'Epstein-Barr, rétrovirus, superantigènes bactériens, mycoplasmes, bactéries du microbiote…) mais il est improbable qu'un seul microorganisme soit causal pour tous les patients[19].
D'autres facteurs plus marginaux sont le surpoids[26], l'exposition à la poussière de silice[27](risque confirmé par l'ANSES en France en 2019[28]), un déficit en vitamine D et l'utilisation de contraceptifs oraux[19].
Des facteurs protecteurs, diminuant le risque, sont le régime méditerranéen, la consommation d'acides gras oméga-3, et la consommation d'alcool[19].
Physiopathologie
Résumé
Contexte
La PR est reconnue pour présenter un nombre anormal de lymphocytes T dans les articulations. Ces lymphocytes T :
- se différencient surtout en lymphocytes T CD4+ mémoire. Ceux-ci se différencient à leur tour en cellules Th1 qui produisent de l'IFN-γ qui activent des macrophages qui vont produire les cytokines TNF-a et IL-12 qui vont :
- stimuler les chondrocytes in situ, les encourageant à produire des enzymes protéolytiques dégradant le cartilage,
- stimuler les fibroblastes qui vont produire de la collagénase et de la cathepsine, qui vont dégrader la matrice articulaire,
- stimuler les ostéoclastes qui vont déminéraliser les os composant l'articulation ;
C'est une hypersensibilité de type IV.
- ne vont pas se différencier en cellules TH2-like, qui produisent la cytokine IL-4, connue pour réguler la quantité d'IFN-Y ;
- produisent le ligand CD40 (CD40L) qui favorise la prolifération de lymphocytes B qui vont produire le facteur rhumatoïde un anticorps anti-IgG et l'immunoglobuline polyclonale. Ces deux molécules vont se lier pour former des complexes immuns qui vont :
- activer le complément, ce qui va attirer des neutrophiles et entraîner la production de dérivés réactifs de l'oxygène,
- produire les opsonines C3a et C5a qui vont exacerber le processus inflammatoire.
C'est une hypersensibilité de type III.
Les mécanismes immunologiques effecteurs sont multiples :
- stimulation des lymphocytes T CD4+ ;
- stimulation des lymphocytes B et différenciation en plasmocytes, responsables entre autres de sécrétion de facteurs rhumatoïdes et autres auto-anticorps ;
- sécrétion de cytokines pro-inflammatoires intra-articulaire, principalement le TNFalpha, à l'origine des synovites et des érosions articulaires.
La recherche permet de progressivement comprendre quels sont les facteurs qui permettent à une réponse immunitaire anormale, une fois initiée, de devenir chronique.
Des facteurs rhumatoïdes peuvent entrainer un syndrome d'hyperviscosité du sang[29],[30],[31].
Causes
Résumé
Contexte
Elles restent mal comprises.
Mais, outre des facteurs génétiques (voir plus bas) et le tabagisme[32] ; certains facteurs environnementaux (inflammatoires et citrullinant du poumon) semblent clairement en cause, même si leurs mécanismes précis d'action sont à éclaircir.
D'autres pathologies (allergiques, respiratoires et cardiovasculaires notamment) peuvent être induites ou aggravées par des particules issues de la pollution routière, urbaine et industrielle. Des maladies auto-immunes en font partie et la polyarthrite rhumatoïde notamment[33].
La pollution (et en particulier la pollution de l'air) expliquerait une incidence augmentée de la maladie dans les zones urbaines et/ou industrielles et quand le lieu de vie du patient est proche d'un lieu connu d’émission de polluants atmosphériques[33]. L'inhalation de poussières siliceuses fines en est une cause avérée[28].
Ces malades produisent en effet des anti-CCP (anti-peptides cycliques citrullinés) et l'on constate que l'exposition à la pollution de l'air (cocktail de polluants) fait produire des anticorps considérés comme spécifiques de la PR ; l'histologie met en évidence des liens entre PM, citrullination, et polyarthrite rhumatoïde via les structures lymphoïdes bronchiques tertiaires (dites iBALT, typiques des maladies pulmonaires inflammatoires, retrouvées dans les bronches (iBALT) des patients, et dont on sait que des particules issues des moteurs diesel stimulent leur formation). Aux échelles cellulaires, il existe des liens entre PM, polarisation T et PR via l’Aryl Hydrocarbon Receptor (AhR)[33].
L'organisme y répond parfois en générant des structures lymphoïdes. Ces dernières pourraient induire une transition vers une immunité plus spécifique en générant des anticorps antipeptides citrullinés. Une immunité innée fait alors apparaître dans les cellules des cytokines pro-inflammatoires et des espèces réactives de l’oxygène [ROS]. Une immunité adaptative apparait parallèlement.
Si, à l’échelle moléculaire, la pollution induit une immunité innée (avec augmentation des cytokines pro-inflammatoires et des espèces réactives de l'oxygène [ROS]), elle agit aussi sur l’immunité adaptative. Dans un modèle murin d’arthrite induit par une immunisation contre le collagène, une mutation privant les lymphocytes de ce récepteur protège l'animal de la forme sévère de la maladie[33].
En 2018, on n'a pas cependant encore pu établir de liens épidémiologiques certains avec un ou plusieurs polluants spécifiques ou type de particule[33].
La pollution urbaine et routière de l'air, en entretenant un environnement inflammatoire et « citrulliné » pour le poumon, semblent souvent en cause[33].
Le rôle de la flore intestinale, et plus précisément de ses dysbioses est de plus en plus considéré avec intérêt par de nombreux chercheurs. Via l'augmentation des taux de zonuline, il s'ensuit une hyper-perméabilité de la muqueuse intestinale, par lâchage des jonctions serrées (ou zonula occludens, tight junction en anglais). Des macro-molécules d'aliments non encore digérés, des toxines bactériennes et des bactéries entières peuvent s'infiltrer entre les entérocytes et atteindre ainsi le système immunitaire sous-jacent (GALT pour gut associated lymphoid tissue), les vaisseaux lymphatiques ou la circulation sanguine. On comprend aisément qu'il en découle des phénomènes de dys-immunité, d'inflammation, voire de maladie auto-immune.
Facteurs génétiques
Leur part dépasse vraisemblablement les 50 % lorsqu'on ne tient pas compte de l'alimentation[34].
Les arguments en faveur d'une prédisposition génétique sont l'agrégation familiale de cas de polyarthrite rhumatoïde et la présence simultanées des allèles HLA DR1 et DR4 (chez 93 % des individus atteints de la polyarthrite rhumatoïde).
Une mutation du gène PTPN22 (qui code une tyrosine phosphatase) double le risque de développer la maladie qui est aussi alors parfois plus grave[35].
Une mutation du gène TRAF1–C5 du chromosome 9 est aussi corrélée avec une forme aggravée de la polyarthrite rhumatoïde (avec présence d'anticorps anti-CCP : cyclic citrullinated peptide)[36].
L'association génétique HLA-DR4, les associations nouvellement découvertes avec le gène PTPN22 et avec deux gènes supplémentaires[37] impliquent une modification des seuils de régulation de la réponse immunitaire adaptative.
Facteurs alimentaires
Même si la cause n'est pas directement alimentaire, des phénomènes de régulation épigénétique et liés à l'activité du microbiote intestinal peuvent diminuer ou aggraver les rhumatismes inflammatoires chroniques[38]. Ceci expliquerait les bénéfices ressentis par certains patients face à certains régimes alimentaires. Le rôle d'une alimentation pauvre en fibres et autres prébiotiques, mais enrichie en édulcorants, conservateurs et autres additifs alimentaires, voire en pesticides ou antibiotiques est source de dysbiose intestinale. À cette dernière est associée, entre autres, une augmentation de la production de zonuline. Les excès d'alcool et de gluten, tout comme la cigarette d'ailleurs participent à cet accroissement de zonuline, que l'on peut aisément doser au niveau sanguin ou des selles.
Facteurs hormonaux
Des études récentes montrent que comme les facteurs environnementaux, ils peuvent interagir avec les facteurs génétiques[39] ; c'est le cas notamment de variations d'hormones sexuelles, notamment les œstrogènes, (éventuellement induites par des perturbateurs endocriniens) qui semblent expliquer la fréquence plus élevée de la PR chez les femmes ménopausées, un déclenchement après un accouchement et une (légère) modulation du risque de maladie par des médicaments hormonaux. On ne connaît cependant pas encore les seuils à partir desquels serait déclenchée une réponse auto-immune spécifique et anormale.
Des mécanismes de rétroaction négatives maintenant normalement la tolérance immunitaire semblent pouvoir être dépassés par des mécanismes de rétroaction positive aberrants liés à certains antigènes tels que le Fc des IgG (lié par RF) et fibrinogène citrulliné (lié par l'APAC) (voir l'article sur l'auto-immunité).
Une fois la réponse immunitaire anormale lancée (avec des symptômes pouvant ne devenir visibles qu'après plusieurs années), des cellules plasmatiques dérivées de lymphocytes B produisent des quantités anormalement élevées de facteurs rhumatoïdes et d'anticorps anti-peptides cycliques citrullinés (anti-CCP) de classes IgG et IgM. Ces derniers ne sont pas déposés comme ils le seraient dans un lupus systémique ; ils activent plutôt les macrophages par le récepteur Fc et le site de fixation du complètent qui semble jouer un rôle important dans la forte réponse inflammatoire qui caractérise la polyarthrite rhumatoïde[40]. Ceci contribue à l'inflammation de la membrane synoviale avec des phénomènes d'œdème, de vasodilatation et d'infiltration par des lymphocytes T activés (principalement des cellules CD4 dans les agrégats nodulaires et des cellules CD8 dans des infiltrats diffus).
De plus, les macrophages synoviaux et les cellules dendritiques fonctionnent comme des cellules présentatrices d'antigènes (CPA), en exprimant des molécules du Complexe majeur d'histocompatibilité de classe II (CMH de classe II), ce qui conduit à une réaction immune locale contre le tissu concernée ; La maladie progresse alors de concert avec la formation du tissu de granulation en bordure de la membrane synoviale (pannus) [réf. nécessaire] avec une angiogenèse et une production d'enzymes attaquant (lyse) les tissus. Les médications modernes de la polyarthrite rhumatoïde ciblent ces médiateurs.
Une fois la réaction inflammatoire établie, la synoviale s'épaissit, le cartilage et l'os sous-jacent commencent à se désintégrer et les signes de destruction articulaire apparaissent clairement.
Signes cliniques à la phase débutante
Résumé
Contexte
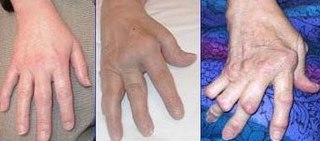
La maladie débute généralement par une polyarthrite aiguë, c'est-à-dire l'inflammation de quatre articulations ou plus, caractérisée par des douleurs d'horaire inflammatoire (réveils nocturnes, dérouillage matinal de durée supérieure à 30 minutes), une raideur articulaire et un gonflement appelé synovite.
Il existe peu de signes spécifiques pour différencier la polyarthrite rhumatoïde des autres causes de polyarthrite (cf. diagnostics différentiels). Cependant, certaines caractéristiques cliniques sont évocatrices :
- l'évolution progressive et insidieuse : subaiguë, c'est-à-dire évoluant depuis plus de 2 semaines, ou surtout chronique évoluant depuis plus de 3 mois ;
- le siège des synovites aux petites articulations : poignets et chevilles et surtout mains et pieds au niveau des interphalangiennes proximales (ou IPP, entre 1re et 2e phalanges) et articulations métacarpo-phalangiennes (ou MCP, entre le métacarpien et la 1re phalange). Toutes les articulations peuvent cependant être atteintes en cours d'évolution : genoux, coudes, épaules, hanches, articulations temporo-mandibulaires, etc. En revanche, les interphalangiennes distales (entre les 2e et 3e phalanges) et les sacro-iliaques sont toujours respectées. Le rachis est également épargné, à l'exception du rachis cervical ;
- la topographie en général bilatérale et symétrique ;
- l'intensité des signes inflammatoires locaux : tuméfaction chaude et douloureuse donnant l'aspect classique de « doigts en fuseaux » ;
- la coexistence de ténosynovites (inflammation des tendons musculaires) ;
- l'association possible à des nodosités cutanées appelées « nodules rhumatoïdes ». Localisés sur la face d'extension des coudes des doigts ou sur le tendon d'Achille, ils sont très spécifiques de la polyarthrite rhumatoïde mais inconstants et tardifs.
Examens biologiques
Résumé
Contexte
Un syndrome inflammatoire est généralement associé aux poussées de la maladie, se traduisant par une augmentation de la vitesse de sédimentation et de la protéine C réactive.
Il peut s'accompagner d'une hyperleucocytose à prédominance de polynucléaires neutrophiles et d'une anémie inflammatoire non spécifiques.
Les examens immunologiques dans le sérum peuvent trouver :
- un facteur rhumatoïde, détecté par méthode ELISA ou par néphélométrie, il était anciennement détecté par des réactions Waaler et Rose (hémagglutination sur du latex), maintenant obsolète. Le facteur rhumatoïde est une immunoglobuline (d'isotype M, G ou A) dirigée contre le fragment constant d'une autre immunoglobuline d'isotype G. Test sensible puisque présent dans 80 % des polyarthrites rhumatoïdes, le dosage du facteur rhumatoïde présente l'inconvénient d'une faible spécificité (environ 50 %) avec une fréquente positivité dans un grand nombre d'autres maladies. Ce test n'a pas valeur de diagnostic car environ 20 % des PR restent négatives, elles sont d'ailleurs dites polyarthrites séronégatives ;
- des anticorps anti-CCP (cyclic citrullinated peptide) : présents dans seulement environ 60 % des cas mais très spécifiques de la maladie (environ 95 %)[41]. Il est d'ailleurs possible que les polyarthrites rhumatoïdes ne comportant pas ce type d'anticorps soient une forme différente de la maladie, le tabagisme, par exemple, influençant négativement les porteurs et restant sans effet chez les non-porteurs[42] ;
- rarement, des anticorps antinucléaires à faible taux (30 %).
La ponction articulaire retrouve plus de 1 000 leucocytes par millimètre cube, confirmant le caractère inflammatoire de l'épanchement. Elle n'a cependant pas d'intérêt pour le diagnostic, sauf en cas de doute sur une polyarthrite de cause infectieuse (recherche de germe dans le liquide articulaire) ou microcristalline (recherche de cristaux d'urate de sodium dans la goutte, de pyrophosphate de calcium dans la chondrocalcinose).
Examens radiologiques
Résumé
Contexte
Le bilan radiographique initial minimal comporte des clichés des mains/poignets et des avant-pieds de face et de trois-quarts, des clichés de l'ensemble des articulations douloureuses et une radiographie pulmonaire.
Au cours de l'évolution, la surveillance des destructions doit comporter un bilan radiographique tous les six mois pendant les deux premières années, puis tous les ans à tous les deux ans. Un cliché dynamique du rachis cervical en flexion forcée doit être réalisé régulièrement afin de dépister les complications cervicales de la maladie.
Les signes radiologiques :
- sont discrets au début : déminéralisations osseuses périarticulaires, se traduisant par une hypertransparence osseuse autour des articulations, signe non spécifique présent dans l'ensemble des rhumatismes inflammatoires. Il existe un épaississement des parties molles périarticulaires ;
- plus tard apparaîtront les destructions articulaires caractéristiques de la polyarthrite rhumatoïde : pincement de l'interligne articulaire, microgéodes (sortes de « trous » dans l'os sous-chondral) et érosions osseuses. L'érosion de la tête du 5e métatarsien, visible sur une radiographie des avant-pieds, constitue classiquement la destruction articulaire la plus précoce et est d'un grand intérêt diagnostique ;
- l'aboutissement des lésions est la destruction articulaire complète correspondant aux déformations observées à l'examen au bout de plusieurs années d'évolution : subluxations des métacarpo-phalangiennes et des interphalangiennes, flessum des coudes et genoux, ankyloses notamment du carpe (=poignet), etc.
Évolution
Résumé
Contexte
Évolution articulaire
Le plus souvent, l'évolution, qui s'étale sur des dizaines d'années, se fait par poussées, entrecoupées de rémissions de rythme et de durée imprévisibles. Au cours des poussées, la plupart des articulations sont gonflées et douloureuses, associées à des signes généraux (fièvre modérée ou fébrilcule, asthénie) et fréquemment d'un syndrome inflammatoire biologique. Le suivi de l'activité de la maladie peut se faire à l'aide de différents scores. Le plus utilisé en pratique clinique est le « DAS 28 », calculé à partir de quatre paramètres : l'indice articulaire (nombre d 'articulations douloureuses - sauf pieds chevilles et hanches non comptabilisées), l'indice synovial (nombre d'articulations gonflées - sauf pieds chevilles et hanches), activité de la maladie évaluée sur une échelle de 0 à 100 par le patient, et vitesse de sédimentation et CRP.
Après plusieurs années d'évolution apparaissent les déformations caractéristiques, secondaires à la destruction articulaire et à l'atteinte tendineuse :
- aux poignets : subluxation antérieure de la main, subluxation postérieure de la tête cubitale « en touche de piano » pouvant conduire à la rupture du tendon extenseur du 5e doigt ;
- aux mains : déformations des doigts en maillet (flexion de l'interphalangienne distale), en col de cygne (flexion de l'interphalangienne distale et hyperextension de l'interphalangienne proximale), ou en boutonnière (hyperextension de l'interphalangienne distale et flexion de l'interphalangienne proximale) ; déformation du pouce en Z ; fréquent « coup de vent cubital » des doigts (déviation latérale des doigts) ; aspect des mains « en dos de chameau » (gonflement des rangées des métacarpo-phalangiennes et carpiennes et atrophie des muscles interosseux) ;
- aux coudes et genoux : flessum irréductible ;
- aux pieds : orteils « en marteau » ou en griffe, coup de vent péronier (déviation latérale des orteils), hallux valgus (déviation externe du 1er orteil) et quintus varus (déviation interne du 5e orteil) aboutissant à un avant-pied triangulaire, affaissement de la voûte plantaire ;
- enraidissement des hanches et des épaules ;
- sur le rachis cervical : atteinte tardive, comportant en particulier une possible subluxation atloïdo-axoidienne qui concerne les deux premières vertèbres et peut conduire à une compression de la moelle épinière cervicale en l'absence de traitement ;
- ruptures tendineuses compliquant l'évolution des ténosynovites.
Dans les polyarthrites très évoluées, les poussées inflammatoires ont tendance à devenir moins fréquentes. On assiste alors à l'extinction progressive de la maladie. À ce stade, les douleurs sont plus fréquemment d'horaire mécanique (prédominance le soir et aux mouvements, absence de dérouillage articulaire matinal) liées aux destructions articulaires. Comme les victimes de psoriasis ou de douleur chronique, le patient tend à devenir plus sensibles à la douleur (sensibilité mesurée par le test à l'eau froide), semble-t-il en raison d'une nociception renforcée par une « sensibilisation » à la douleur[43].
La polyarthrite rhumatoïde est une affection d'évolution et de gravité très hétérogènes. Le retentissement fonctionnel, socioprofessionnel, psychologique peut être considérable. Schématiquement on considère que 30 % sont d'évolution relativement bénigne, 50 % intermédiaires et 20 % sévères. La définition de la sévérité n'est cependant pas consensuelle actuellement.
Actuellement, on rattache la gravité d'une polyarthrite rhumatoïde à l'altération de la qualité de vie qu'elle entraîne, évaluée par le score HAQ (Health Assessment Questionnaire) et à l'importance des destructions articulaires.
Évolution extra-articulaire, comorbidité

MCOP = Maladie pulmonaire obstructive chronique ; AVC = Accident vasculaire cérébral).
D'autres atteintes portant sur des organes extra-articulaires sont possibles :
- signes généraux, exacerbés lors des poussées : altération de l'état général, fébricule, adénopathies superficielles ;
- nodules rhumatoïdes : nodosités sous-cutanées fermes mobiles et indolores présentes principalement sur les crêtes ulnaires et les faces dorsales des doigts ;
- poumons : pleurésie, nodules rhumatoïdes pulmonaires, rarement fibrose pulmonaire interstitielle. L'association avec une pneumoconiose définit le syndrome de Caplan-Colinet ;
- cœur : péricardite ;
- système nerveux périphérique ;
- œil : sclérite et épisclérite ;
- « syndrome sec » avec l'œil sec et bouche sèche (syndrome de Gougerot-Sjögren)
- syndrome de Felty, qui correspond à l'association d'une polyarthrite rhumatoïde, d'une splénomégalie et d'une leuconeutropénie. Une leucémie à LGL (large granular lymphocytes) peut se développer en parallèle, on parle alors de Pseudo-Felty ;
- infections ;
- cancer ;
- troubles gastro-intestinaux ;
- ostéoporose ;
- troubles psychiatriques[45].
La mortalité des patients atteints de polyarthrite rhumatoïde est significativement augmentée par rapport à celle de la population générale[46], avec une prévalence des comorbidités et de leurs facteurs de risque toujours importante mais variant beaucoup selon les pays[44], de même que le respect des recommandations pour la prévention et la gestion de ces comorbidités[44].
Le degré et la vitesse de progression de la maladie varient beaucoup selon le patient, et les réponses individuelles aux traitements varient également beaucoup selon le patient[47].
En 2019, une étude publiée dans le réseau JAMA, a montré que l'intelligence artificielle peut — via des modèles d'apprentissage profond basés sur les données des dossiers de santé électroniques — prédire, avec une précision intéressante, l'évolution de la maladie[48].
Traitement
Résumé
Contexte
Une prise en charge spécialisée est nécessaire, une étude publiée en 2010 ayant, par ailleurs, démontré que la précocité de consultation — et de mise en œuvre du traitement — améliore l'issue de la maladie[49].
La stratégie thérapeutique comporte plusieurs volets.
Traitement symptomatique
Il permet le soulagement des symptômes. Il peut comporter le repos simple lors des poussées, les traitements antalgiques classiques, les anti-inflammatoires non stéroïdiens, les corticostéroïdes à faible dose, inférieure à 10 mg/jour pour en limiter les effets secondaires. Dans les poussées très inflammatoires polysynoviales, un ou plusieurs bolus peuvent être réalisés pour soulager rapidement le patient en attendant l'efficacité d'un nouveau traitement de fond.
Traitements de fond
Ils sont aussi appelés « DMARD » (disease modifying anti-rheumatic drugs[50]) visant à contrôler les manifestations inflammatoires cliniques de la maladie, et à freiner son évolution destructrice. Leur efficacité est en général retardée (un à trois mois), suspensive (reprise d'activité à l'arrêt), et malheureusement inconstante, et épuisable obligeant à changer de molécule. Ils doivent donc être constamment adaptés à l'activité inflammatoire et à la sévérité de la maladie. Leur emploi ont fait l'objet de recommandation, dont les plus récentes sont européennes, datant de 2010[51].
Principales molécules
Pratiquement abandonnés en raison d'une tolérance médiocre, ce sont les sels d'or et la D-pénicillamine.
Utilisé dans les polyarthrites peu actives et non érosives ou dans les polyarthrites inclassées, ce sont les antipaludéens de synthèse comme l'hydroxychloroquine (Plaquénil). Il possède une efficacité clinique mais ne prévient pas les destructions.
Le méthotrexate est utilisé en première intention à la dose de 10 à 20 mg/semaine, par voie orale, sous-cutanée ou intra-musculaire. Il semble au moins aussi efficace que les autres DMARD[52]. D'autres molécules sont également employées : léflunomide (Arava), sulfasalazine (Salazopyrine). L'association de ces molécules (en particulier, salazopyrine + méthotrexate +/- hydroxyplaquenil) pourrait en améliorer l'efficacité ; cependant, cette idée reste discutée.
Dans les formes sévères, certains immunosuppresseurs comme l'azathioprine (Imurel), la ciclosporine (Neoral, Sandimmum) peuvent être employés.
Réservées aux formes sévères d'emblée, ou en cas d'échec ou d'échappement aux traitements précédents sont les biothérapies :
- les anti-TNF alpha : l'infliximab (Remicade) en perfusions de 3 à 5 mg/kg toutes les 8 semaines, l'étanercept (Enbrel) en sous-cutanée, l'adalimumab (Humira), le golimumab (Simponi) en sous-cutanée. Leur efficacité clinique et radiologique est souvent spectaculaire, au prix d'effets secondaires de gravité variable, principalement infectieux (en particulier tuberculose mais aussi autres infections bactériennes et virus). L'initiation du traitement, de prescription hospitalière, comporte une recherche systématique de foyer infectieux et notamment d'une tuberculose latente. Ces molécules sont principalement associées à un autre traitement de fond[53] (méthotrexate, léflunomide, etc.) afin de prévenir l'apparition d'anticorps anti-antiTNFalpha, qui favoriseraient les résistances et les allergies au traitement, mais elles peuvent également être utilisées en monothérapie[54] ;
- un agoniste du CTLA4 : l'abatacept commercialisé sous le nom d'Orencia est approuvé en France, dans la prise en charge des polyarthrites réfractaires aux anti TNF, il s'administre sous forme de perfusions mensuelles à la dose de 8 mg/kg en une vingtaine de minutes, en association au méthotrexate ;
- les antagonistes du récepteur de l'interleukine-1 : anakinra (Kineret), peu utilisés en raison de sa fréquence d'injection journalière ;
- un anti-CD20, le rituximab (Mabthera), après échec des anti-TNF alpha, est également disponible, il est utilisé en association avec des perfusions de corticoïdes, deux perfusions à 15 jours d'intervalles, puis une perfusion tous les 6 mois, et a un effet de déplétion des lymphocytes B sur au moins six mois ;
- un inhibiteur du récepteur de l'interleukine-6 : le tocilizumab (RoActemra), approuvé en France en , indiqué dans les échecs au méthotrexate en perfusion intraveineuse toutes les 4 semaines, à la posologie de 8 mg/kg et donnant des résultats équivalents à l'adalimumab[55] ;
- en cours d'évaluation : le certolizumab pegol, d'autres anti CD-20 (ocrélizumab) et des inhibiteurs des MAP kinases.
Outre les molécules, les stratégies d'utilisations des traitements semblent également très importantes pour obtenir une rémission, plusieurs études comme TICORA, Fin RaCo, et BEST notamment suggèrent que l'utilisation précoces d'une combinaison de traitement de fond à bonne dose et tôt dans l'histoire de la maladie donnait plus de rémission, et permet plus souvent l'arrêt des anti-TNF, que dans les suites d'une initiation tardive. L'intensification thérapeutique peut permettre le maintien d'un résultat au score DAS 28 (à évaluer de façon régulière, soit chaque 3 mois) en dessous du seuil de 24, qui semble être un facteur prédictif important d'une rémission. La question de la durée du traitement par anti-TNF n'a pas de réponse claire et un traitement prolongée (plus d'un an) pourrait avoir un intérêt dans certaines formes[56].
Traitements locaux
Les infiltrations intra-articulaires de dérivés corticoïdes sont à visée symptomatique, dans le cas d'une ou de quelques articulations gonflées malgré une maladie peu active par ailleurs.
La synoviorthèse isotopique (injection intra-articulaire d'isotopes radioactifs) ou chimique (injection d'acide osmique), consistent en la destruction de la synoviale d'une articulation restant inflammatoire malgré les infiltrations de corticoïdes.
La chirurgie a certaines indications : synovectomie d'une petite articulation inflammatoire malgré les mesures précédentes, ténosynovectomie ; au stade tardif de destruction articulaire : correction d'une déformation invalidante ou douloureuse (arthrodèse du poignet ou de l'arrière pied…), ou arthroplastie qui concerne principalement les grosses articulations : hanches, genoux, épaules, plus rarement poignets et métacarpo-phalangiennes ; réparation d'une rupture tendineuse.
Rééducation et traitements non médicamenteux
La stratégie thérapeutique comprend une part non pharmacologique, et complète le traitement médicamenteux (et éventuellement chirurgical). Des recommandations internationales et parfois nationales existent (dont en France, via la Haute Autorité de santé[57]) pouvant associer :
- des techniques passives de masso-kinésithérapie[57] ;
- des techniques actives de masso-kinésithérapie[57] ;
- la balnéothérapie et le thermalisme[57] ;
- les orthèses[57] (par exemple les orthèses plantaires de répartition de charge réalisées par un podologue) ;
- la physiothérapie[57], qui permet de diminuer la douleur et l'inflammation lors des poussées inflammatoires ;
- l'ergothérapie[57] qui consiste en la confection d'attelles de repos (portées pendant la nuit) et d'orthèses qui s'opposent aux attitudes vicieuses et aux déformations articulaires. Elle permet l'aide à la réadaptation du patient dans son environnement habituel ;
- certains traitements spécifiques de la main et du poignet ou du pied[57] ;
- de la pédagogie sur la maladie (éducation thérapeutique) et ses conséquences socio-psychologiques, les comportements à adopter. Un rappel des règles d'hygiène de vie, l'éducation gestuelle et les exercices posturaux sont d'un appoint non négligeable[57] ;
- des aides psychodynamiques[57] ;
- d'autres traitements non médicamenteux reposant sur l'activité physique à dominante aérobie (visant à accroître la capacité d’effort et la fréquence cardiaque grâce à la bicyclette de rééducation, la marche sur tapis roulant, des exercices gymniques rapides ou certains exercices de balnéothérapie, ou via des activités de loisirs telles que danse douce, Tai-chi, yoga[57]... ;
- des conseils diététiques[57] ; des études ont démontré que des modifications diététiques (par exemple régime végétalien sans gluten) pouvaient apporter un bénéfice clinique pour certains patients atteints de polyarthrite rhumatoïde, et que ce bénéfice pouvait être lié à une réduction de l'immunoréactivité de certains antigènes alimentaires éliminés de fait par le changement de régime alimentaire[58]. De nombreux aliments préparés industriellement contiennent du gluten comme agent texturant. Les farines, pour être panifiables mécaniquement ou pour supporter une pré-cuisson, une surgélation et une conservation avant d'être enfin transformées en pains, viennoiseries, etc., sont artificiellement enrichies en gluten (non seulement par sélection génétique de blés plus riches en gluten, mais en outre par ajout de gluten supplémentaire). Cet excès de gluten stimule la production de Zonuline par les entérocytes, ce qui rend la muqueuse intestinale perméable à des macro-molécules alimentaires ou à des composants bactériens ;
- l'acupuncture[57], comme traitement adjuvant de la douleur chronique, mais son efficacité n'est pas spécifiquement démontrée dans le cadre de la polyarthrite rhumatoïde selon la HAS. Par contre, la stimulation au niveau auriculaire gauche de la branche du nerf vague permet une amélioration des fonctions digestives contribuant à soutenir le système immunitaire, dont plus de 60% se situe autour du tube digestif ;
- la réadaptation par des aménagements de l’environnement (familial, professionnel...) du patient via des aides techniques et/ou sociales qui font l'objet d'une réglementation et/ou de remboursement variant selon les pays et conditions[57] ;
- les activités physiques adaptées (APAS), avec une prise en charge visant à atténuer les symptômes par une amélioration de la composition corporelle, une amélioration de la tolérance à l'effort, des amplitudes articulaires, de la résistance osseuse, diminution de la comorbidité cardiovasculaire et par conséquent amélioration de la qualité de vie[59][source insuffisante] ;
- la stimulation électrique du nerf vague a été étudié par différentes études et a montré des résultats positifs significatifs, notamment une réduction importante du taux de TNF et des autres protéines inflammatoires[60]. Parmi les mécanismes sous-tendus par cette stimulation du nerf vague (principalement le nerf vague gauche qui innerve tout le tractus digestif sous-diaphragmatique, contrairement à sa branche droite) il y a augmentation des sécrétions digestives, diminution de la stase gastro-duodénale avec accélération de la vidange gastrique et du transit grêle, par effet pro-kinétique. La prolifération de bactéries au niveau du grêle diminuant à la suite de l'augmentation du péristaltisme, les fermentation alimentaires y diminuent et l'intégrité de la muqueuse intestinale est protégée. Cela explique que le système immunitaire sous-jacent ne soit plus sur-stimulé.
Les solutions et activités listées ci-dessus présentent des bénéfices plus ou moins nets ou durables selon le type de polyarthrite[57] ; elles doivent toujours être adaptées au patient.
Traitement non conventionnel
Des extraits d'une plante médicinale, Tripterygium wilfordii, pourraient avoir, dans certains cas, une efficacité au moins équivalente à celle de la sulfasalazine[61].
Autres mesures
L'information concernant la maladie, individuellement et au sein de groupes de patients, reste indispensable. Elle peut être associée à une orientation vers des associations de malades.
En France, les soins sont pris en charge à 100 % au titre de l'ALD 30 dans les formes sévères.
Diagnostic différentiel
| CLASSEMENT | PENSER D'ABORD À | PUIS À |
|---|---|---|
| Polyarthrites bactériennes | Septicémie endocardite infectieuse Gonocoque |
Brucellose Maladie de Lyme Tuberculose |
| Polyarthrites virales | Hépatite B et C Parvovirus B19 |
Oreillons, rubéole mononucléose infectieuse, cytomégalovirus (CMV) VIH |
| Polyarthrites « post-infectieuses » | Arthrites réactionnelles (post Chlamydiae, Shigella, Yersinia, Campylobacter…) | RAA (rhumatisme articulaire aigu) Rhumatisme post-streptococcique |
| Polyarthrites « métaboliques » | Goutte Chondrocalcinose |
Hémochromatose Maladie de Wilson |
| Rhumatismes inflammatoires | Polyarthrite rhumatoïde Spondylarthropathies périphériques (dont rhumatisme psoriasique) |
Rhumatisme palindromique Syndrome RS3PE Polyarthrite paranéoplasique |
| Maladies auto-immunes | Lupus systémique Syndrome de Gougerot-Sjögren |
Autres connectivites Vascularites Sarcoïdose |
Personnalités atteintes
Il s'agit de personnalités dont le diagnostic a été discuté (maladie probable) ou commenté (maladie avérée à partir du XXe siècle) :
- Constantin IX Monomaque (1000-1055) ;
- Pie II (1405-1464), déjà invalide au moment de son élection[62] ;
- Christophe Colomb (1551-1506), à partir de son troisième voyage transatlantique[62] ;
- Marie Stuart (1542-1587), à partir de son emprisonnement au Château de Loch Leven[62] ;
- Pierre Paul Rubens (1577-1640), à partir de 1606[63] ;
- James Madison (1751-1836), à la fin de son deuxième mandat[63] ;
- Auguste Renoir (1841-1919), à partir de 1901[63] ;
- Raoul Dufy (1877-1953), à partir de 1935. Selon Leca, Raoul Duffy serait mort des complications de son traitement « il n'est certes pas impossible que la corticothérapie y ait eu une part de responsabilité » (à l'époque, corticothérapie prolongée à forte dose)[63].
- Kathleen Turner, à partir du début des années 1990[64].
Notes et références
Voir aussi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.