Loading AI tools
type de leucocytes De Wikipédia, l'encyclopédie libre
Les granulocytes neutrophiles ou polynucléaires neutrophiles (PNN) (ou simplement « les neutrophiles ») sont des cellules sanguines . Ce sont des leucocytes ou globule blanc qui ont un rôle majeur dans le système immunitaire. Les neutrophiles constituent le type cellulaire le plus abondant dans le sang humain. Ils sont exclusivement produits dans la moelle osseuse en très grand nombre, environ 100 milliards par jour. Dans des conditions normales , après la fin d'un processus de formation qui dure environ 6 jours, les neutrophiles entrent dans la circulation, migrent vers les tissus, où ils remplissent leurs fonctions, et sont finalement éliminés par les macrophages, le tout en une journée. Les neutrophiles sont les premières cellules du système immunitaire à réagir[1]. Elles patrouillent constamment dans l’organisme à la recherche de signes d’infections microbiennes. En cas d'infection, ces cellules réagissent rapidement pour piéger et tuer les agents pathogènes envahisseurs. Trois fonctions antimicrobiennes principales sont reconnues aux neutrophiles : la phagocytose, la dégranulation et la libération de matière nucléaire sous forme de pièges extracellulaires à ADN (neutrophil extracellular traps ou NET). Ces fonctions étaient considérées, jusqu'à récemment, comme le seul objectif des neutrophiles. Cependant, les recherches actuelles montrent que les neutrophiles sont des cellules complexes transcriptionnellement actives[2] qui produisent des cytokines[2], modulent l'activité des cellules voisines et contribuent à la résolution de l’inflammation[3], régulent les macrophages pour les réponses immunitaires à long terme[4], participent activement à plusieurs maladies, dont le cancer (Tumor Associated Neutrophil ou TAN)[5], et jouent même un rôle dans le système immunitaire inné à mémoire[6].

Les neutrophiles font partie des cellules granulocytes ou « cellules polynucléaires ». On les appelle polynucléaires en raison d'une erreur historique : de par le caractère plurilobé de leur noyau (de deux à cinq lobes en général), on a longtemps cru que ces cellules possédaient plusieurs noyaux. Les autres granulocytes sont les granulocytes éosinophiles et basophiles. Le qualificatif de « neutrophile » vient aussi d'une caractéristique visible en microscopie optique : après ajout des colorants vitaux usuels (May-Grünwald Giemsa ou MGG), ces cellules restent neutres (elles fixent mal les colorants acides et basiques). Les neutrophiles représentent à eux seuls environ 65 % de l'ensemble des leucocytes du sang, et 99 % des granulocytes.
Le polynucléaire neutrophile est une cellule sphérique, possédant un noyau segmenté en plusieurs lobes qui réfléchit la lumière (à cause des nombreuses granulations). Il se déplace de manière adhérente sur la paroi d'autres cellules en projetant des extensions nommées lamellipodes.
Ce mode de déplacement est appelé amœboïde.
Les neutrophiles représentent environ 70 % de tous les leucocytes et plus de 100 milliards de cellules sont produites chaque jour dans la moelle osseuse[7]. De là, les neutrophiles pénètrent dans le sang où ils circulent jusqu’à ce qu’ils sortent dans les tissus. Les neutrophiles circulant dans le sang (le nombre dans la prise de sang) ne représentent que 2% des neutrophiles . Une fois que les neutrophiles atteignent la fin de leur durée de vie dans les tissus (moins de 24 heures), ils sont principalement éliminés par les macrophages grâce au processus de phagocytose[8]. Malgré ce renouvellement impressionnant, le nombre de neutrophiles en circulation reste relativement constant grâce à un équilibre délicat entre production et élimination (homéostasie des neutrophiles[9]).

Les neutrophiles sont produits dans la moelle osseuse à partir de cellules souches hématopoïétiques[10]. Ces cellules se différencient en cellules progénitrices multipotentes (multipotent progenitor ou MPP) qui ne peuvent pas s'auto-renouveler. Les cellules progénitrices multipotentes se transforment ensuite en progéniteurs multipotents à amorçage lymphoïde (lymphoid-primed multipotent progenitor ou LMPP), qui se différencient en progéniteurs granulocytes-monocytes ( granulocyte–monocyte progenitor ou GMP). Ces progéniteurs granulocytes-monocytes, sous le contrôle du facteur de stimulation des colonies de granulocytes ( granulocyte colony-stimulating factor ou G-CSF), s'engagent dans la génération de neutrophiles en se transformant en myéloblastes[11].
La lignée granulocytaire[12] se subdivise en trois types d'éléments, les neutrophiles, les éosinophiles et les basophiles. Les neutrophiles sont issus des CFU-GM (progéniteur des granulocytes et des monocytes). Lorsque la cellule souche se différencie en granulocyte, il devient un myéloblaste et mature en suivant les divers stades suivants, qui correspondent aux précurseurs :
Au cours de la différenciation, le neutrophile en développement change son noyau d'une forme ronde en une morphologie en bandes puis lobulée, ainsi que l'expression de divers récepteurs: L'intégrine α4β1 (VLA4), le récepteur de chimiokine CXCR4 , le CXCR2 et le récepteur de type Toll 4 (TLR4). Les cellules du stroma de la moelle osseuse expriment la molécule d'adhésion des cellules vasculaires 1 (VCAM1), un ligand de VLA4, et le facteur 1/SDF-1 dérivé du stroma de chimiokine (CXCL12), un ligand de CXCR4, afin de retenir les cellules progénitrices dans la moelle osseuse.
Les neutrophiles matures contiennent également des granules et des vésicules sécrétoires qui stockent des protéines spécifiques pertinentes pour leurs fonctions. Ces granules se forment à des étapes de différenciation particulières. Les granules primaires (azurophiles) se trouvent entre le stade myéloblaste et promyélocyte. Des granules secondaires (spécifiques) sont détectés aux stades myélocytaire et métamyélocytaire. Les granules tertiaires (gélatinase) se trouvent au stade des cellules en bande. Enfin, les vésicules sécrétoires ne sont détectées que dans les neutrophiles matures. Ces granules stockent un arsenal d'enzymes antimicrobiennes, notamment l'élastase, la myéloperoxydase, les cathélicidines, les défensines et les métalloprotéinases matricielles, qui sont utilisées pour détruire les agents pathogènes envahisseurs[13].
Une fois matures, les neutrophiles peuvent quitter la moelle osseuse et entrent dans la circulation sanguine. La libération de neutrophiles est étroitement contrôlée puisque seulement 1 ou 2 % de tous les neutrophiles présents dans l’organisme se trouvent dans le sang dans des conditions homéostatiques normales. Les neutrophiles matures sont conservés dans la moelle osseuse grâce à l'action de deux récepteurs de chimiokines, CXCR2 et CXCR4. Les ostéoblastes et autres cellules stromales de la moelle osseuse produisent du CXCL12 et maintiennent les neutrophiles exprimant CXCR4 dans la moelle osseuse. Le G-CSF (Granulocyte colony-stimulating factor) induit la sortie des neutrophiles de la moelle osseuse en interférant avec l'interaction CXCR4-CXCL12 [14]. Le G-CSF provoque la libération de neutrophiles en induisant une régulation positive des ligands CXCR2 sur les mégacaryocytes[15], une expression réduite de CXCL12 par les cellules du stroma de la moelle osseuse , et également une expression réduite de CXCR4 sur les neutrophiles eux-mêmes[16]. Les ligands de CXCR2, tels que CXCL1, CXCL2, CXCL5 et CXCL8 sont exprimés par les cellules endothéliales en dehors de la moelle osseuse lorsque les neutrophiles doivent être mobilisés dans le sang[15].
En dehors de la moelle osseuse, la production de neutrophiles est également régulée par un réseau de cytokines qui implique l'interleukine-23 produite par les cellules phagocytaires (macrophages et cellules dendritiques) et l'interleukine-17 produite par les lymphocytes T. Les macrophages et les cellules dendritiques phagocytent les neutrophiles apoptotiques entraînant une réduction de l'IL-23 qui contrôle l'expression de l'interleukine-17 produite par les lymphocytes T[17].
Les neutrophiles du sang peuvent être mobilisés vers des sites d'infection ou d'inflammation grâce au processus connu sous le nom de cascade d'adhésion leucocytaire . Les cellules endothéliales des vaisseaux sanguins proches du site affecté sont activées et expriment des récepteurs d'adhésion tels que les sélectines E et P. Ces récepteurs se lient aux ligands glycoprotéiques des neutrophiles, les faisant rouler sur l'endothélium. Ensuite, le neutrophile est activé par des chimiokines, qui induisent un état d’affinité élevée pour les intégrines β2. La liaison des intégrines à leurs ligands tels que la molécule d'adhésion intercellulaire-1 (ICAM-1) et ICAM-2 sur les cellules endothéliales provoque une adhésion ferme du neutrophile. Ensuite, les neutrophiles transmigrent dans les tissus périphériques[18]. Une fois que les neutrophiles sont dans les tissus périphériques, ils suivent des gradients de chimioattractants tels que le formyl-méthionyl-leucyl-phénylalanine (fMLF) et l'anaphylatoxine C5a pour atteindre leur cible[19].
Le nombre constant de neutrophiles dans la circulation est également contrôlé par des signaux centraux délivrés par le système nerveux sympathique. Dans ce cas, les nerfs adrénergiques induisent l'expression temporelle de molécules d'adhésion sur les cellules endothéliales, permettant aux neutrophiles de se lier à l'endothélium et de quitter la circulation. Cette régulation de la migration des neutrophiles dans les tissus suit un schéma circadien[20].
Une fois dans les tissus, les neutrophiles subissent l'apoptose et sont finalement éliminés par phagocytose par les macrophages résidents et les cellules dendritiques. Les neutrophiles sénescents dans le sang régulent positivement l'expression de CXCR4, ce qui leur permet de retourner dans la moelle osseuse pour leur destruction[21]. La clairance des neutrophiles apoptotiques est également importante pour contrôler la production de neutrophiles dans la moelle osseuse. La phagocytose des neutrophiles apoptotiques déclenche une réponse anti-inflammatoire caractérisée par une réduction de l'IL-23 par les macrophages. la réduction d'IL-23 entraîne une réduction des niveaux d'IL-17 et une moindre production de G-CSF, et finalement, par conséquent, une granulopoïèse réduite[22].
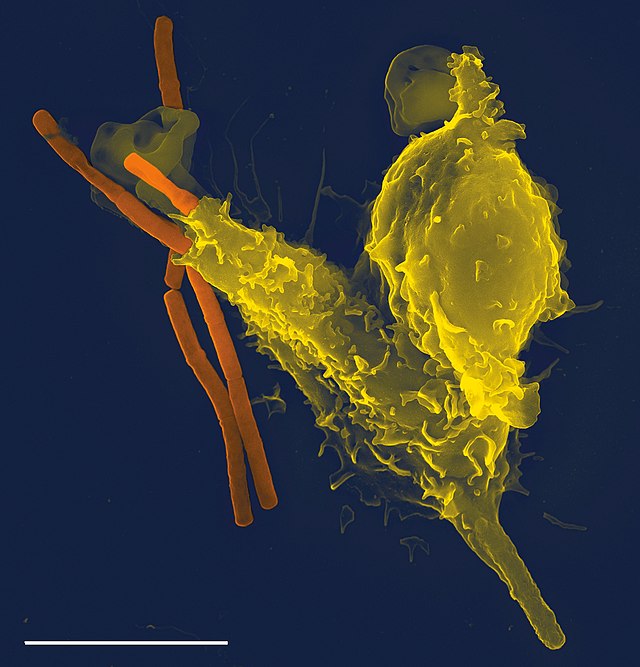
C'est la première cellule mobilisée par le système immunitaire en présence d'un agent pathogène.
Les granulocytes neutrophiles ont une capacité antimicrobienne supérieure à celle des macrophages[23],[24]. Les neutrophiles sont équipés d'un vaste assortiment de mécanismes microbicides et utilisent de multiples molécules antimicrobiennes stockées en quantités énormes dans des granules[25],[26]. La production de ROS est plus importante chez les neutrophiles que chez les macrophages[27]. Plusieurs protéines antimicrobiennes qui constituent une partie importante de l'arsenal des neutrophiles sont absentes ou rares dans les macrophages tissulaires[28],[29],[30],[31].
Les granules présents dans le cytoplasme des neutrophiles contiennent des substances toxiques permettant l'élimination des microorganismes extracellulaires comme les bactéries ou les champignons. Comme pour les macrophages, l'activation de l'explosion oxydative (oxidative burst) par les neutrophiles conduit à la production de radicaux libres de l'oxygène et la sécrétion de peroxyde d'hydrogène et d'hypochlorite. Les neutrophiles sont les phagocytes les plus nombreux, constituant 50 % à 60 % de l'ensemble des leucocytes circulants, et sont parmi les premières cellules recrutées au site d'infection. La moelle osseuse d'un individu sain adulte produit environ 100 milliards de neutrophiles par jour, et environ 10 fois plus au cours d'une infection aigüe.
Les neutrophiles ont un rôle primordial de phagocytose lorsqu'ils rencontrent une cellule étrangère ou infectée. La phagocytose se déroule juste après la stimulation du neutrophile par un antigène porté par la cellule cible (cet antigène étant le plus souvent un fragment de membrane bactérienne ou un fragment de virus, reconnu comme étranger) avec l'émission de pseudopodes (longs prolongements cytoplasmiques) qui vont entourer la cellule cible, et finir par l'inclure dans le corps cellulaire du neutrophile. Là, des vacuoles contenues dans les neutrophiles fusionnent avec la vacuole de phagocytose : leur contenu (lysozyme et granulations sécrétoires) détruit la cellule cible par un mécanisme toxique. Ce processus entraîne la mort du neutrophile, car elle épuise toutes ses réserves en glucose. La phagocytose est favorisée par la mobilité de ces cellules : elles sont capables de se déplacer dans le sang puis dans les tissus vers les foyers d'infection, où elles sont attirées par chimiotactisme (lors d'une infection, les cellules endothéliales, mastocytes et macrophages à proximité libèrent des substances chimiques appelées cytokines, qui attirent les polynucléaires).
Les neutrophiles sont bien plus nombreux que d'autres cellules douées de phagocytose (les macrophages), mais survivent dans le sang bien moins longtemps. Certains spécialistes [Qui ?] du système immunitaire pensent que cette courte durée de vie (qui se termine dès la première phagocytose) est une adaptation évolutive qui permet d'éviter la propagation de pathogènes capables de parasiter les phagocytes. La durée de vie des neutrophiles a été mesurée au moyen de globules blancs marqués par des isotopes radioactifs. Dans la circulation, les neutrophiles ne vivent guère plus de 10 à 12 heures. Dans les tissus, cette durée de vie semble être plus longue (2 à 3 jours). Lorsqu'un neutrophile sort de la circulation, p. ex. pour se rendre vers un foyer inflammatoire, il n'y retourne plus jamais. Lorsqu'un neutrophile meurt, ses fragments sont repris par phagocytose dans le S.R.E.
Décrits pour la première fois en 2004 chez les neutrophiles, les pièges extracellulaires sont la libération de structures en forme de toile après stimulation des neutrophiles par des lipopolysaccharides, l'interleukine 8 et après exposition à des bactéries Gram-positives ou Gram-négatives[32]. Ce piège est formé d'un squelette d'ADN et d' histones. Ces pièges comprennent des molécules à effet antimicrobien, notamment l'élastase, la cathepsine G, les protéinases ou les défensines, protéines augmentant la perméabilité bactérienne (BPI), ou la myéloperoxydase[32],[33].
Depuis il a été démontré que les pièges à ADN ne sont pas formés exclusivement par les neutrophiles mais également par d'autres types de cellules, notamment les mastocytes[34], les éosinophiles[35] et les macrophages/monocytes[36].
Comme les macrophages, les neutrophiles peuvent acquérir soit une activité antitumorale (neutrophiles N1), soit une activité pro-tumorale (neutrophiles N2)[37]. Après une stimulation par des cytokines, les neutrophiles acquièrent la capacité de se polariser en antitumoral (Neutrophil 1 ou N1) ou en pro- phénotype tumoral (Neutrophil 2 ou N2)[38],[37],[39]. Le profil immunitaire des neutrophile associé au tumeur N1 est caractérisé par des niveaux élevés de TNFα, CCL3, ICAM-1 tandis que neutrophiles associé au tumeur N2 sont caractérisés par une régulation positive des chimiokines CCL2, CCL3, CCL4, CCL8, CCL12 et CCL17 et CXCL1, CXCL2, IL-8/CXCL8 et CXCL16 [39].
La plupart des cellules inflammatoires des tumeurs solides sont des neutrophiles et leur densité intra-tumorale élevée est en corrélation avec la présence de métastases ganglionnaires, le grade histologique de la tumeur et le stade clinique[40]. La tumeur et son microenvironnement contrôlent le recrutement des neutrophiles et que les neutrophiles associés aux tumeurs peuvent réguler la progression tumorale ou le contrôle de la croissance tumorale[5].
L'activité N1 contre la croissance tumorale et les métastases est exercée par une cytotoxicité directe ou dépendante des anticorps ainsi que par l'activation de différentes cellules immunitaires innées et adaptatives, notamment les lymphocytes T et B, les cellules tueuses naturelles et les cellules dendritiques[41] présentent une activité NADPH oxydase accrue, ce qui conduit à la production de dérivés réactives de l’oxygène, qui, à leur tour, sont cytotoxiques pour les cellules tumorales[42].
Au contraire, les N2 favorisent, directement ou indirectement, la croissance tumorale ainsi que la dissémination des cellules tumorales en sécrétant des enzymes de remodelage de la matrice extra-cellulaire et des facteurs pro-angiogéniques qui favorisent les métastases et l'angiogenèse[43],[44]
Une baisse de la valeur absolue des neutrophiles est appelée « neutropénie ». Celle-ci peut être congénitale, ou bien plus souvent liée à des facteurs acquis (infection sévère, chimiothérapie, etc.).
Les anomalies fonctionnelles sont le plus souvent héréditaires : les neutrophiles peuvent être incapables de phagocytose.
Le déficit congénital en α1-antitrypsine entraîne un défaut d'inactivation de l'élastase, une des enzymes contenues dans les neutrophiles. L'élastase est une enzyme capable de détruire certains tissus, et cette maladie entraîne des dégâts tissulaires, en particulier dans le poumon (emphysème pulmonaire). Une intoxication tabagique entraîne une inhibition de l'α1-antitrypsine qui a pour rôle de moduler l'action des élastases des neutrophiles. Ceci entraîne une destruction accrue des fibres élastiques du poumon ce qui augmente sa compliance, provoquant un emphysème qui gêne la mécanique ventilatoire.
Le neutrophile peut être sujet à diverses autres anomalies, ces anomalies peuvent être transitoires comme les granulations toxiques, la présence de vacuole dans le cytoplasme ou la présence de corps de Döhle souvent signe d'un état infectieux ou plus sérieuse comme la présence de neutrophile hypersegmenté (le noyau contient 5 lobes ou plus).
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.