Loading AI tools
La médecine de la reproduction est la branche de la médecine étudiant la physiologie de la reproduction ainsi que sa pathologie, l'infertilité. Il s'agit ainsi de l'étude de :
- la bonne capacité des individus et des couples à normalement procréer, tant sur le plan physiologique que psychologique ;
- du diagnostic et des traitements destinés aux couples hypofertiles ou infertiles.
L'OMS définit[1] la santé comme un état de complet, physique, mental et de bien-être social, et non pas seulement l'absence de maladie ou d'infirmité. Cette définition est aussi celle qui a été retenue par la Conférence internationale sur la population et le développement (CIPD) organisée par l'ONU et qui s'est tenue au Caire, en Égypte, du 5 au , qui ne jouit pas du statut d'un instrument juridique international (et n'est donc pas juridiquement contraignant), mais qui a reçu le soutien d'une large majorité d'États-membres de l'ONU.
La médecine de la reproduction s'intéresse à la procréation et donc au fonctionnement de l'appareil reproducteur à tous les stades de la vie (y compris in utero), à la santé sexuelle, à l'hygiène, ainsi qu'à tous les processus, fonctions, systèmes et mécanismes qui facilitent ou au contraire inhibent ou interdisent de la reproduction, pour le couple ou l'individu. Elle s'appuie notamment sur l'éducation sexuelle, le contrôle des naissances, la planification familiale et l'éducation des femmes.
La santé reproductive comprend des aspects préventifs et curatifs, incluant la procréation médicalement assistée pour les personnes jugées infertiles[2],[3].
La fertilité humaine dépend de facteurs variés ;
- aspects génétiques,
- nutrition
- médication
- alcoolisme et exposition à certaines drogues
- comportements sexuels, et donc aspects culturels et socio-psychologiques, émotionnels et contextuels (qualité et conditions de vie…)
- facteurs endocrinologie, du facteur temps, de l'économie, du mode de vie et des émotions
- aspects environnementaux dits de « santé environnementale ». La fertilité des mammifères peut être affectée par l'exposition (éventuellement in utero, ou avant la puberté) à certains polluants. Il peut s'agir de certains métaux lourds et d'autres reprotoxiques ou - même à très faible dose - de certains perturbateurs endocriniens[4], qui peuvent être facteurs directs ou indirects de délétion de la spermatogenèse ou affecter la formation du tractus génital (masculin ou féminin) quand ces polluants affectent l'embryon.
La santé reproductive est un domaine complexe en raison du nombre et de la variété des cocktails de polluants susceptibles d'induire des synergies, potentialisation ou effets directs, avant, pendant ou après le moment de la fécondation.
Comme rappelé par l'ONU via la CIPD en 1994, la santé génésique implique, outre un environnement sain (santé environnementale), que chacun ait la possibilité d'une vie sexuelle satisfaisante et la capacité et liberté de choisir de se reproduire quand il le souhaite et le nombre de fois qu'il le souhaite.
C'est une dimension implicite du droit des hommes et des femmes à être informés et d'avoir accès à des méthodes sûres, efficaces, abordables et acceptables d'accès aux moyens de maîtrise de la fécondité de leur choix et le droit d'accès aux services de soins et de santé appropriés qui permettent aux femmes de conduire au mieux leur maternité (grossesse, accouchement, allaitement…) et donnent aux couples toutes les chances d'avoir un enfant en bonne santé[5].
Les Principes de Jogjakarta se prennent même l'hormonothérapie et la chirurgie de réattribution sexuelle comme les droits de la santé reproductive dans son Principe 9[6].
Parmi les facteurs de santé pour la mère, on peut citer
- de bonnes conditions de planification familiale
- que la mère ait au moins 18 ans avant d'essayer d'avoir des enfants [7].
- Si un enfant supplémentaire est désiré, il est considéré comme plus sûr et plus sain pour la mère, ainsi que pour l'enfant qui vient, d'attendre au moins 2 ans après la naissance précédente avant d'essayer de concevoir un enfant (mais pas plus de 5 ans). Après une fausse-couche ou un avortement, il est plus sain d'attendre au moins 6 mois[7].
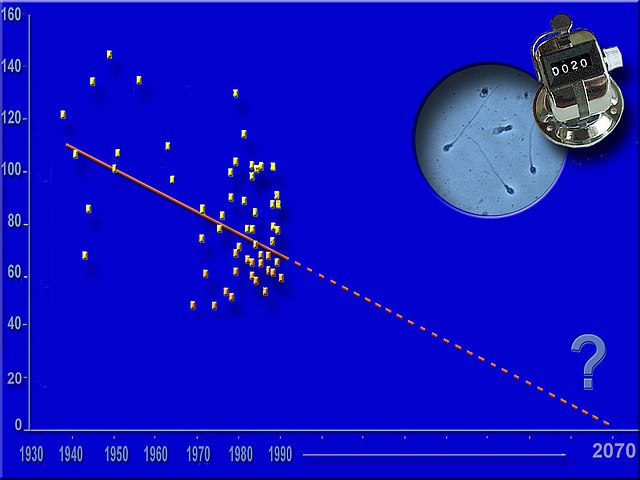
Tendance au déclin continu de la spermatogenèse
(dans les pays riches)
Contrôle du diaporama sous la légende
(dans les pays riches)
Contrôle du diaporama sous la légende

Après ajustement (âge et durée de l'abstinence sexuelle), sur ces 20 ans, chaque nouvelle génération (par année civile de naissance) a perdu 2,6 % des spermatozoïdes de la cohorte née l'année précédente, et le taux de spermatozoïdes mobiles a diminué de 0,3 % par an, et celui des spermatozoïdes de forme normale a diminué de 0,7 %/an.
Parallèlement, la proportion de spermatozoïdes normalement mobiles chutait de 0,6 %/an et celle des spermatozoïdes normalement conformés diminuait de 0,5 % par an[8]
La fertilité masculine dépend de la quantité et de la qualité des spermatozoïdes, qui dépend elle-même fortement de la qualité fonctionnelle de l'appareil génital et reproducteur, et en particulier des tubes séminifères contenant les cellules germinales et les cellules de Sertoli. Ces deux types de cellules se mettent en place chez l'embryon et se développeront sous l'action de la testostérone.
L'exposition du fœtus ou de l'embryon à certains toxiques (uranium par exemple) ou perturbateurs endocriniens ou d'autres produits dits reprotoxiques pour l'homme peut affecter ce processus, de manière irréversible pour le futur adulte. Ils peuvent aussi inhiber la bonne Migration du testicule ou induire des malformations graves du pénis rendant la reproduction difficile.
Dégradation de la qualité du sperme
Dans le monde, cette question est un enjeu aujourd'hui reconnu[9] ; mais le nombre moyen de spermatozoïdes produits par mL de sperme varie selon les régions et les pays, de même que le degré de déclin de la qualité du sperme[10], dont au sein de l'Europe[11]. Ces variations géographiques ont des causes encore mal comprises, mais peut-être en partie dues à des biais statistiques induits par des différences dans les méthodes de comptages des spermatozoïdes[12]. Ces biais devraient se réduire grâce à des méthodes de plus en plus homogènes ou normalisées d'évaluation, promues par l'OMS[13],[14],[15],[16] et divers experts[17],[18], dont en Europe dans le cadre d'une étude SEMen QUAlity (SEMQUA)[19].
Depuis le milieu du XXe siècle, un déclin global et régulier de la quantité et /ou la qualité du sperme humain est constaté par de nombreuses études faites dans les pays riches[20],[21],[22],[23],[24],[25],[26],[27] alors que d'autres études (également faites chez les hommes de couples infertiles ou fertiles, dans d'autres régions ou les mêmes) ne détectent pas de déclin[28],[29],[30],[31],[32],[33],[34],[35].
Si l'on considère que les Suédois correspondent à une moyenne européenne, des spermogrammes réalisés chez un large échantillon de jeunes Suédois dont le sperme a été étudié, donnent les résultats suivants :
- Pour un volume testiculaire moyen (moyenne médiane) de 29 ml (et plus précisément de 13 à 53 ml selon les individus), le volume moyen de sperme produit était de 3,2 ml (de 0,3 à 8,4 ml selon les individus), ce sperme ayant été recueilli après une période d'abstinence moyenne de 67 h (moyenne médiane, correspondant à une abstinence de 12 à 504 h selon les cas) contenait 54 millions de spermatozoïdes (de 0,1 à 390 millions selon les individus), avec un nombre total de spermatozoïdes par éjaculat de 167 millions (de 0,5 à 1200 millions)[36].
Plusieurs études ont conclu que le déclin de la qualité du sperme affectait la fécondité générale de la population[37],[38],[39].
Et au moins trois études (Holden, 2008[40]) ; Jensen et al., 2009[41] ; Li et al., 2011[42]) ont conclu à l'existence d'un lien statistiquement significatif entre la qualité du sperme et l'espérance de vie d'un homme ainsi qu'avec son niveau d'intelligence.
En France un déclin de qualité est aussi constaté :
- Une étude du CECOS de Tours a porté sur 1.114 candidats (fertiles) au don de sperme de 1976 à 2009 (près de 35 ans), avec étude du volume de sperme, du taux de spermatozoïde, de la motilité et vitalité des spermatozoïdes et du taux de formes anormales et du type d'anomalies du premier éjaculat de cette population.
Si (en plus de 20 ans), il n'a pas été constaté de baisse du volume de sperme, le nombre total de spermatozoïdes a fortement chuté (passé de 443,2 millions en 1976 à 300.200.000 en 2009), de même que la motilité (de 64 % en 1976 à 49 % en 2009). La vitalité de spermatozoïdes a aussi diminué (de 88 % à 80 %). En outre, le taux de formes normales (noté de 1976 à 1997 est passé de 67 % à 26 % avec une augmentation régulière de l'indice d'anomalies multiples de 1998 à 2009 (de 1,19 à 1,65)[43]. - Dans une autre étude, des échantillons de sperme récoltés (après 3-6 jours d'abstinence sexuelle) chez 10 932 partenaires masculins (de 5 462 couples infertiles) ont été analysés pour évaluer les variations temporelles de qualité du sperme de 1988 à 2007. Les facteurs mesurés sont le volume, le pH, la concentration en spermatozoïdes, le nombre total de spermatozoïdes, la motilité et la morphologie des spermatozoïdes. Ces paramètres ont été comparés avec ceux d'hommes présentant une numération totale normale (≥ 40 millions de spermatozoïdes par éjaculat).
Les résultats montrent qu'en un peu moins de 20 ans, dans toute la population masculine, il y a eu une baisse de la concentration du sperme en spermatozoïdes (-1,5 % par an en moyenne). Le nombre total de spermatozoïdes a chuté de 1,6 % par an en moyenne alors que leur motilité totale diminuait de 0,4 %/an, et la « motilité rapide » de 5,5 % par an. Le taux de spermatozoïdes morphologiquement normaux a diminué de 2,2 % par an dans le même temps. Chez les personnes présentant un nombre normal total de spermatozoïdes normale totale, des tendances identiques ont été constatées pour la qualité du sperme au cours du temps[44].
La qualité génétique de l'ADN porté par les spermatozoïdes

Elle dépend de la qualité de l'appareil reproducteur, laquelle dépend de l'ADN de l'individu (dont le génome pouvait être initialement éventuellement porteur de mutations délétères). Elle dépend aussi de l'âge et de facteurs de santé environnementale.
Le génome transporté par le spermatozoïde s'altère progressivement avec l'âge du donneur, augmentant le risque de stérilité, de grossesses infructueuses, de nanisme de l'enfant et éventuellement d'autres maladies génétiques touchant l'enfant. Et, pour certaines anomalies, certaines populations produisent un sperme plus dégradé que d'autres[45].
Diverses études[45], notamment nord-américaines ayant porté sur des hommes considérés comme en bonne santé ont montré que :
- le nombre et la motilité des spermatozoïdes diminuent avec l'âge du donneur ;
- l'aptitude d'un spermatozoïde à nager en ligne droite diminue aussi avec l'âge du donneur et ce, de manière fortement corrélée avec le taux de fragmentation de l'ADN ;
- Plus un donneur est âgé, plus l'ADN transporté par ses spermatozoïdes est altéré. Par exemple, selon Andrew Wyrobek, le gène impliqué dans l'achondroplasie (codant le récepteur 3 des facteurs de croissance des fibroblastes, ou FGFR 3), également impliqué dans le nanisme est notamment plus souvent et de plus en plus lésé avec l'âge du donneur, avec en moyenne une augmentation de 2 % par année d'âge des mutations de ce gène. L'augmentation du nombre de mutations (moindre intégrité de la chromatine, mutations génétiques, et aneuploïdies) est déjà observable chez les jeunes hommes, dès les premières années de procréation, et se poursuit tout au long de la vie.
- Les hommes se reproduisant tardivement ont plus de difficultés à concevoir, et « pourraient également augmenter le risque d'avoir des enfants avec des problèmes génétiques », et « diminuer leurs chances d'avoir des descendants viables en bonne santé » selon Andrew Wyrobek du LLNL et Brenda Eskenazi spécialiste en santé publique[45]. Ceci expliquerait que les anomalies génétiques les plus courantes transmises par les hommes vieillissant ne sont pas les mêmes que celles transmises par les femmes (qui en vieillissant voient augmenter le risque de faire un enfant porteur du syndrome de Down et d'autres formes de trisomies ou monosomies - comme le syndrome de Klinefelter, syndrome de Turner ou syndrome du triple X chez leurs descendants - qui sont associés à divers types d'infertilité ou d'anomalies irréversibles (physiques et neurologiques) du descendant. Ces risques ne sont pas corrélés à l'âge du père.
- Certaines anomalies génétiques sont plus fréquentes chez les enfants d'hommes plus âgés, mais uniquement chez certains groupes d'hommes[45]. C'est par exemple le cas du syndrome d'Apert (anomalie congénitale défigurante et grave) ; Le gène muté responsable de ce syndrome (FGFR2) augmente avec l'âge dans les spermatozoïdes d'un groupe d'hommes recrutés dans le centre-ville de Baltimore par des chercheurs de Johns Hopkins Medical Center, alors qu'aucun effet lié à l'âge n'était constaté chez un autre groupe d'hommes recrutés en Californie[45].
Ceci suggère que des facteurs ethniques, environnementaux et/ou socio-économiques pourraient aggraver les effets de l'âge sur la qualité génétique du sperme[45].
Ceci signifie aussi que la qualité génomique du sperme ne peut pas être évaluée en ne testant qu'un seul spermatozoïde ou un trop petit nombre de spermatozoïdes, ceci d'autant plus que le donneur est âgé[45].
Le taux de cas de sous-fertilité masculine
Il varie également selon les régions, comme la qualité du sperme[46].
La sous-fertilité peut notamment être induite par une exposition excessive à des métaux. Par exemple, le plomb est connu pour diminuer la fertilité masculine ; Le mercure également (consommé avec plus de quatre repas de poisson par semaine à Hong Kong ; les consommateurs qui avaient des taux de mercure plus élevés dans les cheveux étaient les plus touchés (avec également des problèmes de peau et des autismes plus fréquent chez les enfants qui ont les plus hauts taux de mercure mesuré dans le sang, les cheveux et l'urine)[47].
Les Amérindiens d'Aamjiwnaang, dans une réserve située au cœur de la « chemical valley » du Canada, exposés au mercure, dioxines, HCBs ou PCBs connaissent une modification du sex ratio de leurs enfants : Constanze MacKenzie, de l'université d'Ottawa, a montré que le ratio à la naissance est passé de un garçon pour une fille en 1984 à un garçon pour deux filles en 1999. En outre, le taux de fausses couches est de 39 % contre 25 % habituellement et 23 % des enfants de moins de 16 ans souffrent d'ADHD (hyperactivité avec déficit d'attention), au lieu de 4 % habituellement.
Elle est liée à la bonne conformation des organes reproducteurs, processus, qui comme chez le garçon est pour partie acquis in utero, mais aussi au bon fonctionnement des cycles hormonaux.
À la différence de l'homme, la femme est fertile quelques jours par mois, pendant la « période fertile » ou « fenêtre de fertilité ».
Certaines mutations génétiques, dont celles induites par l'exposition in utero à un reprotoxique (distilbène par exemple) peuvent affecter la fertilité de générations successives de descendants.
La Conférence internationale sur la population et le développement
Le Programme d'action de la CIPD a en 1994 approuvé une nouvelle stratégie portant l'accent sur les liens entre population et développement et se concentre sur la satisfaction des besoins individuels des femmes et des hommes plutôt que sur la réalisation des objectifs démographiques[48].
La CIPD a obtenu un consensus sur quatre objectifs qualitatifs et quantitatifs pour la communauté internationale. Les deux derniers ont un intérêt particulier pour la santé génésique :
- Réduction de la mortalité maternelle : réduction des taux de mortalité maternelle et la réduction des disparités dans la mortalité maternelle dans les pays et entre les régions géographiques, les groupes socio-économiques et ethniques.
- L'accès aux services de santé génésique et sexuelle, y compris la planification familiale : le conseil pour la planification familiale, les soins prénataux, l'accouchement sans risques et les soins post-nataux, la prévention et le traitement approprié de la stérilité, la prévention de l'avortement par un meilleur accès aux moyens de contraception et à l'information sexuelle et la gestion des conséquences de l'avortement, le traitement des infections du tractus génital, la lutte contre les maladies sexuellement transmissibles, la promotion des conditions de santé reproductive via notamment l'éducation, le conseil sur la sexualité humaine, la santé reproductive et la responsabilité parentale. Des services suffisants et pertinents concernant le SIDA, le cancer du sein, l'infertilité, l'accouchement et l'avortement devrait être mis à disposition de toute la population. Le découragement actif des mutilations génitales féminines (MGF) est également promu.
La principale clé de cette nouvelle approche est l'autonomisation des femmes qui doivent bénéficier de plus de choix grâce à : un accès élargi aux services éducatifs et de santé, la promotion du développement des compétences, et un meilleur accès à l'emploi.
Ce Programme plaide pour une planification familiale universellement accessible (à mettre en place par les États avant 2015).
Objectifs du millénaire pour le développement
Un accès universel à la santé génésique d'ici 2015 est aussi l'une des deux cibles de l'Objectif 5 du millénaire (améliorer la santé maternelle) parmi les huit Objectifs du millénaire pour le développement.
Pour surveiller les progrès mondiaux vers la réalisation de cet objectif, l'Organisation des Nations unies a convenu des indicateurs suivants (que chaque État doit fournir à l'ONU) :
- 5.3: Taux de prévalence de la contraception
- 5.4: Taux de natalité chez les adolescentes
- 5.5: taux de couverture des soins prénatals
- 5.6: besoins non satisfaits en planification familiale
Selon le Rapport d'avancement des OMD, les statistiques régionales sur les quatre indicateurs se soit améliorées ou sont demeurées stables entre les années 2000 et 2005. Toutefois, des progrès ont été lents dans la plupart des pays en développement, particulièrement en Afrique sub-saharienne, qui reste la région dont les indicateurs de la santé procréative sont les plus faibles. Selon l'OMS en 2005, on estime que 55 % des femmes n'ont pas suffisamment de soins prénatals et 24 % n'ont pas accès aux services de planification familiale
La santé reproductive prend de l'importance dans le domaine de la santé publique, car les problèmes d'infertilité augmentent, et la production moyenne de spermatozoïdes ne cesse de décroître dans les pays riches (seuls pays à faire l'objet d'études), au moins depuis la seconde moitié du XXe siècle (au rythme des 30 dernières années, en 2070, si ce déclin observé dans les pays riches devait se poursuivre, la production moyenne de spermatozoïdes viables y sera proche de zéro[49].
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.